CHEM 101 – Elektrolyten
ALGEMENE CHEMESTIE TOPICS
Elektrolyten
Dissociatie van ionische verbindingen in water resulteert in de vorming van mobiele waterige ionische species.Chemische vergelijkingen voor oplossen en dissociëren in water. Sterke en zwakke elektrolyten.
Electrolyten (muzikale begeleiding bij dit onderwerp) zijn stoffen die ionische soorten in waterige oplossing doen ontstaan. Het bestaan van ladingsdragers in oplossing kan door middel van een eenvoudig experiment worden aangetoond. De geleidbaarheid van waterige media kan worden waargenomen met behulp van een paar elektroden, verbonden met een spanningsbron, die in de oplossing zijn ondergedompeld. De stroom die de oplossing dan geleidt kan gemakkelijk worden gemeten, en een gloeilamp kan worden gebruikt als een visuele indicator van de geleidbaarheid van een oplossing.
Wanneer dit experiment wordt uitgevoerd met zuiver water, gloeit de gloeilamp helemaal niet. Water geleidt zelf niet gemakkelijk elektriciteit; het is een voorbeeld van een moleculaire stof die een niet-elektrolyt is. Dit geldt ook voor veel andere moleculaire stoffen. Zo is bijvoorbeeld tafelsuiker (sucrose, C12H22O11) – goed oplosbaar in water, maar een suikeroplossing geleidt elektriciteit blijkbaar niet beter dan water alleen. Wanneer we daarentegen het experiment uitvoeren met een vrij oplosbare ionische verbinding zoals natriumchloride, dan gloeit de gloeilamp helder.
Laten we weergeven wat we denken dat er aan de hand is met deze tegengestelde gevallen van het oplossen van een moleculaire en een ionische verbinding door de volgende chemische vergelijkingen op te stellen:
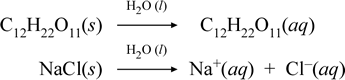
De eerste vergelijking hierboven stelt het oplossen voor van een niet-elektrolyt, de moleculaire verbinding sucrose. Het belangrijkste onderscheid tussen de twee scheikundige vergelijkingen in dit geval is de vorming in de laatste van waterige ionische stoffen als producten. De ionen zijn vrij om individueel te diffunderen in een homogeen mengsel, en wanneer een spanning wordt aangelegd, zullen de ionen zich verplaatsen volgens het elektrische potentiaal-energieverschil tussen de elektroden, en zo elektrische stroom geleiden. Merk op dat water niet is weergegeven aan de kant van de reactant van deze vergelijkingen, maar in plaats daarvan is weergegeven boven de pijl, wat aangeeft dat water het milieu bepaalt waarin het oplossingsproces plaatsvindt. De superstoichiometrische status van water in deze symboliek kan worden gelezen als een oplossingsproces dat plaatsvindt met water als oplosmiddel. Wij zullen water niet schrijven als reactant bij de vorming van een waterige oplossing door een eenvoudig oplossingsproces. Er zijn vele gevallen waarin een stof reageert met water wanneer deze zich mengt met en oplost in water. Deze reactie van een opgeloste stof in een waterige oplossing geeft aanleiding tot chemisch verschillende producten. In dergelijke gevallen kan water expliciet in de chemische vergelijking worden weergegeven als een reagerende soort.
Sterke en zwakke elektrolyten
Het blijkt dat wanneer een oplosbare ionische verbinding zoals natriumchloride in water oplost om een waterige oplossing te vormen die bestaat uit opgeloste ionen, de pijl naar rechts die in de chemische vergelijking wordt gebruikt gerechtvaardigd is in die zin dat (zolang de oplosbaarheidsgrens niet is bereikt) het vaste natriumchloride dat aan het oplosmiddel water wordt toegevoegd volledig dissocieert. Met andere woorden, effectief is er 100% omzetting van NaCl(s) in Na+(aq) en Cl-(aq). Als gevolg hiervan is in ons geleidbaarheidsexperiment een natriumchloride-oplossing zeer geleidend door de overvloed aan ionen, en de gloeilamp gloeit helder. In zo’n geval zeggen we dat natriumchloride een sterk elektrolyt is.
Neem daarentegen de moleculaire stof azijnzuur, HC2H3O2.Wanneer azijnzuur wordt opgelost in water, vormt het een ongebonden, opgeloste, moleculaire soort, gesymboliseerd als HC2H3O2(aq), vergelijkbaar met het geval met sucrose hierboven. Wanneer we echter onze geleidbaarheidstest uitvoeren met een azijnzuuroplossing, zien we dat de gloeilamp gloeit, zij het tamelijk zwak in vergelijking met de helderheid die is waargenomen bij de natriumchloride-oplossing. In dit geval moet er op zijn minst een gedeeltelijke vorming van ionen uit azijnzuur in water plaatsvinden. Een chemische vergelijking die dit proces weergeeft moet de productie van ionen laten zien. Een redelijk voorstel voor zo’n vergelijking zou zijn:
![]()
Twee dingen zijn hier belangrijk om op te merken. Ten eerste is dit een geval waarin we water als reactant opnemen. De twee moleculaire stoffen, water en azijnzuur, reageren tot de polyatomische ionen hydronium en acetaat. De vergelijking die dit weergeeft is een ionische vergelijking. Het tweede kenmerk dat nadere bespreking verdient is de vervanging van de pijl naar rechts door het symbool van de dubbele pijl met enkele streep, dat een chemisch evenwicht aangeeft en in dit geval is de evenwichtstoestand voor de reactie in het voordeel van de reactanten, wat betekent dat in een waterige oplossing van azijnzuur het grootste deel van het azijnzuur als azijnzuurmoleculen overblijft, waarbij slechts een klein deel op enig moment H+ heeft afgestaan aan water om de ionen te vormen. Het kleine aantal geproduceerde ionen verklaart waarom de azijnzuuroplossing niet zo goed elektriciteit geleidt als de natriumchloride-oplossing, met als gevolg slechts een zwakke oplichting van het lampje van onze geleidbaarheidsdetector. Wij maken dus onderscheid tussen sterke elektrolyten, zoals natriumchloride, en azijnzuur, dat een voorbeeld is van een zwakke elektrolyt.
Zoals de naam azijnzuur suggereert, is deze stof ook een zuur, en tevens een zwakke elektrolyt. Dienovereenkomstig classificeren wij azijnzuur als een zwak zuur. Onze eerste (en minst algemene) definitie van een zuur is een stof die in water hydronium-ionen doet ontstaan, en dat is precies wat onze ionenvergelijking hierboven laat zien, in aanmerking genomen dat een zwak zuur relatief kleine hoeveelheden hydronium-ionen doet ontstaan.
Chemici zijn erg dol op afkortingen, en een belangrijke afkorting voor hydroniumion is H+(aq), en deze wordt vaak gebruikt. Dit is te zien in de afgekorte versie van de bovenstaande vergelijking die hieronder is weergegeven. Voor alle duidelijkheid, H+ zelf zou slechts een geïsoleerd proton zijn (voor 1H); het is dus ook belangrijk op te merken dat een dergelijke soort niet bestaat in een waterige oplossing.
Daarnaast zijn de pijlen van ongelijke lengte gemaakt om het reactant-gezinde evenwicht aan te geven, waarin er veel minder ionen dan azijnzuurmoleculen zijn.
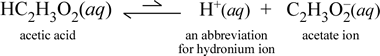
Door hydronium voor te stellen als H+(aq), is de ionische vergelijking voor azijnzuur in water formeel in evenwicht zonder een watermolecuul als reactant op te nemen, wat impliciet is in de bovenstaande vergelijking.
Ammoniak: Een voorbeeld van een zwakke elektrolyt die een zwakke base is
Azijnzuur zoals we zojuist hebben gezien is een moleculaire verbinding die zwak zuur en elektrolyt is. Ammoniak, NH3, een andere eenvoudige moleculaire verbinding, reageert ook in geringe mate met water, waarbij ammonium- en hydroxide-ionen worden gevormd. Onze eerste, minst algemene definitie van een base is een stof die in water hydroxide-ionen doet ontstaan. Ammoniak is dus een zwakke base en geleidt, net als azijnzuur, elektriciteit lang niet zo goed als waterig zout. Dus ammoniak is ook een zwakke elektrolyt.
![]()
De symboliek van onze chemische vergelijking geeft opnieuw een reactant-gezind evenwicht aan voor de zwakke elektrolyt.
Uitbreidingen en verbanden
Een meer kwantitatieve benadering van evenwichten gebruikt zwakke zuren en zwakke basen als belangrijke voorbeelden.




