CNIO, nieuwe stappen voor een toekomstige therapie tegen leeftijdsgebonden longfibrose
De Telomeres and Telomerase Group van het Spaanse National Cancer Research Centre (CNIO) heeft een effectieve therapie aangetoond bij muizen met fibrose door veroudering, nadat dezelfde remedie was ontwikkeld voor muizen met fibrose door genetische fouten. In de studie, die is gepubliceerd in het Journal of Cell Biology, wordt een gentherapie ontwikkeld die de productie van telomerase door het lichaam activeert.
Idiopathische longfibrose is een onbehandelde en potentieel dodelijke ziekte die samenhangt met bepaalde mutaties en ook met veroudering.
Telomerase is het enzym dat verantwoordelijk is voor de reparatie van de uiteinden van chromosomen, waar de telomeren zich bevinden. De therapie was zeer doeltreffend bij dieren en er werden geen bijwerkingen waargenomen. Dit werd toegelicht door studieleider Maria Blaso.
“Als we aan mensen denken, wijst ons resultaat op de mogelijkheid om een therapie te ontwikkelen die de ontwikkeling van longfibrose, die gepaard gaat met veroudering, bij elke patiënt kan voorkomen,” zegt Blasco.
Telomeerdisfunctie aan de oorsprong van fibrose
Pulmonale fibrose treft ongeveer 8.000 mensen in Spanje. Bij deze ziekte ontwikkelt het longweefsel littekenvorming en wordt het stijf, wat leidt tot een progressief verlies van ademhalingscapaciteit.
De oorzaak wordt toegeschreven aan een combinatie van genetica en milieu: toxines in het milieu spelen een belangrijke rol, maar om de ziekte tot uiting te laten komen moet er ook een genetische oorzaak zijn of veroudering in verband met het verstrijken van de tijd.
De CNIO-groep had in eerdere studies al aangetoond dat deze genetische oorzaak ligt in het niet goed functioneren van telomeren. Telomeren zijn structuren die, net als doppen, de integriteit beschermen van de chromosomen die in alle cellen aanwezig zijn.
In 2015 creëerden ze een diermodel voor longfibrose, een muis die het telomerase-gen mist. Bij deze dieren sterven de cellen die verantwoordelijk zijn voor de regeneratie van longweefsel, de zogeheten alveolaire pneumocyten van type II, uiteindelijk af door disfunctie van de telomeren. De muis ontwikkelt daardoor agressieve fibrose, omdat het epitheel van zijn longen zich niet periodiek kan vernieuwen. Het is deze periodieke regeneratie die het weefsel gezond houdt, vrij van schade door milieu-toxines.
Fibrose geassocieerd met veroudering
Dit diermodel zonder het telomerase gen reproduceert goed wat er gebeurt bij patiënten bij wie de fibrose te wijten is aan mutaties die de telomeren aantasten. Maar deze mensen zijn in de minderheid. Bij de overgrote meerderheid van de patiënten wijst niets op een specifieke mutatie, maar er is één factor die al deze patiënten gemeen hebben: hoge leeftijd.

Telomeren kunnen hun functie ook verliezen door het verouderingsproces alleen al. De studie van hoe dit gebeurt wordt internationaal geleid door Blasco’s groep.
Telomeren zijn eiwitkapjes aan de uiteinden van chromosomen, en ze worden elke keer dat de cel zich deelt een beetje korter. Daarom komt er na vele celdelingen tijdens het leven van het organisme een punt waarop de chromosomen zo kort worden dat zij niet langer in staat zijn de chromosomen te beschermen. De cel interpreteert dit als een fout en stopt met delen, zodat het weefsel niet regenereert.
In het nu gepubliceerde werk hebben de onderzoekers aangetoond dat deze leeftijdsgebonden telomeer disfunctie inderdaad voorkomt in de regeneratieve cellen van longweefsel, de type II pneumocyten. Zij vinden aldus de moleculaire oorzaak van het verband tussen veroudering en longfibrose, dat in de kliniek zo duidelijk is.
Verlies van longsmeer
Volgens de auteurs is “een van de successen van het nieuwe werk het zeer gedetailleerd beschrijven van de effecten van veroudering op het longweefsel”. “Een daarvan vloeit rechtstreeks voort uit het feit dat type II pneumocyten stoppen met hun werk,” zegt Sergio Piñeiro, eerste auteur van het artikel.
Naast het regenereren van weefsel, maken en geven deze cellen een vloeistof af die het mechanische werk van de long vergemakkelijkt, genaamd pulmonale surfactant.
“Het longweefsel moet zich bij elke ademhaling openen, tussen de zes en tien keer per minuut, wat vanuit fysisch oogpunt een grote inspanning is,” verklaarde Jesús Pérez-Gil, een deskundige aan de Complutense Universiteit van Madrid.
Gil, die aan de studie meewerkte en wiens team een expert is op dit gebied, wijst erop dat “long surfactant essentieel is voor het smeren van het weefsel, waardoor het zich met minimale inspanning kan openen en sluiten, en het elastisch blijft”.
“Als type II pneumocyten niet regenereren, doet surfactant dat ook niet, en dit draagt bij tot het progressief stijf en fibrotisch worden van de long”
Complutense Universiteit van Madrid, Jesús Pérez-Gil
In deze studie “hebben we een zeer duidelijk verband waargenomen tussen de telomeerstatus van type II pneumocyten, de pulmonale surfactantproductie en de ontwikkeling van fibrose bij dieren”, voegt Pérez-Gil eraan toe. “In deze samenwerking pakken we op een gecombineerde manier de effecten op moleculaire schaal aan, op telomeren; de biologische en fysieke veranderingen in cellen en weefsels; en de gevolgen voor de gezondheid van het dier, het hele organisme.”
Een therapie voor alle soorten fibrose
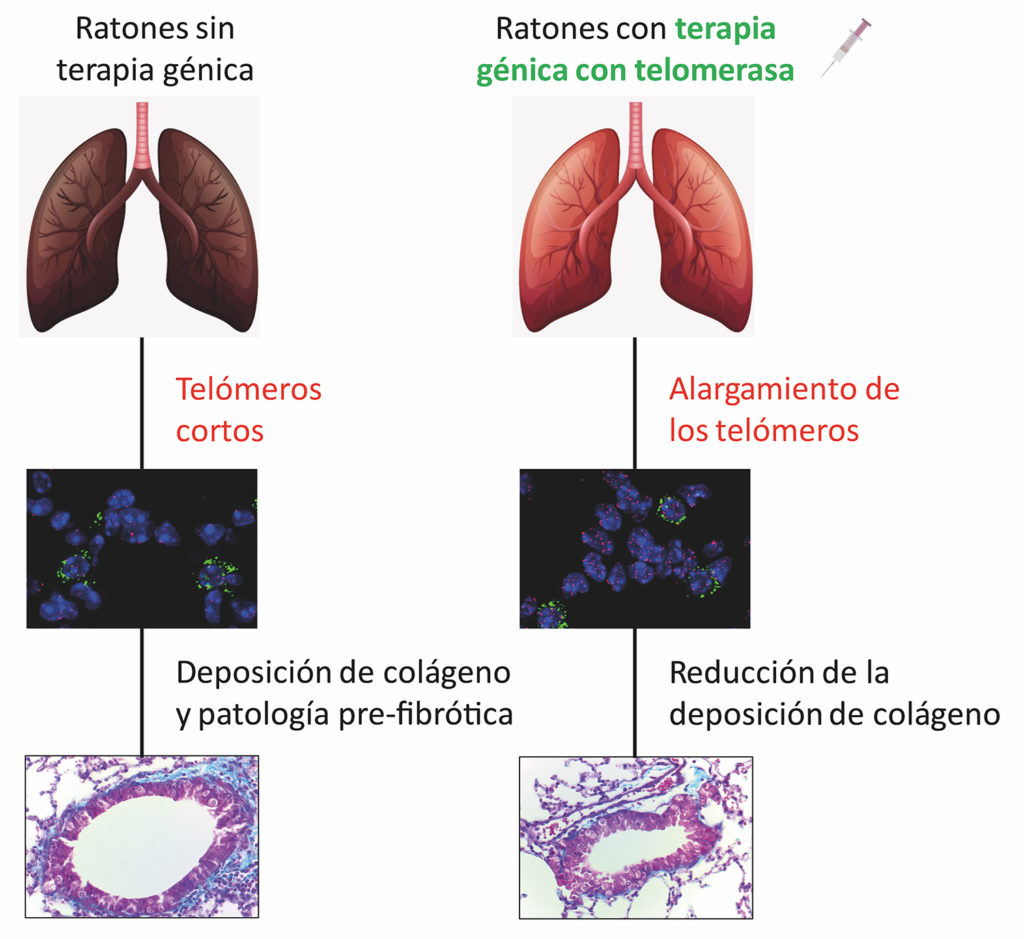
In 2018 ontwikkelde de CNIO-groep een gentherapie die in staat is om de fibrose te genezen die hun muizen ontwikkelden zonder het telomerase-gen. De behandeling is gebaseerd op het ongedaan maken van deze genetische verandering, waarbij de synthese van telomerase in de muizen tijdelijk wordt geactiveerd.

Muizen krijgen intraveneus een virus toegediend dat als enige functie heeft het telomerase-gen naar de weefsels te brengen. Het effect is van korte duur, maar het is voldoende om ervoor te zorgen dat de pneumocyten van type II weer lange telomeren krijgen en dat het longweefsel regenereert.
Nu hebben ze diezelfde therapie toegepast op muizen die gewoon ouder worden. En het werkt nog ook. “Behandeling met telomerase-activerende gentherapie voorkwam het begin van fibrose bij alle muizen, ook bij muizen die geen genetische verandering hadden maar fysiologisch verouderden,” legt Blasco uit.
Dit breidt de mogelijkheid van genezing van longfibrose uit tot bijna alle gevallen van fibrose, zoals de onderzoekers in hun artikel concluderen: “Deze bevindingen helpen om het belang van de voor toekomstige therapeutische strategieën tegen idiopathische longfibrose te verklaren.
De studie werd gefinancierd door het Spaanse ministerie van Wetenschap, Innovatie en Universiteiten, het Carlos III Institute of Health, de Gemeenschap van Madrid, de Botín Foundation en Banco Santander via Santander Universities en World Cancer Research.
De studie werd gefinancierd door het Spaanse ministerie van Wetenschap, Innovatie en Universiteiten, het Carlos III Institute of Health, de Gemeenschap van Madrid, de Botín Foundation en Banco Santander via Santander Universities en World Cancer Research.




