CHEM 101 – Elektrolyty
VŠEOBECNÁ TÉMATA Z CHEMIE
Elektrolyty
Disociace iontových sloučenin ve vodě vede ke vzniku pohyblivých vodných iontů.Chemické rovnice pro rozpouštění a disociaci ve vodě. Silné a slabé elektrolyty.
Elektrolyty (hudební doprovod k tomuto tématu) jsou látky, které vytvářejí ve vodném roztoku iontové druhy. Existenci nosičů náboje v roztoku lze prokázat pomocí jednoduchého experimentu. Vodivost vodných prostředí lze pozorovat pomocí dvojice elektrod připojených ke zdroji napětí, které jsou ponořeny do roztoku. Pak lze snadno změřit proud, který roztok vede, a jako vizuální indikátor vodivosti roztoku lze použít žárovku.
Pokud se tento pokus provádí s čistou vodou, žárovka vůbec nesvítí. Voda sama o sobě nevede snadno elektrický proud; je příkladem molekulární látky, která je neelektrolytem. To platí i pro mnoho dalších molekulárních látek. Například stolní cukr (sacharóza, C12H22O11) – je ve vodě docela dobře rozpustný, ale roztok cukru zřejmě nevede elektřinu lépe než samotná voda. Na druhou stranu, když provedeme pokus s volně rozpustnou iontovou sloučeninou, jako je chlorid sodný, žárovka jasně svítí.
Představme si, co si myslíme, že se děje v těchto kontrastních případech rozpouštění molekulární a iontové sloučeniny, zápisem následujících chemických rovnic:
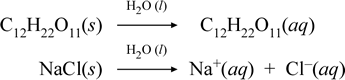
První výše uvedená rovnice představuje rozpouštění neelektrolytu, molekulární sloučeniny sacharózy. Druhá rovnice představuje rozpouštění iontové sloučeniny, chloridu sodného. klíčovým rozdílem mezi oběma chemickými rovnicemi je v tomto případě vznik vodných iontových forem jako produktů. Ionty mohou v homogenní směsi volně difundovat jednotlivě, a když se přiloží napětí, budou se ionty pohybovat podle rozdílu elektrické potenciální energie mezi elektrodami, a povedou tak elektrický proud. Všimněte si, že na straně reaktantů těchto rovnic není zobrazena voda, ale je zobrazena nad šipkou, což naznačuje, že voda určuje prostředí, ve kterém proces rozpouštění probíhá. Superstochiometrický status vody v této symbolice lze číst jako proces rozpouštění probíhající s vodou jako rozpouštědlem. Vodu nebudeme psát jako reaktant při vzniku vodného roztoku prostým procesem rozpouštění. Existuje mnoho případů, kdy látka reaguje s vodou, když se s ní mísí a rozpouští se v ní. Při této reakci rozpuštěné látky ve vodném roztoku vznikají chemicky odlišné produkty. V takových případech lze vodu v chemické rovnici explicitně zobrazit jako druh reaktantu.
Silné a slabé elektrolyty
Ukazuje se, že když rozpustná iontová sloučenina, jako je chlorid sodný, podléhá rozpouštění ve vodě za vzniku vodného roztoku složeného ze solvatovaných iontů, je šipka doprava použitá v chemické rovnici oprávněná v tom, že (dokud nebylo dosaženo meze rozpustnosti) pevný chlorid sodný přidaný do vody s rozpouštědlem zcela disociuje. Jinými slovy, ve skutečnosti dochází ke 100% přeměně NaCl(s) na Na+(aq) a Cl-(aq). V důsledku toho je v našem vodivostním experimentu roztok chloridu sodného díky velkému množství iontů vysoce vodivý a žárovka jasně svítí. V takovém případě říkáme, že chlorid sodný je silný elektrolyt.
Naproti tomu uvažujme molekulární látku kyselinu octovou, HC2H3O2.Když je kyselina octová rozpuštěna ve vodě, tvoří nedisociovaný, solvatovaný, molekulární druhsymbolizovaný jako HC2H3O2(aq), podobně jako ve výše uvedeném případě se sacharosou. Když však provedeme naši zkoušku vodivosti s roztokem kyseliny octové, zjistíme, že žárovka svítí, i když poměrně slabě ve srovnání s jasem pozorovaným u roztoku chloridu sodného. V tomto případě musí docházet alespoň k částečné tvorbě iontů z kyseliny octové ve vodě. Chemická rovnice znázorňující tento proces musí ukazovat vznik iontů. Rozumný návrh takové rovnice by byl:
![]()
Důležité je zde poznamenat dvě věci. Za prvé, jedná se o případ, kdy jako reaktant zahrnujeme vodu. Dvě molekulární látky, voda a kyselina octová, reagují za vzniku mnohoatomových iontů hydronia a octanu. Rovnice, která to vyjadřuje, je iontová rovnice. Druhým rysem, který si zaslouží další diskusi, je nahrazení šipky vpravo symbolem dvojité jednosměrné šipky, což znamená chemickou rovnováhu a v tomto případě je rovnovážný stav reakce ve prospěch reaktantů, což znamená, že ve vodném roztoku kyseliny octové zůstává většina kyseliny octové ve formě molekul kyseliny octové, přičemž pouze malá část v každém okamžiku odevzdala H+ vodě za vzniku iontů. Malý počet vzniklých iontů vysvětluje, proč roztok kyseliny octové nevede elektrický proud tak dobře jako roztok chloridu sodného, což má za následek pouze slabé osvětlení žárovky našeho detektoru vodivosti. Proto rozlišujeme silné elektrolyty, jako je chlorid sodný, a kyselinu octovou, která je příkladem slabého elektrolytu.
Jak název kyseliny octové napovídá, tato látka je také kyselinou a zároveň slabým elektrolytem. V souladu s tím klasifikujeme kyselinu octovou jako slabou kyselinu. Naše první (a nejméně obecná) definice kyseliny je látka, která ve vodě vytváří hydroniový ion, což je právě to, co ukazuje naše výše uvedená iontová rovnice, přičemž je třeba mít na paměti, že slabá kyselina vytváří relativně malé množství hydroniového iontu.
Chemisté mají velmi rádi zkratky a důležitá zkratka pro hydroniový ion je H+(aq) a ta se běžně používá. To je znázorněno ve zkrácené verzi výše uvedené rovnice, která je uvedena právě níže. Aby bylo jasné, samotný H+ by byl pouze izolovaný proton (pro 1H); proto je také důležité poznamenat, že žádný takový druh ve vodném roztoku neexistuje.
Šipky jsou navíc nestejně dlouhé, aby naznačily rovnováhu zvýhodňující reaktanty, v níž je mnohem méně iontů než molekul kyseliny octové.
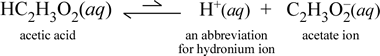
Představením hydronia jako H+(aq) je iontová rovnice pro kyselinu octovou ve vodě formálně vyvážená bez zahrnutí molekuly vody jako reaktantu, což je ve výše uvedené rovnici implicitní.
Amoniak: Příklad slabého elektrolytu, který je slabou zásadou
Kyselina octová, jak jsme právě viděli, je molekulární sloučenina, která je slabou kyselinou a elektrolytem. Amoniak, NH3, další jednoduchá molekulová sloučenina, také v malé míře reaguje s vodou za vzniku amonných a hydroxidových iontů. Naše první, nejméně obecná definice zásady je látka, která ve vodě vytváří hydroxidové ionty. Amoniak je tedy slabá zásada a stejně jako kyselina octová nevede elektrický proud zdaleka tak dobře jako vodná sůl. Čpavek je tedy také slabý elektrolyt.
![]()
Symbolika naší chemické rovnice opět naznačuje rovnováhu zvýhodněnou reaktantem pro slabý elektrolyt.
Rozšíření a souvislosti
Kvantitativnější přístup k rovnováhám využívá slabé kyseliny a slabé zásadyjako důležité příklady.




