Chemistry
Tvorba roztoku je příkladem spontánního procesu, tedy procesu, který probíhá za určitých podmínek bez potřeby energie z nějakého vnějšího zdroje. Někdy směs mícháme, abychom proces rozpouštění urychlili, ale není to nutné; homogenní roztok by vznikl, kdybychom čekali dostatečně dlouho. Téma samovolnosti je pro studium chemické termodynamiky zásadně důležité a je podrobněji zpracováno v jedné z dalších kapitol tohoto textu. Pro účely této kapitoly postačí, když se budeme zabývat dvěma kritérii, která spontánní vznik roztoku upřednostňují, ale nezaručují:
- snížení vnitřní energie systému (exotermická změna, jak je popsáno v předchozí kapitole o termochemii)
- zvýšení neuspořádanosti systému (což znamená zvýšení entropie systému, jak se dozvíte v pozdější kapitole o termodynamice)
V procesu rozpouštění často, ale ne vždy, dochází ke změně vnitřní energie, protože se absorbuje nebo uvolňuje teplo. Při vzniku roztoku vždy dochází ke zvýšení neuspořádanosti.
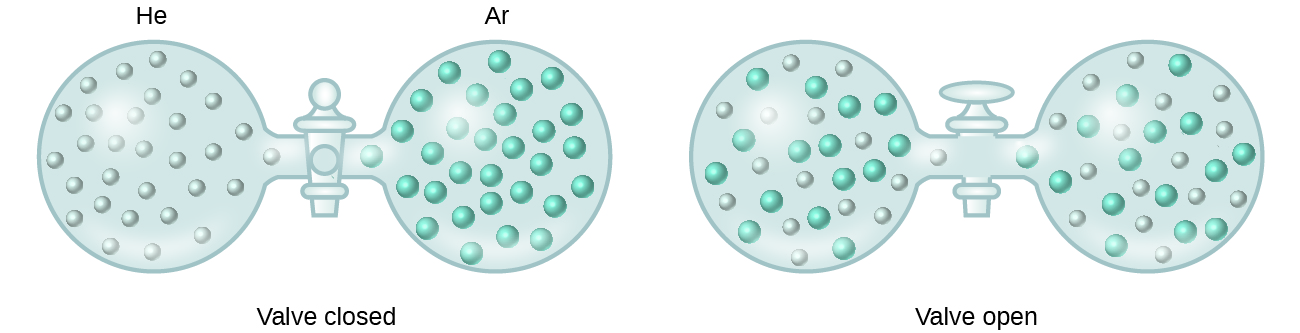
Když se síly mezimolekulárních přitažlivých sil mezi rozpuštěnými látkami a rozpouštědly v roztoku neliší od sil přítomných v oddělených složkách, vzniká roztok bez doprovodné změny energie. Takový roztok se nazývá ideální roztok. Příkladem ideálního roztoku je směs ideálních plynů (nebo plynů, jako je helium a argon, které se ideálnímu chování těsně blíží), protože u entit tvořících tyto plyny nedochází k žádným významným mezimolekulárním přitažlivostem.
Při spojení nádob s héliem a argonem se plyny samovolně smíchají v důsledku difúze a vytvoří roztok (obrázek 2). Při vzniku tohoto roztoku zjevně dochází ke zvýšení neuspořádanosti, protože atomy helia a argonu zaujímají dvakrát větší objem, než jaký každý z nich zaujímal před smícháním.
Ideální roztoky mohou vznikat také při smíchání strukturně podobných kapalin. Například směsi alkoholů methanolu (CH3OH) a ethanolu (C2H5OH) tvoří ideální roztoky, stejně jako směsi uhlovodíků pentanu, C5H12, a hexanu, C6H14. Umístěním methanolu a ethanolu nebo pentanu a hexanu do baňky znázorněné na obrázku 2 dojde ke stejné difúzi a následnému smíchání těchto kapalin, jako je tomu u plynů He a Ar (i když mnohem pomaleji), a vzniknou roztoky bez výrazné změny energie. Na rozdíl od směsi plynů však na složky těchto roztoků kapaliny a kapaliny skutečně působí mezimolekulární přitažlivé síly. Protože jsou však molekuly obou mísených látek strukturně velmi podobné, jsou mezimolekulární přitažlivé síly mezi podobnými a nepodobnými molekulami v podstatě stejné, a proces rozpouštění proto neznamená žádné výrazné zvýšení nebo snížení energie. Tyto příklady ilustrují, jak samotná difuze může poskytnout hnací sílu potřebnou ke spontánnímu vzniku roztoku. V některých případech však může relativní velikost mezimolekulárních přitažlivých sil mezi druhy rozpuštěné látky a rozpouštědla zabránit rozpouštění.
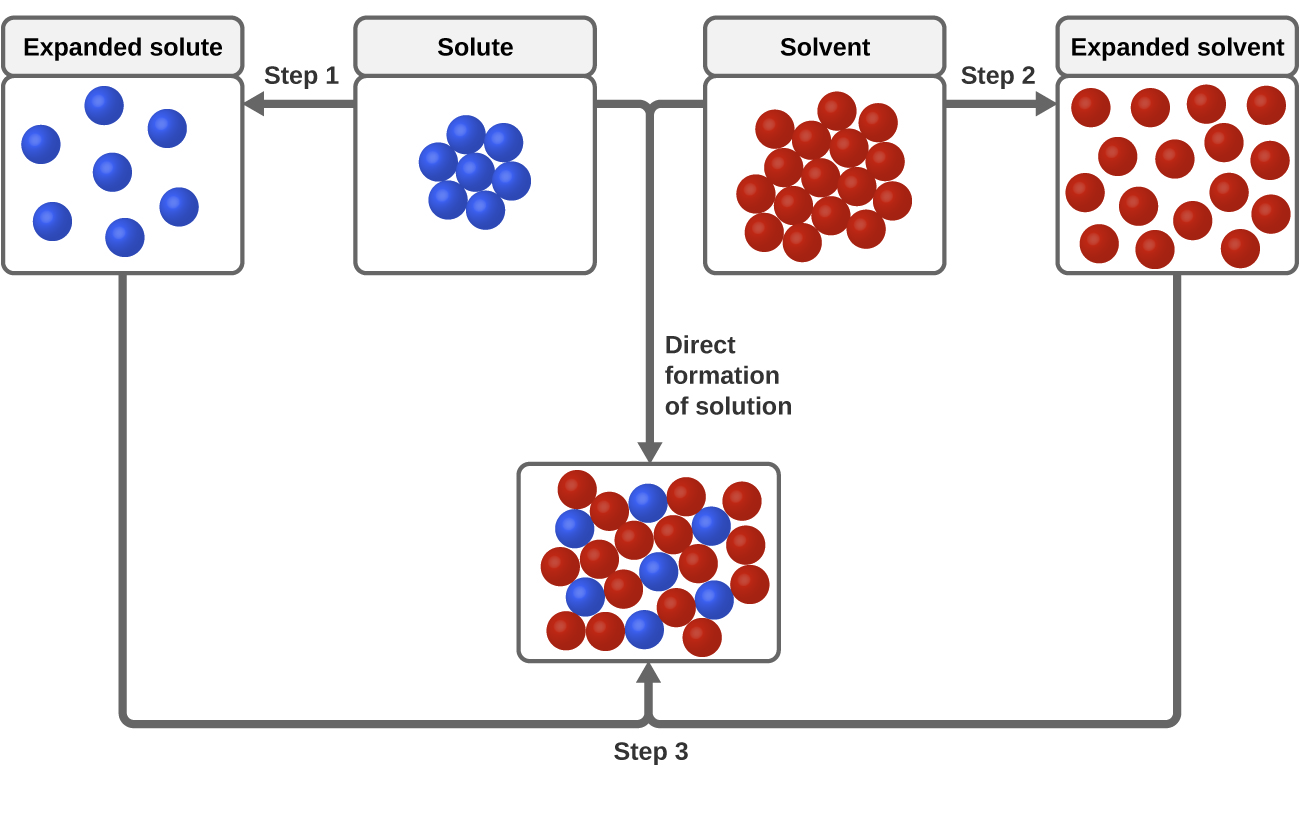
Pro proces rozpouštění jsou důležité tři typy mezimolekulárních přitažlivých sil: rozpouštědlo-roztok, rozpouštědlo-rozpouštědlo a rozpouštědlo-rozpouštědlo. Jak je znázorněno na obrázku 3, na tvorbu roztoku lze pohlížet jako na postupný proces, při kterém se energie spotřebovává na překonání přitažlivosti roztok-rozpuštěná látka a rozpouštědlo-rozpouštědlo (endotermické procesy) a uvolňuje se při vytvoření přitažlivosti roztok-rozpouštědlo (exotermický proces označovaný jako solvatace). Relativní velikost energetických změn spojených s těmito postupnými procesy určuje, zda se při procesu rozpouštění energie celkově uvolňuje, nebo pohlcuje. V některých případech se roztoky nevytvoří, protože energie potřebná k oddělení druhů rozpuštěné látky a rozpouštědla je mnohem větší než energie uvolněná při solvataci.
Například kuchyňské oleje a voda se nemíchají ve významném rozsahu, aby vznikly roztoky (obrázek 4). Vodíková vazba je dominantní mezimolekulární přitažlivou silou přítomnou v kapalné vodě; nepolární uhlovodíkové molekuly kuchyňských olejů nejsou schopny vodíkové vazby, místo toho je drží pohromadě disperzní síly. Vytvoření roztoku oleje a vody by vyžadovalo překonání velmi silné vodíkové vazby ve vodě, jakož i značně silných disperzních sil mezi relativně velkými molekulami oleje. A protože mezi polárními molekulami vody a nepolárními molekulami oleje by nedocházelo k příliš silné mezimolekulární přitažlivosti, uvolnilo by se při solvataci jen velmi málo energie.

Naproti tomu směs ethanolu a vody se smísí v jakémkoli poměru a vznikne roztok. V tomto případě jsou obě látky schopny vodíkové vazby, a tak je proces rozpouštění dostatečně exotermický, aby kompenzoval endotermické separace molekul rozpuštěné látky a rozpouštědla.
Jak bylo uvedeno na začátku tohoto modulu, spontánní vznik roztoku je exotermickými procesy rozpouštění zvýhodněn, ale není zaručen. Zatímco mnoho rozpustných sloučenin se skutečně rozpouští s uvolněním tepla, některé se rozpouštějí endotermicky. Dusičnan amonný (NH4NO3) je jedním z takových příkladů a používá se k výrobě instantních chladivých obkladů pro ošetření zranění, jako je ten na obrázku 5. Tenkostěnný plastový sáček s vodou je uzavřen uvnitř většího sáčku s pevným NH4NO3. Po protržení menšího sáčku se vytvoří roztok NH4NO3, který pohlcuje teplo z okolí (poraněné místo, na které je obklad přiložen) a poskytuje studený obklad, který snižuje otok. Endotermická rozpouštění, jako je toto, vyžadují k oddělení druhů rozpuštěných látek větší příkon energie, než se získá při rozpouštění rozpuštěných látek, ale přesto jsou spontánní v důsledku zvýšení neuspořádanosti, které provází vznik roztoku.


Podívejte se na toto krátké video ilustrující endotermické a exotermické procesy rozpouštění.
Klíčové pojmy a shrnutí
Roztok vzniká, když se dvě nebo více látek fyzikálně spojí a vznikne směs, která je na molekulární úrovni homogenní. Rozpouštědlo je nejkoncentrovanější složkou a určuje fyzikální stav roztoku. Rozpuštěné látky jsou ostatní složky, které jsou obvykle přítomny v koncentracích nižších, než je koncentrace rozpouštědla. Roztoky mohou vznikat endotermicky nebo exotermicky v závislosti na relativní velikosti mezimolekulárních přitažlivých sil rozpuštěné látky a rozpouštědla. Ideální roztoky vznikají bez znatelné změny energie.
Chemie Cvičení ke konci kapitoly
- Jak se liší roztoky od sloučenin? Od jiných směsí?
- Které z hlavních vlastností roztoků můžeme pozorovat u roztoků K2Cr2O7 zobrazených na obrázku 1?
- Při rozpouštění KNO3 ve vodě je výsledný roztok výrazně chladnější, než byla voda původně.
(a) Je rozpouštění KNO3 endotermický nebo exotermický proces?
(b) Jaké závěry můžete vyvodit o mezimolekulových přitažlivostech, které se na tomto procesu podílejí?
(c) Je výsledný roztok ideální roztok?
- Uveďte příklad každého z následujících typů roztoků:
(a) plyn v kapalině
(b) plyn v plynu
(c) pevná látka v pevné látce
- Uveďte nejdůležitější typy mezimolekulových přitažlivostí v každém z následujících roztoků:
(a) Roztok na obrázku 1. Uveďte, které typy mezimolekulových přitažlivostí se v něm vyskytují.
(b) NO(l) v CO(l)
(c) Cl2(g) v Br2(l)
(d) HCl(aq) v benzenu C6H6(l)
(e) Methanol CH3OH(l) v H2O(l)
.
- Předpovězte, zda by každá z následujících látek byla rozpustnější ve vodě (polární rozpouštědlo) nebo v uhlovodíku, jako je heptan (C7H16, nepolární rozpouštědlo):
(a) rostlinný olej (nepolární)
(b) isopropylalkohol (polární)
(c) bromid draselný (iontový)
- Při vzniku některých roztoků se uvolňuje teplo; při vzniku jiných roztoků se teplo pohlcuje. Uveďte molekulární vysvětlení rozdílu mezi těmito dvěma typy spontánních procesů.
- Roztoky vodíku v palladiu mohou vznikat působením plynného H2 na kov Pd. Koncentrace vodíku v palladiu závisí na tlaku použitého plynu H2, ale složitějším způsobem, než lze popsat Henryho zákonem. Za určitých podmínek se v 215 g kovového palladia rozpustí 0,94 g plynného vodíku.
(a) Určete molaritu tohoto roztoku (hustota roztoku = 1,8 g/cm3).
(b) Určete molalitu tohoto roztoku (hustota roztoku = 1,8 g/cm3).
(c) Určete hmotnostní procento atomů vodíku v tomto roztoku (hustota roztoku = 1,8 g/cm3).
.




