Fakta o baryu
Baryum, pojmenované podle řeckého slova barys, což znamená „těžký“, je poměrně hustý a reaktivní kov alkalických zemin. V přírodě se vyskytuje pouze v kombinaci s jinými prvky a sloučeniny obsahující baryum mají širokou škálu využití; vyskytují se v jedu na krysy, ve vážicích činidlech v ropných vrtných kapalinách a v bílé tekutině používané k zobrazení střev při rentgenovém diagnostickém testu zvaném baryový klystýr.
Jen fakta
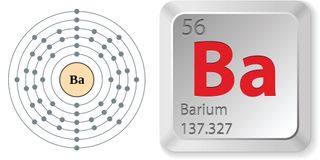
- Atomové číslo (počet protonů v jádře): 56
- Atomová značka (v periodické tabulce prvků): Ba
- Atomová hmotnost (průměrná hmotnost atomu): 137,327
- Hustota: 2,09 unce na palec krychlový (3.62 gramů na cm krychlový)
- Fáze při pokojové teplotě: pevná
- Teplota tání: 1 341 stupňů Fahrenheita (727 stupňů Celsia)
- Teplota varu: 3 447 F (1 897 C)
- Počet přírodních izotopů (atomy téhož prvku s různým počtem neutronů): 7
- Nejběžnější izotop: Ba-138
Objev barya
Vincenzo Casciarolo, italský alchymista 17. století, si podle Královské chemické společnosti poprvé všiml barya v podobě neobvyklých oblázků, které po vystavení teplu po několik let zářily. Tyto oblázky pojmenoval podle svého rodného města „boloňské kameny“, ale později bylo zjištěno, že se jedná o síran barnatý (BaSO4). Koncem 18. století objevil oxid barnatý (BaO) německý chemik Carl Scheele a uhličitan barnatý (BaCO3) anglický chemik William Withering.
Čistý kovový baryum byl izolován a identifikován až v roce 1808 v Královském institutu v Londýně. Významný chemik a vynálezce Sir Humphry Davy použil elektrolýzu k oddělení barya od roztavených solí barya, jako je hydroxid barnatý (Ba(OH)2). Při elektrolýze prochází iontovou látkou elektrický proud, aby se od sebe oddělily ionty. Protože soli barya byly roztavené, ionty barya se snadno přesouvaly do nádoby se zápornou elektrodou a ostatní záporné ionty se snadno přesouvaly opačným směrem do nádoby s kladnou elektrodou.
Zdroje barya
Baryum se v přírodě vyskytuje pouze v kombinaci s jinými prvky kvůli své vysoké reaktivitě. Baryum se nejčastěji vyskytuje v kombinaci se sírany a uhličitany, ale může také tvořit sloučeniny s hydroxidy, chloridy, dusičnany, chlorečnany a jinými zápornými ionty. Podle Roberta E. Krebse v knize The History and Use of Our Earth’s Chemical Elements (Historie a využití chemických prvků naší Země) tvoří baryum asi 0,05 % zemské kůry, což z něj činí 17. nejrozšířenější prvek v zemské kůře: A Reference Guide“ (Greenwood Publishing Group, 2006). Těžební zásoby ve Velké Británii, Itálii, České republice, Spojených státech a Německu obsahují více než 400 milionů tun barya, jak uvádí John Emsley ve své knize „Nature’s Building Blocks:
Aby bylo možné získat čisté elementární baryum, musí být odděleno od ostatních prvků přítomných v přirozeně se vyskytujících sloučeninách barya. Baryum lze extrahovat z chloridu barnatého elektrolýzou. Baryum lze také získat redukcí oxidu barnatého pomocí hliníku nebo křemíku ve vysokoteplotním nízkotlakém vakuu.
Vlastnosti barya
Čisté baryum je měkký, stříbřitě bílý kov. Řadí se mezi kovy alkalických zemin a v periodické tabulce se nachází ve skupině neboli sloupci 2 spolu s beryliem, hořčíkem, vápníkem, stronciem a radiem. Každý z jejich atomů obsahuje dva valenční (vnější) elektrony. Baryum se nachází v periodě neboli 5. řádku, takže drží své valenční elektrony v páté slupce a může o elektrony velmi snadno přijít neboli se zoxidovat. To vysvětluje vysokou reaktivitu barya, zejména s elektronegativními prvky, jako je kyslík.
Komerční využití barya
Elementární baryum nemá mnoho praktických využití, opět kvůli své vysoké reaktivitě. Jeho silná přitažlivost pro kyslík jej však činí užitečným jako „getr“ k odstranění posledních stop vzduchu ve vakuových trubicích. Čisté baryum lze také kombinovat s jinými kovy a vytvářet z nich slitiny, které se používají k výrobě strojních součástí, jako jsou ložiska nebo zapalovací svíčky ve spalovacích motorech. Protože baryum volně drží své elektrony, jeho slitiny při zahřátí snadno emitují elektrony a podle Krebse zlepšují účinnost zapalovacích svíček.
Sloučeniny obsahující baryum mají řadu komerčních využití. Síran barnatý neboli baryt se používá v litoponu (rozjasňující pigment v tiskařském papíru a barvách), v kapalinách pro vrtání ropných vrtů, při výrobě skla a při výrobě pryže. Uhličitan barnatý se používá jako jed na krysy a dusičnan barnatý a chlorečnan barnatý vytvářejí zelené barvy v ohňostrojích.
Baryum v těle
Průměrný dospělý člověk obsahuje asi 22 mg barya, protože je obsaženo v potravinách, jako je mrkev, cibule, salát, fazole a obilná zrna. Hladina barya ve vašich zubech může vědcům skutečně pomoci určit, kdy děti přecházejí z kojení na konzumaci pevné stravy. Tyto nízké hladiny barya neplní žádnou biologickou roli a nejsou škodlivé.
Velká množství rozpustných solí barya však mohou být toxická a dokonce smrtelná, jak uvádí John Emsley ve své knize „The Elements of Murder: A History of Poison“ (Oxford University Press, 2005). Baryum může způsobit zvracení, koliku, průjem, třes a ochrnutí. Bylo zaznamenáno několik vražd pomocí sloučenin barya, včetně vraždy muže v Mansfieldu v Texasu v roce 1994, kterou spáchala jeho šestnáctiletá dcera Marie Robardsová, která ukradla octan barnatý ze středoškolské chemické laboratoře. Několik pacientů bylo také omylem zabito baryem, když byl při gastroenterologickém diagnostickém testu zvaném baryové klyzma omylem použit rozpustný uhličitan barnatý místo nerozpustného síranu barnatého.
Lékaři podle Johns Hopkins Medicine provádějí baryové klystýry za účelem vizualizace a diagnostiky abnormalit tlustého střeva a konečníku. Během zákroku je přes konečník vpraven síran barnatý, který pokryje vnitřní stěny tlustého střeva. Dále se obvykle podává vzduch, aby se zajistilo, že baryový povlak vyplní všechny povrchové abnormality. Poté se pomocí rentgenového záření vytvoří obraz dolní části trávicího traktu. Síran barnatý pohlcuje rentgenové záření a na rentgenovém filmu se jeví bílý, na rozdíl od vzduchu a okolní tkáně, které se jeví černé. Analýza rentgenového obrazu z baryového klyzmatu umožňuje lékařům diagnostikovat poruchy, jako je ulcerózní kolitida, Crohnova choroba, polypy, rakovina a syndrom dráždivého tračníku.
.




