Frontiers in Neuroscience
Úvod
Tvorba nových neuronů v dospělém hipokampu, oblasti mozku zapojené do prostorové navigace a tvorby paměti (Buzsaki a Moser, 2013), je pozoruhodnou formou plasticity, která přetrvává po celý život u několika druhů včetně člověka (Altman a Das, 1965; Eriksson a kol.), 1998; Moreno-Jiménez et al., 2019). Mezi mnoha podmínkami regulujícími neurogenezi dospělého hipokampu je jedním z nejspolehlivějších procesů, který byl široce popsán, věkem zprostředkovaný pokles produkce neuronů, zatímco preexistující populace neuronů zůstávají při normálním stárnutí konstantní (Kuhn et al., 1996; Kempermann et al., 1998; Burke a Barnes, 2010). Stárnutí ovlivňuje mnoho funkcí v mozku včetně synaptického přenosu a plasticity, o nichž se předpokládá, že přispívají ke ztrátě paměti (Burke a Barnes, 2006; Fan et al., 2017). Vzhledem k tomu, že hipokampus je obzvláště zranitelný vůči změnám souvisejícím s věkem a neurodegenerací, stává se hledání strategií pro zvýšení plasticity v této struktuře důležité pro prevenci nebo zmírnění účinků stárnutí (Bartsch a Wulff, 2015). Fyzické cvičení a kognitivní podněty zlepšují zdraví mozku a mají tendenci zmírňovat účinky stárnutí. Jeden z přímých přínosů může vyplývat ze zvýšení hladiny neurotrofického faktoru odvozeného od mozku (BDNF) v závislosti na aktivitě, u kterého bylo prokázáno, že obnovuje synaptickou plasticitu, zvyšuje neurogenezi a zlepšuje učení u myší středního věku (Marlatt et al., 2012; Trinchero et al., 2017). Cvičení také snižuje aktivaci mikroglie, zvyšuje synaptickou plasticitu závislou na aktivitě, proliferaci nervových progenitorových buněk a urychluje vývoj a integraci granulárních buněk (GC) narozených v dospělosti ve stárnoucím hipokampu (van Praag et al., 2005; Kronenberg et al., 2006; O’Callaghan et al., 2009; Marlatt et al., 2012; Gebara et al., 2013). Tyto účinky přispívají k obnovení plasticity závislé na hipokampu a korelují s adaptivním chováním. Stárnoucí zvířata, která si vedou špatně v úlohách prostorového učení a oddělování vzorů, tak po cvičení zlepšují svůj výkon (van Praag et al., 2005; Marlatt et al., 2012; Wu et al., 2015; Duzel et al., 2016; Xu et al., 2017).
Míra, do jaké neurogeneze přispívá k pozitivním behaviorálním účinkům cvičení u stárnoucích zvířat, je stále předmětem zkoumání. Je možné, že zvýšení rychlosti neurogeneze působené fyzickým cvičením přispívá ke zlepšení chování. Mohou se na tom však podílet i jiné mechanismy (Meshi et al., 2006). Ke zlepšení chování může přispívat i zrychlená integrace nových neuronů ve stárnoucím dentátovém gyru po cvičení, která mění kvalitu nových GC. Zatímco neurony narozené u myší středního věku se vyvíjejí pomalu, trvalé dobrovolné cvičení podporuje růst dendritů, tvorbu páteře a integraci neuronů (Trinchero et al., 2017). Podobné účinky mělo i krátké vystavení obohacení prostředí (EE) (Trinchero et al., 2019). Pokud se kumuluje ve více neuronálních kohortách, může mít zrychlená neuronální integrace vyvolaná cvičením významný vliv na učení a chování závislé na hipokampu. V této práci prokazujeme, že několik kohort nových GC může být rychle integrováno do již existujících obvodů myší, které se nadále věnují dobrovolnému běhu, a že tyto účinky přetrvávají, jakmile myši přestanou běhat.
Materiál a metody
Myši a chirurgie
Myší samci C57BL/6J byli ustájeni v počtu 4-5 zvířat na klec za standardních podmínek. Byly vybrány osmiměsíční (8M) myši, protože po dosažení tohoto věku dochází k silnému poklesu hipokampální neurogeneze, který znemožňuje studium značených neuronů (Morgenstern et al., 2008; Trinchero et al., 2017). Myši byly anestetizovány (150 μg ketaminu/15 μg xylazinu v 10 μl fyziologického roztoku/g) a retrovirus byl infundován do septální oblasti pravého dentátového gyru (1,5 μl rychlostí 0,15 μl/min) pomocí sterilních kalibrovaných mikrokapilárních pipet prostřednictvím stereotaxe; souřadnice od bregmy (v mm): -2 anteroposteriorně, -1,5 laterálně a -1,9 ventrálně. V uvedených časech byly mozky fixovány a připraveny řezy pro konfokální zobrazování (Trinchero et al., 2017). Do analýzy byly zahrnuty pouze GC ze septálního dentálního gyru, což odpovídá řezům lokalizovaným od -0,96 do -2,30 mm od bregma podle atlasu myšího mozku (Paxinos a Franklin, 2001). Experimentální protokoly byly schváleny Institucionálním výborem pro péči o zvířata ve Fundación Instituto Leloir v souladu se Zásadami pro biomedicínský výzkum zahrnující zvířata Rady mezinárodních organizací pro lékařské vědy a ustanoveními uvedenými v Příručce pro péči o laboratorní zvířata a jejich používání.
Běh
Běhové vzdálenosti byly u každého experimentu zaznamenány pomocí bezdrátových běžeckých koleček. V pokusech na obrázku 1 byla zvířata umístěna s běžeckým kolečkem po dobu 7 nebo 21 dnů, jak je uvedeno. Za těchto podmínek uběhly myši ∼2 km/den. V obrázcích 2, 3, v nichž myši běhaly 1, 2 nebo 3 měsíce, byla sledovaná vzdálenost ∼10 km/den.
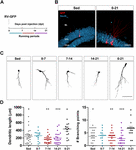
Obrázek 1. Dlouhé, ale nikoli krátké období běhu urychluje morfologické zrání nových GC. (A) Experimentální plán. Po injekci RV-GFP následovalo vystavení 1 týdnu dobrovolného běhu v uvedených oknech nebo po celou dobu experimentu (0-21 dpi). (B) Reprezentativní snímky 21 dpi GC exprimujících GFP (červeně) pořízené ze skupin sedavého zaměstnání a 0-21 běhu. NeuN (modře) označuje vrstvu granulárních buněk (GCL) (ML, molekulární vrstva). Měřítko 50 μm. (C) Reprezentativní konfokální snímky 21-dpi GFP-GCs pro různé skupiny. Měřítko 50 μm. (D) Dendritická složitost (délka a body větvení) pro různá běžecká okna. ∗, ∗∗ a ∗∗∗ označují p < 0,05, p < 0,01 a p < 0,001 ve srovnání se skupinou 0-21 běhu po Kruskal-Wallisově testu a následném Dunnově post hoc testu. Mezi žádnou ze skupin běhajících 7 dní nebyly zjištěny rozdíly. Velikost vzorků (neurony/myši): 27/3 (Sed), 14/3 (0-7), 27/3 (7-14), 22/3 (14-21) a 15/3 (0-21). Vodorovné sloupce označují průměr ± SEM. Otevřené kroužky odpovídají příkladům neuronů.
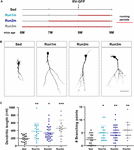
Obrázek 2. Vliv běhu na různé kohorty neuronů. (A) Experimentální design. Po injekci RV-GFP následovaly 3 týdny běhu, kterým předcházely sedavé podmínky (Run1m), 1 (Run2m) nebo 2 měsíce běhu (Run3m). Všechny skupiny byly porovnávány se sedavými myšmi (Sed). Celková délka dendritů byla analyzována ve 21 dpi. (B) Reprezentativní konfokální snímky GFP-GCs. Měřítko 50 μm. (C) Dendritická komplexita (délka a body větvení) pro různá okna běhu. ∗, ∗∗ a ∗∗∗ označují p < 0,05, p < 0,01 a p < 0,001 ve srovnání se Sed po Kruskal-Wallisově testu a následném Dunnově post hoc testu. Velikost vzorků (neurony/myši): 20/3 (Sed), 19/3 (Run1m), 31/3 (Run2m) a 15/3 (Run3m). Vodorovné sloupce označují průměr ± SEM. Otevřené kroužky odpovídají příkladům neuronů.

Obrázek 3. Trvalé účinky chronického cvičení. (A) Experimentální plán. Po injekci RV-GFP následovaly 3 týdny běhu (Run1m) nebo předcházel 1 měsíc cvičení (Run-1m) nebo 1 měsíc cvičení a 1 měsíc bez běžeckého kola (Run-2m). Všechny skupiny byly porovnávány se sedavými myšmi (Sed). Celková délka dendritů byla analyzována ve 21 dpi. (B) Reprezentativní konfokální snímky označených GC. Měřítko 50 μm. (C) Složitost dendritů (délka a body větvení) pro různá běžecká okna. ∗∗∗ značí p < 0,001 ve srovnání se Sed po Kruskal-Wallisově testu a následném Dunnově post hoc testu. Velikost vzorků (neurony/myši): 33/4 (Sed), 39/4 (Run1m), 15/4 (Run-1m) a 18/3 (Run-2m). (D) Morfologie MFB v CA3 byla analyzována pro skupiny Run1m a Run-1m a porovnána se Sed. Reprezentativní konfokální snímky. Měřítko 5 μm. (E) ∗ a ∗∗ označují p < 0,05 a p < 0,01 po Kruskal-Wallisově testu a následném Dunnově post hoc testu. Velikost vzorků: 27/4 (Sed), 32/4 (Run1m) a 18/4 (Run-1m). Vodorovné sloupce označují průměr ± SEM. Otevřené kroužky odpovídají příkladům boutonů.
Imnofluorescence
Imnobarvení bylo provedeno na 60 μm volně plovoucích koronálních řezech. Protilátky byly aplikovány v tris pufrovaném fyziologickém roztoku (TBS) s 3% oslím sérem a 0,25% Tritonem X-100. Protilátky byly naneseny v pufrovaném fyziologickém roztoku (TBS). Imunofluorescence byla provedena pomocí protilátek anti GFP (králičí polyklonální; 1:500; Invitrogen), anti NeuN (myší monoklonální; 1:50; dar F. H. Gage, Salk Institute for Biological Studies, La Jolla, CA, Spojené státy), oslí protilátky proti králičímu Cy3 a oslí proti myšímu Cy5 (1:250; Jackson Immuno Research Laboratories).
Konfokální mikroskopie
Pro měření dendritické délky byly pořízeny snímky (40×; NA 1,3; olejová imerze) z řezů o tloušťce 60 μm, přičemž byly pořízeny Z stacky obsahující 35-50 optických řezů, vzdušná jednotka = 1 v intervalech 0,8 μm (Trinchero et al., 2017). Délka dendritů byla poté měřena pomocí softwaru LSM Image Browser z projekcí trojrozměrných rekonstrukcí do jedné roviny u GC exprimujících GFP. Snímky MFB značených GFP v oblasti CA3 byly pořízeny v intervalech 0,4 μm (63×; NA 1,4; olejová imerze) a digitálním zoomem 6. Plocha a počet filopodií byly analyzovány z projekcí trojrozměrných rekonstrukcí do jedné roviny. Pro kvantifikaci byly vybrány boutony mechovitých vláken (MFB), které splňovaly následující kritéria: (i) průměr boutonu byl >třikrát větší než průměr vlákna, (ii) bouton byl připojen k mechovému vláknu alespoň na jednom konci (Toni et al., 2008). Filopodia byla identifikována jako výběžky vycházející z velkých mechových zakončení (1 μm < délky < 20 μm) (Acsady et al., 1998). Filopodiální extenze byly měřeny počítáním počtu výběžků na terminál. Při pořizování snímků a analýze morfologických vlastností byly všechny zkoumané experimentální skupiny slepé pro operátora.
Statistická analýza
Pokud není uvedeno jinak, jsou údaje prezentovány jako průměr ± SEM. Normalita byla posouzena pomocí Shapiro-Wilksova testu, D’Agostino-Pearsonova omnibusového testu a Kolmogorov-Smirnovova testu, přičemž hodnota p byla 0,05. Pokud data vyhověla testům normality (Gaussovo rozdělení a rovnoměrný rozptyl), byl podle pokynů použit nepárový t-test s Welchovou korekcí nebo ANOVA s Bonferroniho post hoc testem. V případech, které nesplňovaly podmínky normality, byly použity následující neparametrické testy: Mannův-Whitneyho test pro nezávislá srovnání a Kruskalův-Wallisův test pro vícenásobná srovnání.
Výsledky
Dříve jsme prokázali, že běh urychluje vývoj a funkční integraci nových GC ve stárnoucím hipokampu (Trinchero et al., 2017). Nyní jsme zkoumali, zda tento typ plasticity vyžaduje trvalou úroveň aktivity, která se kumuluje v čase, nebo zda kratší období běhu může také vyvolat rychlejší integraci, jak bylo dříve pozorováno u expozice EE (Trinchero et al., 2019). K řešení této otázky byly označeny nové kohorty neuronů u myší středního věku (8 měsíců věku; 8M) pomocí retroviru exprimujícího GFP (RV-GFP). Myším bylo umožněno používat běhací kolo po dobu 1 týdne v rámci různých oken vývoje neuronů nebo běhat po celý interval růstu neuronů (3 týdny; obr. 1A,B). Jak bylo popsáno dříve, nové GC vykazovaly u sedících myší pomalý vývoj, což mělo za následek krátké dendrity s malým rozvětvením ve 3 týdnech. Týdenní běh nezměnil celkový vzhled nových GC v žádném z testovaných intervalů (obr. 1C,D). Naopak běh po celý 3týdenní interval vedl ke zvýšení délky dendritů a jejich větvení, což odpovídá zrychlené integraci neuronů.
Pozorované účinky cvičení byly testovány na jediné kohortě neuronů, a to té, která byla retrovirálně značena. Protože však nové GC vznikají neustále, lze předpokládat, že GC zrozené v různých okamžicích během cvičení mohou být také ovlivněny aktivitou. K ověření této hypotézy jsme použili jednoduchou strategii značení neuronálních kohort narozených v různých časech s ohledem na zahájení cvičení tím, že jsme myši vystavili běžícím kolům po různé časové intervaly, ale vždy jsme analyzovali neuronální strukturu 3 týdny po retrovirální injekci (pro zjednodušení označované jako 1m). Byly tak porovnány tři kohorty; jedna běžící 3 týdny, označená hned na začátku cvičení (Run1m), jedna běžící 2 měsíce, označená 1 měsíc po začátku cvičení (Run2m), a jedna běžící 3 měsíce, označená 2 měsíce po začátku cvičení (Run3m) (obr. 2A). Ve všech podmínkách jsme pozorovali podobný stupeň růstu neuronů ve srovnání se sedavými myšmi, což naznačuje, že všechny kohorty neuronů narozené v mozku myši středního věku vykonávající dobrovolný běh projdou rychlým růstem a integrací (obr. 2B,C). Dendritické stromy GC u myší Run3m byly o něco delší než u myší Run1m nebo Run2m, což naznačuje, že podpora neuronální integrace může reagovat na mechanismus, jehož účinek se kumuluje v čase. Přesto 1 měsíc běhu vedl k téměř maximálnímu účinku na vývoj GC.
Poté jsme zkoumali účinky cvičení ve stárnoucím mozku na neuronální kohorty vzniklé po ukončení aktivity. Porovnávali jsme, jak běh po dobu 3-4 týdnů ovlivňuje vývoj nových GC narozených hned na začátku (Run1m), na konci (Run-1m) nebo 1 měsíc po ukončení cvičení (Run-2m; obrázek 3A). Překvapivě kohorty neuronů narozených na začátku nebo na konci období běhu reagovaly podobně (obr. 3B,C). Naproti tomu kohorty narozené 1 měsíc po skončení cvičení (Run-2m) vykazovaly pouze nepatrný účinek.
Pro plnou integraci do obvodu navazují GC glutamátergní excitační spojení na pyramidové buňky CA3 prostřednictvím velkých MFB a rekrutují GABAergní dopřednou inhibici na pyramidové buňky prostřednictvím filopodiálních prodloužení, která z těchto terminálů vycházejí (Acsady et al.), 1998; Toni et al., 2008; Sun et al., 2013; Restivo et al., 2015). Zatímco konfokální analýza neodhalila změny v ploše MFB neuronů narozených při Run-1m nebo Run1m ve srovnání s kontrolami, počet filopodií/MFB se zvýšil o ∼100 % (obr. 3D,E). Tyto výsledky naznačují, že fyzické cvičení specificky zvyšuje konektivitu z nových GC na inhibiční lokální síť (Trinchero et al., 2019).
Diskuse
Dospělá neurogeneze zahrnuje sled složitých vývojových kroků, jejichž výsledkem je integrace nových jednotek zpracovávajících informace. Nervové kmenové buňky subgranulární zóny opouštějí svůj klidový stav a stávají se proliferujícími nervovými progenitorovými buňkami, které rozšiřují populaci prekurzorů (tranzitní amplifikační buňky) (Bonaguidi et al., 2012). Progenitorové buňky vytvářejí neurony, které migrují, vyvíjejí se a integrují do okruhu. Během tohoto prodlouženého časového okna dochází k výrazné redukci neuronálního poolu v důsledku apoptotické smrti buněk. Dobrovolné cvičení a EE představují silné podněty pro zvýšení neurogeneze dospělého hipokampu u hlodavců v průběhu celého života (van Praag et al., 1999a, b; Kronenberg et al., 2003, 2006; Wu et al., 2008; Kannangara et al., 2011). Neurogeneze se ve stárnoucím mozku snižuje, a to především v důsledku zmenšení objemu rezervoáru progenitorových buněk. Běh i EE mohou působit proti snížené produkci neuronů zaznamenané u stárnoucích zvířat, přičemž působí různými mechanismy (Kempermann et al., 2010). Běh působí na zvýšení neurogeneze na dvou úrovních: zvyšuje rychlost proliferace nervových progenitorových buněk (van Praag et al., 1999b, 2005; Cooper et al., 2018) a urychluje zrání a funkční integraci vyvíjejících se neuronů (Trinchero et al., 2017). EE zvyšuje přežívání a také urychluje zrání nových GC, ale nemá vliv na proliferaci (Trinchero et al., 2017, 2019).
Běhání také podporuje přepojování neuronální konektivity a modulaci vnitřních vlastností v nových GC během prvního týdne vývoje u mladých dospělých myší (Sah et al., 2017). Nedávno jsme zaznamenali kritické období během druhého týdne zrání GC u stárnoucích zvířat, v němž EE indukuje růst dendritů a rychlejší integraci nových neuronů do obvodu (Trinchero et al., 2019). Zde jsme si položili otázku, zda běh po dobu 1 týdne v jakémkoli období vývoje GCs ovlivní jejich integraci, ale žádný vliv jsme nezjistili (obr. 1). K regulaci neurogeneze bylo zapotřebí celé 3týdenní období běhu. Nedostatek krátkodobé modulace naznačuje mechanismus zprostředkovaný faktory, které se musí nahromadit, aby působily znatelné změny. Zajímavé je, že dobrovolné cvičení zhoršuje produkci BDNF, která se hromadí v průběhu týdnů, než dosáhne úrovně plateau, která působí maximálně (Vecchio et al., 2018). Přestože neurotrofiny jsou klíčovými mediátory, je pravděpodobné, že zde pozorované účinky jsou zprostředkovány více mechanismy. Cvičení také zvyšuje elektrickou aktivitu v dentátovém gyru, zvyšuje průtok krve a moduluje neurozánět (Piatti et al., 2011; Speisman et al., 2013; Trinchero et al., 2017). Příspěvek dalších mechanismů vyžaduje další studie.
Ukazujeme zde, že ∼3 týdny staré GC ze stárnoucích myší chronicky vystavených běžícímu kolu (až 3 měsíce) vykazují plně vyvinutý fenotyp s dlouhými a komplexními dendritickými arborizacemi, podobnými těm, které mají nové GC vytvořené u mladých dospělých myší (obr. 2). Zralé GC u mladých dospělých myší a myší středního věku dosahují na konci vývoje ekvivalentní dendritické délky a komplexnosti, srovnatelné s 3týdenními GC u stárnoucích myší vystavených EE nebo běhu (Piatti et al., 2011; Trinchero et al., 2017, 2019). Tyto nashromážděné důkazy hovoří o jasném zrychlení rychlosti zrání vyvolaného během.
Na úrovni neuronálního výstupu běh podpořil rychlý růst filopodiálních prodloužení, ale nezměnil velikost MBF (obr. 3D,E). Tento výsledek naznačuje, že nové GC se rychle integrují, ale jejich výstup může být vychýlen směrem k aktivaci GABAergních interneuronů v CA3 (kontaktovaných filopodiemi), spíše než pyramidových buněk kontaktovaných MFB (Acsady et al., 1998; Toni et al., 2008; Sun et al., 2013; Restivo et al., 2015). Je překvapivé, že EE vyvolala u stárnoucích myší výrazný nárůst velikosti MFB i počtu filopodiálních prodloužení, což odpovídá vyváženější modulaci neuronálního výstupu (Trinchero et al., 2019). Předpokládáme, že změny způsobené EE zahrnují remodelaci specifických synapsí závislou na aktivitě, které se stávají silnějšími pro kódování prostorových signálů (Nicoll a Schmitz, 2005; Holtmaat a Svoboda, 2009). Naproti tomu běh může představovat obecný stimul pro nové GC, aby se připravily na připojení ke specifickým cílům, až bude kódování nezbytné, a zároveň zachovává inhibiční tón z GABAergních interneuronů, který může působit jako mechanismus omezující postsynaptickou aktivitu, dokud se nový GC v okolní síti řádně nesestaví.
Naše výsledky ukazují, že stárnoucí mozek generuje neurogenní signály, když myši pokračují v běhu po delší dobu (měsíce). V této souvislosti se následné kohorty neuronů narozené u běžících myší rychle vyvinou a integrují, což umožní stárnoucím obvodům nahromadit značné množství nových neuronů (obr. 4). Výsledkem průběžného začleňování nových GC s vlastnostmi, které se podobají tomu, k čemu dochází u mladších myší, je omlazený hipokampus s neurony, které by mohly být připraveny reagovat na budoucí zkušenosti.
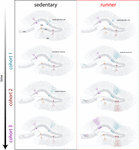
Obr. 4. Běháním navozené omlazení hipokampální sítě u myší středního věku. Schematické znázornění časového průběhu neuronální integrace u sedících (vlevo) a běžících (vpravo) myší po delších intervalech dobrovolného cvičení. V subgranulární zóně dentátového gyru zůstávají buňky podobné radiální glii (RGL) v klidovém stavu (nahoře). Sedavé stárnoucí myši vykazují nízkou míru neurogeneze a nové neurony se vyvíjejí pomalu (reprezentativní kohorty jsou označeny různými barvami). U běžících myší je produkce nových RGL zvýšena a tyto nové jednotky se vyvíjejí a integrují rychleji, čímž se neuronální síť rozšiřuje kumulativním způsobem v delším časovém období. Nakonec se tyto nové kohorty plně zralých neuronů zapojí do zpracování informací na vyžádání.
Z širšího hlediska je nárůst délky života spojený s moderní společností doprovázen vyšším rizikem poklesu kognitivních funkcí. Proto se stává relevantním pochopit mechanismy, které jsou základem dobře známých přínosů cvičení pro mozkové funkce. Kromě toho mohou existovat dlouhodobé rozdíly mezi jedinci, kteří cvičili v různých životních intervalech, a těmi, kteří cvičili nepřetržitě, pokud jde o snížení rizika vzniku neurodegenerativních onemocnění (Llorens-Martin, 2018). Naše výsledky ukazují, že nepřetržitý běh podporuje integraci mnoha neuronálních kohort, čímž pozoruhodným způsobem zvyšuje komplexitu sítě. Navrhování různých strategií pro zvýšení účinnosti integrace nových neuronů v hipokampu by mohlo sloužit jako slibný mechanismus plasticity, který by případně zmírnil úbytek kognitivních funkcí, k němuž dochází ve zdravém i nemocném stárnoucím mozku. A konečně, pitvání mechanismů, které jsou základem různých aspektů takové zrychlené neuronální integrace a vývoje, nás naučí mnoho o možnostech plasticity neuronálních sítí ve stárnoucím mozku.
Data Availability
Údaje, které podporují výsledky této studie, jsou k dispozici u odpovídajícího autora na základě odůvodněné žádosti.
Etické prohlášení
Studie na zvířatech byla přezkoumána a schválena výborem pro používání laboratorních zvířat a péči o ně Leloir Institute.
Příspěvek autora
MT a MH provedli experimenty a analyzovali data. MT, MH a AS navrhli experimenty a napsali rukopis. AS poskytl finanční podporu.
Financování
Tato práce byla podpořena Argentinskou agenturou pro podporu vědy a technologií (Grant# PICT2015-3814), Národním institutem neurologických poruch a mrtvice a Fogartyho mezinárodním centrem (Grant# R01NS103758) pro AS, který je řešitelem v Consejo Nacional de Investigaciones Científicas y Técnicas (CONICET). MT byl podpořen stipendiem CONICET.
Prohlášení o střetu zájmů
Autoři prohlašují, že výzkum byl prováděn bez jakýchkoli komerčních nebo finančních vztahů, které by mohly být chápány jako potenciální střet zájmů.
Poděkování
Děkujeme členům laboratoře AS za zasvěcené diskuse.
Acsady, L., Kamondi, A., Sik, A., Freund, T., and Buzsaki, G. (1998). GABAergní buňky jsou hlavními postsynaptickými cíli mechových vláken v hipokampu potkana. J. Neurosci. 18, 3386-3403.
PubMed Abstract | Google Scholar
Altman, J. a Das, G. D. (1965). Autoradiografické a histologické důkazy postnatální hipokampální neurogeneze u potkanů. J. Comp. Neurol. 124, 319-335.
Google Scholar
Bartsch, T. a Wulff, P. (2015). Hipokampus ve stárnutí a nemoci: od plasticity ke zranitelnosti. Neuroscience 309, 1-16. doi: 10.1016/j.neuroscience.2015.07.084
PubMed Abstract | CrossRef Full Text | Google Scholar
Bonaguidi, M. A., Song, J., Ming, G. L., and Song, H. (2012). Sjednocující hypotéza o vlastnostech savčích nervových kmenových buněk v dospělém hipokampu. Curr. Opin. Neurobiol. 22, 754-761. doi: 10.1016/j.conb.2012.03.013
PubMed Abstract | CrossRef Full Text | Google Scholar
Burke, S. N., and Barnes, C. A. (2006). Neurální plasticita ve stárnoucím mozku. Nat. Rev. Neurosci. 7, 30-40.
PubMed Abstract | Google Scholar
Burke, S. N., and Barnes, C. A. (2010). Senescentní synapse a dynamika hipokampálních obvodů. Trends Neurosci. 33, 153-161. doi: 10.1016/j.tins.2009.12.003
PubMed Abstract | CrossRef Full Text | Google Scholar
Buzsaki, G., and Moser, E. I. (2013). Paměť, navigace a rytmus theta v hipokampálně-entorhinálním systému. Nat. Neurosci. 16, 130-138. doi: 10.1038/nn.3304
PubMed Abstract | CrossRef Full Text | Google Scholar
Cooper, C., Moon, H. Y., and van Praag, H. (2018). Na útěku za hipokampální plasticitou. Cold Spring Harb. Perspect. Med. 8:a029736. doi: 10.1101/cshperspect.a029736
PubMed Abstract | CrossRef Full Text | Google Scholar
Duzel, E., van Praag, H., and Sendtner, M. (2016). Může fyzické cvičení ve stáří zlepšit paměť a funkci hipokampu? Brain 139, 662-673. doi: 10.1093/brain/awv407
PubMed Abstract | CrossRef Full Text | Google Scholar
Eriksson, P. S., Perfilieva, E., Bjork-Eriksson, T., Alborn, A. M., Nordborg, C., Peterson, D. A. a další (1998). Neurogeneze v hipokampu dospělého člověka. Nat. Med. 4, 1313-1317.
PubMed Abstract | Google Scholar
Fan, X., Wheatley, E. G., and Villeda, S. A. (2017). Mechanismy stárnutí hipokampu a možnosti jeho omlazení. Annu. Rev. Neurosci. 40, 251-272. doi: 10.1146/annurev-neuro-072116-031357
PubMed Abstract | CrossRef Full Text | Google Scholar
Gebara, E., Sultan, S., Kocher-Braissant, J., and Toni, N. (2013). Neurogeneze hipokampu dospělých inverzně koreluje s mikrogliemi v podmínkách dobrovolného běhu a stárnutí. Front. Neurosci. 7:145. doi: 10.3389/fnins.2013.00145
PubMed Abstract | CrossRef Full Text | Google Scholar
Holtmaat, A., a Svoboda, K. (2009). Strukturální synaptická plasticita závislá na zkušenosti v mozku savců. Nat. Rev. Neurosci. 10, 647-658. doi: 10.1038/nrn2699
PubMed Abstract | CrossRef Full Text | Google Scholar
Kannangara, T. S., Lucero, M. J., Gil-Mohapel, J., Drapala, R. J., Simpson, J. M., Christie, B. R., et al. (2011). Běh snižuje stres a zlepšuje genezi buněk u stárnoucích myší. Neurobiol. Aging 32, 2279-2286. doi: 10.1016/j.neurobiolaging.2009.12.025
PubMed Abstract | CrossRef Full Text | Google Scholar
Kempermann, G., Fabel, K., Ehninger, D., Babu, H., Leal-Galicia, P., Garthe, A., et al. (2010). Proč a jak fyzická aktivita podporuje plasticitu mozku vyvolanou zkušenostmi. Front. Neurosci. 4:189. doi: 10.3389/fnins.2010.00189
PubMed Abstract | CrossRef Full Text | Google Scholar
Kempermann, G., Kuhn, H. G., and Gage, F. H. (1998). Neurogeneze vyvolaná zkušeností v senescentním dentátovém gyru. J. Neurosci. 18, 3206-3212.
PubMed Abstract | Google Scholar
Kronenberg, G., Bick-Sander, A., Bunk, E., Wolf, C., Ehninger, D., and Kempermann, G. (2006). Fyzické cvičení zabraňuje s věkem souvisejícímu poklesu aktivity prekurzorových buněk v myším dentátním gyru. Neurobiol. Aging 27, 1505-1513. doi: 10.1016/j.neurobiolaging.2005.09.016
PubMed Abstract | CrossRef Full Text | Google Scholar
Kronenberg, G., Reuter, K., Steiner, B., Brandt, M. D., Jessberger, S., Yamaguchi, M., et al. (2003). Subpopulace proliferujících buněk dospělého hipokampu reagují odlišně na fyziologické neurogenní podněty. J. Comp. Neurol. 467, 455-463. doi: 10.1002/cne.10945
PubMed Abstract | CrossRef Full Text | Google Scholar
Kuhn, H. G., Dickinson-Anson, H., and Gage, F. H. (1996). Neurogeneze v dentátovém gyru dospělého potkana: s věkem související pokles proliferace neuronálních progenitorů. J. Neurosci. 16, 2027-2033.
PubMed Abstract | Google Scholar
Llorens-Martin, M. (2018). Cvičení nových neuronů k poražení Alzheimerovy choroby. Brain Plast. 4, 111-126. doi: 10.3233/bpl-180065
PubMed Abstract | CrossRef Full Text | Google Scholar
Marlatt, M. W., Potter, M. C., Lucassen, P. J., and van Praag, H. (2012). Běh v průběhu středního věku zlepšuje paměťové funkce, hipokampální neurogenezi a hladiny BDNF u myších samic C57BL/6J. Dev. Neurobiol. 72, 943-952. doi: 10.1002/dneu.22009
PubMed Abstract | CrossRef Full Text | Google Scholar
Meshi, D., Drew, M. R., Saxe, M., Ansorge, M. S., David, D., Santarelli, L., et al. (2006). Hipokampální neurogeneze není nutná pro behaviorální účinky obohacení prostředí. Nat. Neurosci. 9, 729-731. doi: 10.1038/nn1696
PubMed Abstract | CrossRef Full Text | Google Scholar
Moreno-Jiménez, E. P., Flor-García, M., Terreros-Roncal, J., Rábano, A., Cafini, F., Pallas-Bazarra, N., et al. (2019). Neurogeneze dospělého hipokampu je hojná u neurologicky zdravých osob a prudce klesá u pacientů s Alzheimerovou chorobou. Nat. Med. 25, 554-560.
Google Scholar
Morgenstern, N. A., Lombardi, G. a Schinder, A. F. (2008). Nově vzniklé granulární buňky ve stárnoucím dentátním gyru. J. Physiol. 586, 3751-3757. doi: 10.1113/jphysiol.2008.154807
PubMed Abstract | CrossRef Full Text | Google Scholar
Nicoll, R. A., and Schmitz, D. (2005). Synaptická plasticita na synapsích hipokampálních mechových vláken. Nat. Rev. Neurosci. 6, 863-876.
PubMed Abstract | Google Scholar
O’Callaghan, R. M., Griffin, E. W., and Kelly, A. M. (2009). Dlouhodobé vystavení běžeckému pásu chrání před neurodegenerativními změnami souvisejícími s věkem v hipokampu potkanů. Hippocampus 19, 1019-1029. doi: 10.1002/hipo.20591
PubMed Abstract | CrossRef Full Text | Google Scholar
Paxinos, G., and Franklin, K. B. J. (2001). Myší mozek ve stereotaxických souřadnicích. Amsterdam: Elsevier.
Google Scholar
Piatti, V. C., Davies-Sala, M. G., Esposito, M. S., Mongiat, L. A., Trinchero, M. F., and Schinder, A. F. (2011). Načasování zrání neuronů v dospělém hipokampu je modulováno aktivitou lokální sítě. J. Neurosci. 31, 7715-7728. doi: 10.1523/JNEUROSCI.1380-11.2011
PubMed Abstract | CrossRef Full Text | Google Scholar
Restivo, L., Niibori, Y., Mercaldo, V., Josselyn, S. A., and Frankland, P. W. (2015). Vývoj propojení dospělých buněk s excitačními a inhibičními buněčnými populacemi v hipokampu. J. Neurosci. 35, 10600-10612. doi: 10.1523/JNEUROSCI.3238-14.2015
PubMed Abstract | CrossRef Full Text | Google Scholar
Sah, N., Peterson, B. D., Lubejko, S. T., Vivar, C., and van Praag, H. (2017). Běh reorganizuje obvody týdenních hipokampálních neuronů narozených v dospělosti. Sci. Rep. 7:10903. doi: 10.1038/s41598-017-11268-z
PubMed Abstract | CrossRef Full Text | Google Scholar
Speisman, R. B., Kumar, A., Rani, A., Foster, T. C., and Ormerod, B. K. (2013). Denní cvičení zlepšuje paměť, stimuluje hipokampální neurogenezi a moduluje imunitní a neuroimunitní cytokiny u stárnoucích potkanů. Brain Behav. Immun. 28, 25-43. doi: 10.1016/j.bbi.2012.09.013
PubMed Abstract | CrossRef Full Text | Google Scholar
Sun, G. J., Sailor, K. A., Mahmood, Q. A., Chavali, N., Christian, K. M., Song, H., et al. (2013). Plynulá rekonstrukce intaktních neuronů narozených v dospělosti pomocí sériového zobrazování koncového bloku odhaluje komplexní axonální vedení a vývoj v dospělém hipokampu. J. Neurosci. 33, 11400-11411. doi: 10.1523/JNEUROSCI.1374-13.2013
PubMed Abstract | CrossRef Full Text | Google Scholar
Toni, N., Laplagne, D. A., Zhao, C., Lombardi, G., Ribak, C. E., Gage, F. H., et al. (2008). Neurony narozené v dospělém dentátním gyru vytvářejí funkční synapse s cílovými buňkami. Nat. Neurosci. 11, 901-907. doi: 10.1038/nn.2156
PubMed Abstract | CrossRef Full Text | Google Scholar
Trinchero, M. F., Buttner, K. A., Sulkes Cuevas, J. N., Temprana, S. G., Fontanet, P., Monzon Salinas, M. C., et al. (2017). Vysoká plasticita nových granulárních buněk ve stárnoucím hipokampu. Cell Rep. 21, 1129-1139. doi: 10.1016/j.celrep.2017.09.064
PubMed Abstract | CrossRef Full Text | Google Scholar
Trinchero, M. F., Herrero, M., Monzon-Salinas, M. C., and Schinder, A. F. (2019). Strukturální plasticita neuronů narozených v dospělosti ve stárnoucím hipokampu závislá na zkušenosti. Front. Neurosci. 13:739. doi: 10.3389/fnins.2019.00739
PubMed Abstract | CrossRef Full Text | Google Scholar
van Praag, H., Christie, B. R., Sejnowski, T. J., and Gage, F. H. (1999a). Běh zlepšuje neurogenezi, učení a dlouhodobou potenciaci u myší. Proc. Natl. Acad. Sci. U.S.A. 96, 13427-13431.
Google Scholar
van Praag, H., Kempermann, G., and Gage, F. H. (1999b). Běh zvyšuje proliferaci buněk a neurogenezi v dentátním gyru dospělých myší. Nat. Neurosci. 2, 266-270.
PubMed Abstract | Google Scholar
van Praag, H., Shubert, T., Zhao, C., and Gage, F. H. (2005). Cvičení zlepšuje učení a hipokampální neurogenezi u stárnoucích myší. J. Neurosci. 25, 8680-8685.
PubMed Abstract | Google Scholar
Vecchio, L. M., Meng, Y., Xhima, K., Lipsman, N., Hamani, C. a Aubert, I. (2018). Neuroprotektivní účinky cvičení: udržení zdravého mozku v průběhu stárnutí. Brain Plast. 4, 17-52. doi: 10.3233/bpl-180069
PubMed Abstract | CrossRef Full Text | Google Scholar
Wu, C. W., Chang, Y. T., Yu, L., Chen, H. I., Jen, C. J., Wu, S. Y. a další (2008). Cvičení zvyšuje proliferaci neuronálních kmenových buněk a růst neuritů a přežívání neuronálních progenitorových buněk v dentátovém gyru myší středního věku. J. Appl. Physiol. 105, 1585-1594. doi: 10.1152/japplphysiol.90775.2008
PubMed Abstract | CrossRef Full Text | Google Scholar
Wu, M. V., Luna, V. M., and Hen, R. (2015). Běh zachraňuje deficit kontextové diskriminace založené na strachu u stárnoucích myší. Front. Syst. Neurosci. 9:114. doi: 10.3389/fnsys.2015.00114
PubMed Abstract | CrossRef Full Text | Google Scholar
Xu, B., Sun, A., He, Y., Qian, F., Liu, L., Chen, Y., et al. (2017). Zlepšení paměti vyvolané běháním koreluje se zachováním tenkých trnů v hipokampální oblasti CA1 starých myší C57BL/6. Neurobiol. Aging 52, 106-116. doi: 10.1016/j.neurobiolaging.2017.01.002
PubMed Abstract | CrossRef Full Text | Google Scholar
.




