Inhibice enzymů
Enzymy jsou nezbytné pro většinu, ne-li všechny procesy nezbytné pro život. Enzymy katalyzují reakci tím, že snižují aktivační energii potřebnou k tomu, aby reakce proběhla. Enzymy však musí být přísně regulovány, aby se zajistilo, že hladina produktu nestoupne na nežádoucí úroveň. Toho se dosahuje inhibicí enzymů.
Typy inhibice
Reverzibilní a ireverzibilní inhibitory jsou chemické látky, které se vážou na enzym a potlačují jeho aktivitu. Jednou z metod, jak toho dosáhnout, je téměř trvalá vazba na enzym. Tyto typy inhibitorů se nazývají ireverzibilní. Jiné chemické látky se však mohou na enzym vázat přechodně. Ty se nazývají reverzibilní. Reverzibilní inhibitory se buď vážou na aktivní místo (kompetitivní inhibitory), nebo na jiné místo na enzymu (nekompetitivní inhibitory).
 Obr. 1 – Schéma znázorňující účinek kompetitivních a nekompetitivních inhibitorů enzymu.
Obr. 1 – Schéma znázorňující účinek kompetitivních a nekompetitivních inhibitorů enzymu.Kompetitivní inhibitory
Kompetitivní inhibitory soutěží se substrátem v aktivním místě, a proto zvyšují Km (Michaelis-Mentenovu konstantu). Vmax se však nemění, protože při dostatečné koncentraci substrátu může být reakce stále dokončena. Graf aktivity enzymu v závislosti na koncentraci substrátu by byl posunut doprava v důsledku zvýšení Km, zatímco Lineweaverův-Burkeův graf by byl strmější ve srovnání s grafem bez inhibitoru.
Nekompetitivní inhibitory
Nekompetitivní inhibitory se vážou na jiné místo na enzymu, a proto snižují VMAX. KM se však nemění. To se projevuje nižším maximem na grafu znázorňujícím závislost aktivity enzymu na koncentraci substrátu a vyšším y-interceptem na Lineweaverově-Burkeově grafu ve srovnání se situací bez inhibitoru.
| Kompetitivní | Nekompetitivní | |
| Kde působí? | Aktivní místo | Alternativní místo |
| Změna km | Zvýšení | Nezměněno |
| Změna Vmax | Nezměněno | Snížení |
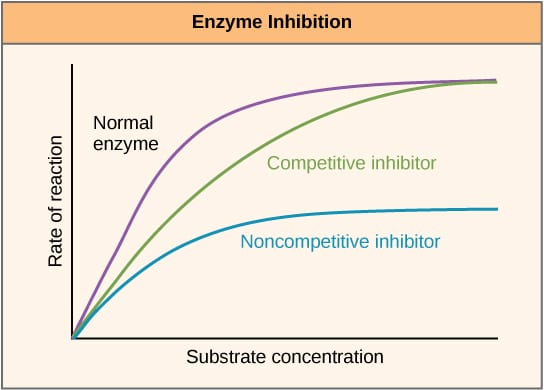 Obr. 2 – Km. Diagram znázorňující vliv inhibitorů enzymu na rychlost reakce a její změny v závislosti na koncentraci substrátu.
Obr. 2 – Km. Diagram znázorňující vliv inhibitorů enzymu na rychlost reakce a její změny v závislosti na koncentraci substrátu.Allosterická inhibice
Allosterické enzymy vykazují sigmoidální křivku na rozdíl od hyperbolické křivky, kterou vykazují Michaelis-Mentenovy enzymy. Je to proto, že většina alosterických enzymů obsahuje více podjednotek, které se mohou při vazbě substrátu na enzym vzájemně ovlivňovat. Inhibice může ovlivnit buď K0,5, což je koncentrace substrátu pro poloviční nasycení, Vmax nebo obojí. To má za následek posun křivky doprava a v případě snížení Vmax posun křivky dolů.
Allosterické enzymy mají dva stavy: stav s nízkou afinitou označovaný jako stav „T“ a stav s vysokou afinitou „R“. Inhibitory fungují tak, že se přednostně vážou na stav T alosterického enzymu a způsobují, že enzym udržuje tento stav nízké afinity.
To je velmi užitečné pro omezení množství produktu enzymu, protože produkt pak může pokračovat v inhibici stejného typu enzymu, aby množství produktu nebylo nadměrné. Tento postup se nazývá zpětnovazební inhibice. Například ATP alostericky inhibuje pyruvátkinázu, aby zabránila zvýšené tvorbě pyruvátu, takže nakonec vzniká méně ATP. Kromě toho je fosfofruktokináza alostericky inhibována citrátem, meziproduktem Krebova cyklu. To znamená, že glykolýza bude omezena při vysoké tvorbě ATP z Krebova cyklu.
 Obr. 3 – Schéma znázorňující mechanismus alosterické inhibice i aktivace.
Obr. 3 – Schéma znázorňující mechanismus alosterické inhibice i aktivace.Fosforylace
Fosforylace poskytuje další mechanismus, kterým lze enzymy inhibovat. K tomu obvykle dochází působením enzymů kináz, které mohou enzym v závislosti na situaci buď inhibovat, nebo aktivovat. Kinázové enzymy odštěpují fosfátovou skupinu z ATP a vážou ji na enzym. V situacích, kdy to vede ke zvýšení aktivity enzymu, vzniká kaskádová reakce, která umožňuje, aby z malého podnětu vznikla velká odezva.
Zymogeny
Enzymy mohou být také vylučovány v neaktivním stavu, které se nazývají zymogeny. Zymogeny jsou užitečným mechanismem, který umožňuje bezpečný transport enzymů na různá místa, aniž by se enzym cestou stal aktivním a plnil svou funkci. Zůstávají neaktivní díky přídavku aminokyselin v bílkovině. Proto, aby se zymogen aktivoval, musí jiný enzym tyto dodatečné aminokyseliny odštěpit. Například chymotrypsinogen je syntetizován slinivkou břišní, přesto je inaktivován a nemůže fungovat. Po cestě do střev odštěpí další enzym (trypsin) dodatečné aminokyseliny a vznikne aktivovaná forma, chymotrypsin.
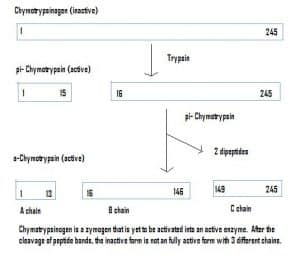 Obr. 4 – Schéma znázorňující aktivaci chymotrypsinogenu v gastrointestinálním systému a enzymy, které se na ní podílejí v jednotlivých fázích.
Obr. 4 – Schéma znázorňující aktivaci chymotrypsinogenu v gastrointestinálním systému a enzymy, které se na ní podílejí v jednotlivých fázích.Klinický význam – farmakokinetika
Nejdůležitějším klinickým využitím inhibice enzymů je použití farmaceutických léčiv. Inhibitory ACE jsou běžnou léčbou hypertenze. Angiotenzin I se působením angiotenzin konvertujícího enzymu (ACE) přeměňuje na angiotenzin II. Angiotenzin II však způsobuje četné účinky, které souvisejí se zvýšením krevního tlaku. Proto byly inhibitory ACE navrženy tak, aby kompetitivně inhibovaly působení ACE, což má za následek menší tvorbu angiotenzinu II a nižší krevní tlak.
Alternativně se penicilin ireverzibilně váže na aktivní místo enzymu zvaného DD-transpeptidáza. DD-transpeptidáza je zodpovědná za poslední krok syntézy bakteriální buněčné stěny. Inhibicí tohoto enzymu nemůže bakterie syntetizovat buněčnou stěnu, a proto nemůže udržet život.
Konec, kyanid je příkladem nekompetitivního inhibitoru. Kyanid se váže na poslední enzym v řetězci přenosu elektronů a brání tomuto enzymu katalyzovat reakci z kyslíku na vodu. Tím se zabrání toku elektronů po elektronovém transportním řetězci a nemůže vzniknout žádný ATP, což má za následek smrt
.




