3.3: Subatomare partikler – elektroner, protoner og neutroner
Identificering og lokalisering af de subatomare partikler
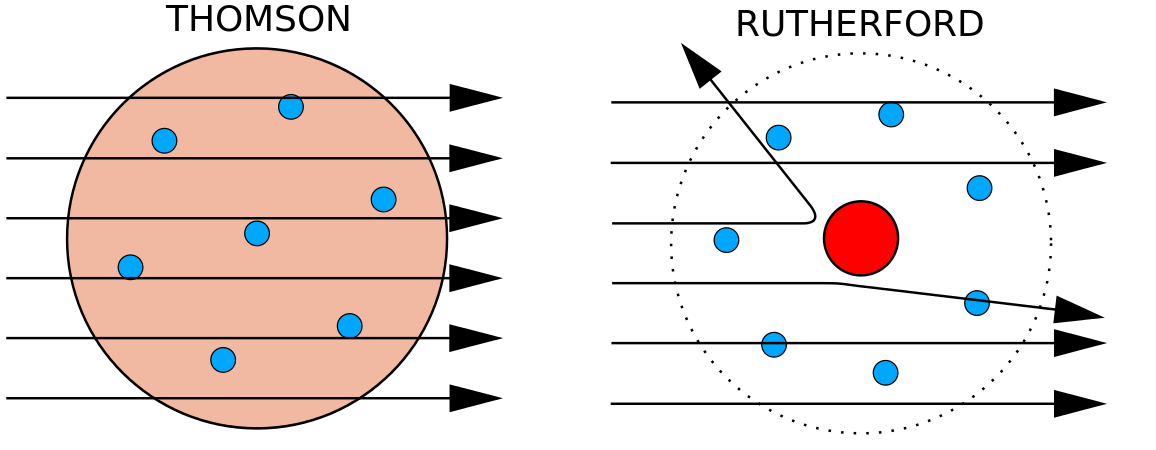
I 1897 beviste den britiske fysiker J. J. Thomson (1856-1940), at at atomerne ikke var den mest grundlæggende form for stof. Hans eksperimenter involverede brugen af katodestrålerør (CRT). Under vakuum producerer disse apparater usynlige stråler, der udgår fra en negativ elektrode (katode) og fortsætter til en positiv elektrode (anode). I disse eksperimenter påviste Thomson, at katodestråler kunne afbøjes eller bøjes af magnetiske eller elektriske felter, hvilket viste, at katodestråler består af ladede partikler . Endnu vigtigere var det, at Thomson ved at måle omfanget af katodestrålingernes afbøjning i magnetiske eller elektriske felter af forskellig styrke kunne beregne partiklernes masse/ladningsforhold. Da ens ladninger frastøder hinanden og modsatrettede ladninger tiltrækker hinanden, konkluderede Thomson, at partiklerne havde en negativ nettoladning; disse partikler kaldes nu for elektroner. Thomson fandt ud af det mest relevante for kemiområdet, at forholdet mellem masse og ladning af katodestråler er uafhængigt af arten af metalelektroderne eller gassen, hvilket tydede på, at elektroner var grundlæggende bestanddele af alle atomer.
I 1910’erne førte eksperimenter med røntgenstråler til denne nyttige konklusion: Størrelsen af den positive ladning i kernen af hvert atom af et bestemt grundstof er den samme. Med andre ord har alle atomer af det samme grundstof det samme antal protoner. Desuden har forskellige grundstoffer et forskelligt antal protoner i deres kerner, så antallet af protoner i et atoms kerne er karakteristisk for et bestemt grundstof. Denne opdagelse var så vigtig for vores forståelse af atomer, at antallet af protoner i kernen af et atom kaldes atomnummeret. Disse eksperimenter blev udført af Ernest Rutherford. Han er krediteret for at have defineret et centralt sted i atomet, som nu er blevet kaldt atomkernen.
Rutherford var klar over, at protonerne befandt sig inden for dette område. En af Ernest Rutherfords kolleger, James Chadwick, udførte og studerede radioaktive reaktioner af beryllium. Ved at ramme en berylliumkerne med alfapartikler blev der udsendt en neutronpartikel. I 1932 meddelte James Chadwick, at der fandtes en tredje subatomar partikel, neutronen. Denne partikel har en masse på 1 atomar masseenhed, men har ingen ladning. Efter denne opdagelse startede atomvidenskab og -teknologi straks.
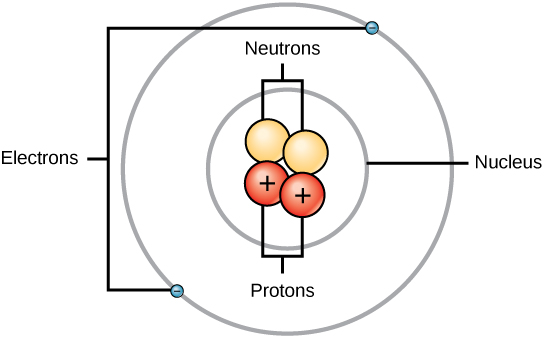
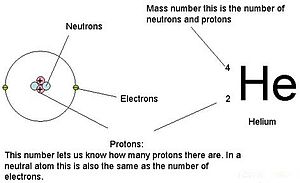
Masserne for de tre subatomare partikler kan udtrykkes i amu (atomare masseenheder) eller gram. For enkelhedens skyld vil vi bruge amu-enheden for de tre subatomare partikler. Både neutroner og protoner tildeles en masse på 1 amu hver. Elektronen har derimod en ubetydelig masse på 0,0005 amu. Denne subatomare masse er ikke repræsenteret i den decimale masse, der vises i det periodiske system. Kun protoner og neutroner bidrager til et atomers masseværdi.
da:User:Materialscientist)
For atomer (neutrale arter) er antallet af elektroner lig med antallet af protoner. Som følge heraf har alle atomer en samlet ladning på nul. For en diskussion af ioner (atomer, der får eller mister elektroner) henvises til den sidste del af dette kapitel. Atomer, der afviger i neutron- og masseværdier fra tabellen, kaldes isotoper. Disse særlige arter kan ses i det følgende afsnit af teksten.
| Subatomare partikel | Symbol | Relativ ladning | Location | Amu-masse |
|---|---|---|---|---|
| Proton | p | +1 | inden for kernen | 1 |
| Neutron | n | 0 | inden for kernen | 1 |
| Elektron | e- | -1 | uden for kernen | 0.0005 (~0) |
Eksempel \(\PageIndex{1}\)
Hvilket er sandt?
- Kernen indeholder protoner og elektroner.
- En elektrons masse er medregnet i atomets masse
- For et atom er antallet af protoner = antallet af elektroner.
Løsning
- Sandt, kernen indeholder protonerne og neutronerne. Elektronerne befinder sig uden for kernen.
- Falsk, elektroner bidrager ikke til atomets massetal.
- Sandt, alle atomer er neutrale og skal have samme antal protoner som elektroner.




