CHEM 245 – Hæmning af enzymer
BIOKEMISK TEMAER
Hæmning af enzymer
Typer af inhibitorer og hæmning.Reversible og irreversible inhibitorer og hæmning. Modeller for og kinetiske virkninger af kompetitiv og ukompetitiv hæmning. Blandede hæmninger.Eksempler på enzymhæmning.
Enzymernes specificitet er ikke strengt begrænset til substrater. Ofte reduceres et enzyms aktivitet ved specifikke interaktioner med molekyler, der betegnes inhibitorer. Enzymhæmning er et af de vigtigste fænomener inden for biokemi. F.eks. udøver mange lægemidler, antibiotika og toksiner deres virkning ved at kunne hæmme et enzym. Inhibitorer, der strukturelt ligner substratet, er ofte kompetitive inhibitorer, da de konkurrerer om at binde sig til det aktive sted. Enzymhæmning kan være reversibel (som det normalt er tilfældet, når en inhibitor binder til enzymet via ikke-kovalente interaktioner) eller irreversibel (som det sker i mange tilfælde, hvor inhibitorer virker via kovalente modifikationer af enzymet, måske ved at målrette en kritisk rest for katalysen).
Vi kan forestille os flere enkle modeller for reversibel hæmning. Den enkleste af disse er den direkte okklusion af det aktive sted af inhibitoren. Dette vil kunne ses i tilfælde af et molekyle med en vis strukturel lighed med substratet. Binding af substrat og inhibitor er gensidigt udelukkende i denne model for kompetitiv hæmning.
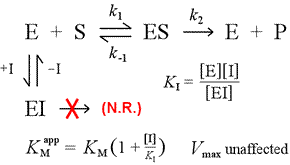
Til højre er vist en simpel mekanistisk model for kompetitiv hæmning. Inhibitoren, I, binder kun til det frie enzym E med en dissociationskonstant KI , og blokerer for substratbinding (S). Ved at binde en del af enzymet i det inaktive EI-kompleks er der mindre af enzymet til rådighed ved en given substratkoncentration til at kombinere med substratet og danne ES og derefter potentielt konvertere til produkter. Der vil blive observeret en stigning i den tid, der er nødvendig for at nå ½Vmax, og derfor stiger den tilsyneladende værdi af KM.
Ved at stige til stadig større niveauer kan substratet overvælde inhibitoren og udkonkurrere den for det frie enzym i et sådant omfang, at den sande Vmax stadig kan nærmes.
Vi kan let forestille os, at et molekyle, der ligner substratet i visse centrale strukturelle træk, kan konkurrere med substratet om at binde det på det aktive sted. Dette kaldes en substratanalog, og de giver almindelige eksempler på kompetitive enzymhæmmere. Hvis den måde, enzymer øger reaktionshastigheden på, er ved selektivt at stabilisere overgangstilstanden i reaktionen, så hvis vi kan finde et molekyle, der ligner overgangstilstanden (i struktur og polaritet eller ladning), burde en sådan overgangstilstandsanalog være en meget god kompetitiv inhibitor.
Vi vil kontrastere modellen med kompetitiv hæmning med ukompetitiv hæmning, hvor inhibitoren kun binder sig til enzym-substrat-komplekset. Man kan forestille sig, at dette sker som følge af et enzym-substrat-interaktion af induced-fit-typen, hvor et bindingssted for en inhibitor udelukkende er tilgængeligt i den inducerede konformation af ES.
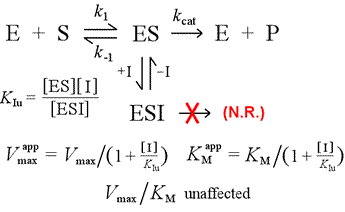
Venstre: En mekanistisk model for ukompetitiv hæmning. I denne model binder inhibitoren kun ES-komplekset og ikke frit enzym. Det ternære kompleks, ESI, går ikke videre til produkter. Dette har den virkning, at den tilsyneladende Vmax sænkes. Inhibitorens dissociationskonstant for ESI betegnes KIu. I en virkning, der forklares ved Le Châteliers princip, er den tilsyneladende KM lavere, da inhibitorbindingen fjerner noget af produktet (ES) fra ES-dannelsens “ligevægt”.
En model for hæmning, hvor inhibitor binder både frit enzym og enzym-substratkomplekset, er blandet hæmning. Inhibitorens dissociationskonstant kan være forskellig mellem E og ES (dvs. KI ≠ KIu). Det særlige tilfælde, hvor KI = KIu, går under navnet ikke-kompetitiv hæmning. Bemærk, at i dette tilfælde påvirkes KM ikke, mens Vmax sænkes.
Typer af reversibel enzymhæmning – en oversigt
Vi har set, at de forskellige modeller for reversibel hæmning kan skelnes efter virkningerne på de kinetiske parametre. Nedenstående tabel opsummerer typerne af hæmning og deres virkninger på disse parametre.

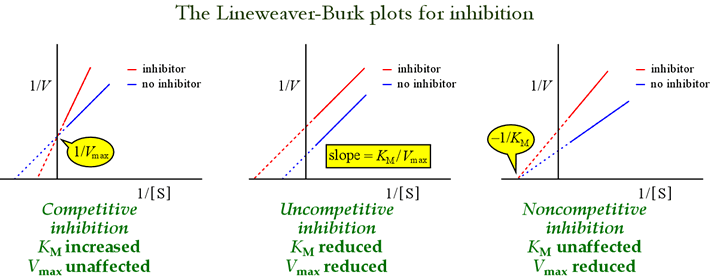
Lineweaver-Burk- eller dobbelt-reciprokke plotter er nyttige til at identificere hæmningsmønstre. Figuren nedenfor viser, hvordan forskellige typer af hæmning påvirker plottet.
Eksempler på enzymhæmning
Det første og mest udbredte lægemiddel, acetylsalicylat (salicylat = orthohydroxybenzoat), almindeligvis kendt som aspirin, er et effektivt analgetikum (smertelindrende middel), antipyretisk (febernedsættende) og antiinflammatorisk middel. De medicinske egenskaber ved pilebark har været kendt i nogle kulturer i århundreder. I det 19. århundrede fandt man ud af, at den aktive ingrediens var en kombination af salicylalkohol og salicylalkohol. På grundlag af disse og andre observationer samt fremskridt inden for kemisk syntese blev aspirin tilgængeligt i midten af århundredet, efter at det var blevet fremstillet af Hoffman, en kemiker ansat hos Bayer. Mere moderne undersøgelser har fastslået, at aspirins medicinske egenskaber i høj grad stammer fra dets evne til irreversibelt at hæmme et enzym kendt som cyclooxygenase, som er nødvendigt for syntesen af prostaglandinerog thromboxaner.
Cyclooxygenaser katalyserer det første trin i omdannelsen af arachidonat til et forstadie til prostaglandiner og thromboxaner, prostaglandin G2 (PGG2, strukturer og reaktion). Reaktionen udnytter to molekyler O2 og omdanner C20:4-fedtsyren til et peroxideret molekyle, der indeholder en cyclopentanring (PGG2 – PG står for “prostaglandin”). Cyclooxygenaseenzymet besidder også en hydroperoxidaseaktivitet, der omdanner PGG2 til PGH2. Derfor ville “cyclooxygenase” (COX) mere præcist blive betegnet som prostaglandin endoperoxid H-syntase (PGHS). Aspirins hæmning af cyclooxygenaseaktiviteten skyldes dets evne til kemisk at modificere en serinrest (Ser530) i enzymet. Serinrester får en acetylgruppe fra aspirin, hvilket er en irreversibel modifikation. Aspirin er således et eksempel på en irreversibel inhibitor. Der findes faktisk to COX-isoenzymer: en konstitutiv form, COX-1 (PGHS-1), og en induceret form (under betændelsesbetingelser), COX-2 (PGHS-2). Ikke-steroide antiinflammatoriske lægemidler (NSAID) som f.eks. aspirin, ibuprofen og naproxen hæmmer generelt begge isoformer. Derfor giver disse lægemidler uønskede bivirkninger, f.eks. gastrointestinal irritation. Et af de aktuelle mål for den farmakologiske forskning er derfor at udvikle hæmmere, der er specifikke for COX-2, en virkning, som menes at være ansvarlig for de fleste af de smertestillende og antiinflammatoriske virkninger af NSAID’er.
Sider om relaterede emner:
- introduktion til kemisk kinetik
- introduktion til enzymologi
- enzymkinetik
- Michaelis-Menten-ligningen




