CNIO, nye skridt til en fremtidig behandling af aldersrelateret lungefibrose
Telomerer- og telomerase-gruppen ved det spanske nationale center for kræftforskning (CNIO) har demonstreret en effektiv behandling af mus med fibrose som følge af aldring, efter at have udviklet den samme kur til mus med fibrose som følge af genetiske fejl. I undersøgelsen, der er offentliggjort i Journal of Cell Biology, udvikles en genterapi, der aktiverer kroppens produktion af telomerase.
Idiopatisk lungefibrose er en ubehandlet og potentielt dødelig sygdom, der er forbundet med visse mutationer og også med aldring.
Telomerase er det enzym, der er ansvarligt for at reparere kromosomernes ender, hvor telomererne er placeret. Behandlingen var meget effektiv hos dyr, og der blev ikke observeret nogen bivirkninger. Dette blev forklaret af undersøgelsesleder Maria Blaso.
“Hvis vi tænker på mennesker, peger vores resultat på muligheden for at skabe en terapi, der kan forhindre udviklingen af lungefibrose i forbindelse med aldring hos alle patienter,” siger Blasco.
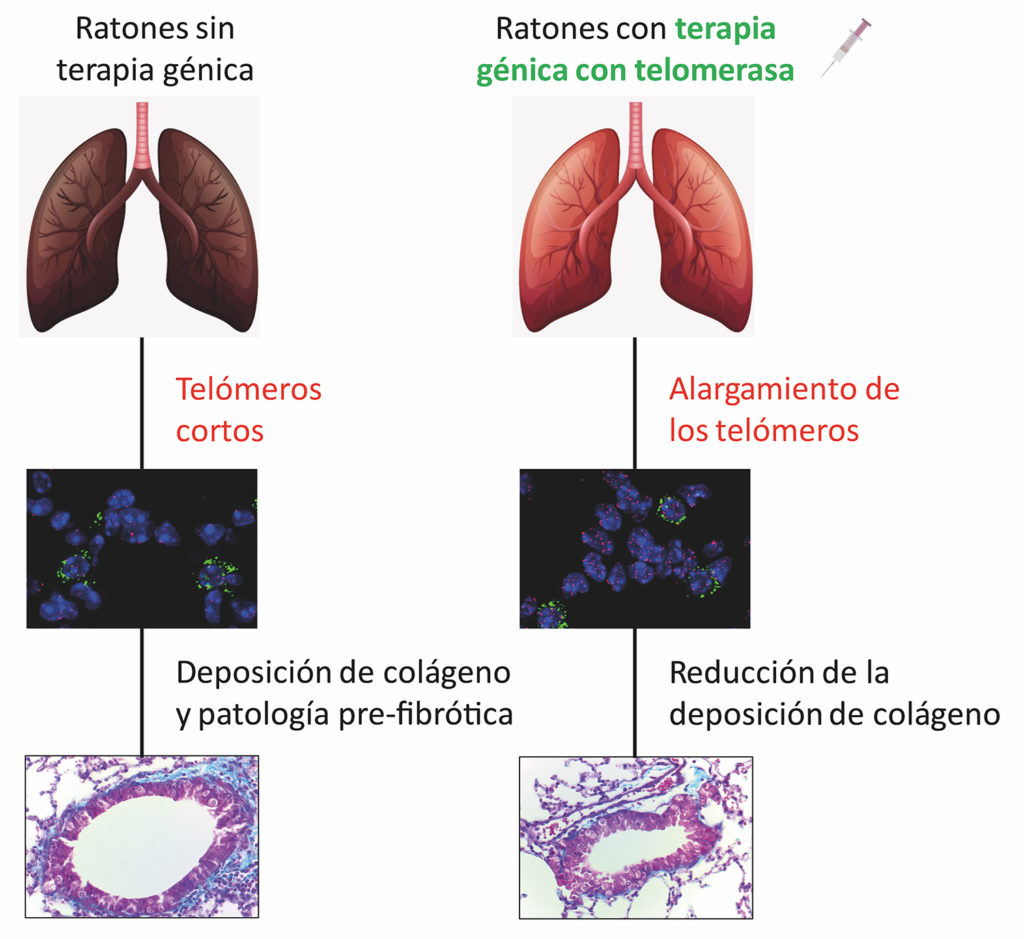
Telomerdysfunktion ved fibrosens oprindelse
Lungefibrose rammer omkring 8.000 mennesker i Spanien. Ved denne sygdom udvikler lungevævet arvæv og bliver stiv, hvilket fører til et progressivt tab af vejrtrækningskapacitet.
Den tilskrives en kombination af genetik og miljø: miljøgifte spiller en vigtig rolle, men for at sygdommen kan manifestere sig, skal der også være enten en genetisk årsag eller aldring i forbindelse med tidens gang.
CNIO-gruppen havde allerede i tidligere undersøgelser påvist, at denne genetiske årsag ligger i telomerernes dårlige funktion. Telomerer er strukturer, der ligesom hætter beskytter integriteten af de kromosomer, der findes i alle celler.
I 2015 skabte de en dyremodel for lungefibrose, en mus, der mangler telomerase-genet. Hos disse dyr dør de celler, der er ansvarlige for regenerering af lungevævet, kaldet type II alveolære pneumocytter, til sidst på grund af telomerdysfunktion. Musen udvikler aggressiv fibrose som følge heraf, fordi epithelet i dens lunger ikke kan forny sig selv med jævne mellemrum. Det er denne periodiske regenerering, der holder vævet sundt og fri for skader fra miljøgifte.
Fibrose i forbindelse med aldring
Denne dyremodel uden telomerase-genet gengiver godt, hvad der sker hos patienter, hvis fibrose skyldes mutationer, der påvirker telomerer. Men disse mennesker er i mindretal. Hos langt de fleste patienter er der intet, der peger på en specifik mutation, men der er en faktor, der er fælles for dem alle: høj alder.

Telomerer kan også miste deres funktion alene som følge af aldringsprocessen. Undersøgelsen af, hvordan dette sker, er et område, der ledes internationalt af Blascos gruppe.
Telomerer er proteinhætter i enderne af kromosomerne, og de bliver lidt kortere, hver gang cellen deler sig. Derfor kommer der et tidspunkt efter mange celledelinger i løbet af organismens levetid, hvor de bliver så korte, at de mister deres evne til at beskytte kromosomerne. Cellen tolker dette som en fejl og holder op med at dele sig, så vævet ikke regenereres.
I det arbejde, der nu er offentliggjort, har forskerne vist, at denne aldersrelaterede telomer-dysfunktion faktisk forekommer i de regenerative celler i lungevævet, type II-pneumocytterne. De har således fundet den molekylære årsag til forbindelsen mellem aldring og lungefibrose, som er så tydelig i klinikken.
Tab af lungesmøremiddel
Forfatterne siger, at “et af resultaterne af det nye arbejde er at beskrive virkningerne af aldring på lungevævet meget detaljeret”. “En af dem stammer direkte fra det faktum, at type II-pneumocytter holder op med at udføre deres arbejde,” siger Sergio Piñeiro, der er førsteforfatter på artiklen.
Ud over at regenerere væv producerer og frigiver disse celler en væske, der gør lungens mekaniske arbejde lettere, kaldet pulmonal surfaktant.
“Lungevævet skal åbnes hver gang vi trækker vejret, mellem seks og ti gange i minuttet, hvilket ud fra et fysisk synspunkt er en stor anstrengelse”, forklarer Jesús Pérez-Gil, der er ekspert ved Complutense-universitetet i Madrid.
Gil, der har medvirket i undersøgelsen, og hvis hold er eksperter på området, påpeger, at “lungesurfaktant er afgørende for at smøre vævet, så det kan åbne og lukke sig med minimal indsats og holde det elastisk”.
“Hvis type II-pneumocytter ikke regenereres, gør surfaktant det heller ikke, og det bidrager til, at lungerne gradvist bliver stive og fibrotiske”
Complutense University of Madrid, Jesús Pérez-Gil
I dette arbejde “har vi observeret en meget klar sammenhæng mellem telomerstatus for type II-pneumocytter, produktionen af surfaktant i lungerne og udviklingen af fibrose hos dyr”, tilføjer Pérez-Gil. “I dette samarbejde behandler vi på en kombineret måde virkningerne på molekylær skala, på telomerer, de biologiske og fysiske ændringer i celler og væv og konsekvenserne for dyrets sundhed, hele organismen.”
En terapi mod alle former for fibrose
I 2018 udviklede CNIO-gruppen en genterapi, der kunne kurere den fibrose, som deres mus udviklede uden telomerase-genet. Behandlingen er baseret på at vende denne genetiske ændring ved midlertidigt at aktivere telomerase-syntesen i musene.

Mus får intravenøst indgivet et virus, hvis eneste funktion er at overføre telomerase-genet til vævene. Virkningen er kortvarig, men den er tilstrækkelig til at få type II-pneumocytter til at genvokse lange telomerer og få lungevævet til at regenerere.
Nu har de anvendt den samme behandling på mus, der blot bliver ældre. Og det virker også. “Behandling med telomerase-aktiverende genterapi forhindrede fibrose i alle musene, også dem, der ikke havde nogen genetisk ændring, men som blev fysiologisk ældre,” forklarer Blasco.
Dette udvider muligheden for en kur mod lungefibrose til at omfatte næsten alle tilfælde af fibrose, som forskerne konkluderer i deres artikel: “Disse resultater hjælper med at forklare betydningen af den for fremtidige terapeutiske strategier mod idiopatisk lungefibrose.
Undersøgelsen blev finansieret af det spanske ministerium for videnskab, innovation og universiteter, Carlos III Institute of Health, Madrid kommune, Botín Foundation og Banco Santander gennem Santander Universities og World Cancer Research.
Undersøgelsen blev finansieret af det spanske ministerium for videnskab, innovation og universiteter, Carlos III Institute of Health, Madrid kommune, Botín Foundation og Banco Santander gennem Santander Universities og World Cancer Research.
Undersøgelsen blev finansieret af det spanske ministerium for videnskab, innovation og universiteter, Carlos III Institute of Health, Madrid kommune, Botín Foundation og Banco Santander gennem Santander Universities og World Cancer Research.




