Frontiers in Neuroscience
Introduktion
Genereringen af nye neuroner i den voksne hippocampus, en region af hjernen involveret i rumlig navigation og hukommelsesdannelse (Buzsaki og Moser, 2013), er en slående form for plasticitet, der vedvarer hele livet i flere arter, herunder mennesker (Altman og Das, 1965; Eriksson et al., 1998; Moreno-Jiménez et al., 2019). Blandt de mange forhold, der regulerer voksen hippocampal neurogenese, er en af de mest pålidelige processer, der er blevet bredt beskrevet, det aldersmedierede fald i neuronal produktion, mens allerede eksisterende neuronale populationer forbliver konstante med normal aldring (Kuhn et al., 1996; Kempermann et al., 1998; Burke og Barnes, 2010). Aldring påvirker mange funktioner i hjernen, herunder synaptisk transmission og plasticitet, som menes at bidrage til hukommelsestab (Burke og Barnes, 2006; Fan et al., 2017). I betragtning af at hippocampus er særligt sårbar over for aldersrelaterede ændringer og neurodegeneration, bliver det relevant at finde strategier til at øge plasticiteten i denne struktur for at forhindre eller lindre virkningerne af senescens (Bartsch og Wulff, 2015). Fysisk træning og kognitive stimuli forbedrer hjernens sundhed og har en tendens til at forbedre virkningerne af aldring. En af de direkte fordele kan skyldes den aktivitetsafhængige stigning i niveauerne af hjerneafledt neurotrofisk faktor (BDNF), som har vist sig at genoprette synaptisk plasticitet, forbedre neurogenese og forbedre indlæring i midaldrende mus (Marlatt et al., 2012; Trinchero et al., 2017). Motion reducerer også mikroglia-aktivering, øger aktivitetsafhængig synaptisk plasticitet, proliferation af neurale progenitorceller og fremskynder udvikling og integration af voksenfødte granuleceller (GC’er) i den aldrende hippocampus (van Praag et al., 2005; Kronenberg et al., 2006; O’Callaghan et al., 2009; Marlatt et al., 2012; Gebara et al., 2013). Disse virkninger bidrager til at genoprette hippocampalafhængig plasticitet og korrelerer med adaptiv adfærd. Således forbedrer aldrende dyr, der præsterer dårligt i rumlig indlæring og mønsterseparationsopgaver, deres præstation efter træning (van Praag et al., 2005; Marlatt et al., 2012; Wu et al., 2015; Duzel et al., 2016; Xu et al., 2017).
Det omfang, i hvilket neurogenese bidrager til de positive adfærdsmæssige virkninger af træning hos aldrende dyr, er stadig under undersøgelse. Det er muligt, at den stigning i neurogenesehastigheden, der udøves af fysisk træning, bidrager til adfærdsforbedring. Men der kan også være andre mekanismer involveret (Meshi et al., 2006). Den accelererede integration af nye neuroner i den aldrende dentate gyrus efter træning, som ændrer kvaliteten af nye GC’er, kan også bidrage til adfærdsforbedring. Mens neuroner, der fødes i midaldrende mus, udvikler sig langsomt, fremmer vedvarende frivillig træning dendritisk vækst, rygsøjledannelse og neuronal integration (Trinchero et al., 2017). Lignende virkninger blev observeret ved kortvarige eksponeringer for miljøberigelse (EE) (Trinchero et al., 2019). Hvis det akkumuleres over flere neuronale kohorter, kan den accelererede neuronale integration, der udløses af motion, udøve betydelig indflydelse på hippocampusafhængig læring og adfærd. I dette arbejde viser vi, at flere kohorter af nye GC’er hurtigt kan integreres i de allerede eksisterende kredsløb hos mus, der fortsætter med at engagere sig i frivillig løb, og at disse virkninger fortsætter, når musene er stoppet med at løbe.
Materialer og metoder
Mus og kirurgi
C57BL/6J-hanemus blev opstaldet på 4-5 dyr pr. bur under standardbetingelser. Otte måneder gamle (8M) mus blev udvalgt, fordi der efter denne alder er et stærkt fald i hippocampal neurogenese, der udelukker undersøgelse af mærkede neuroner (Morgenstern et al., 2008; Trinchero et al., 2017). Mus blev bedøvet (150 μg ketamin/15 μg xylazin i 10 μl saltvand/g), og retrovirus blev infunderet i den septale region af højre dentate gyrus (1.5 μl ved 0.15 μl/min) ved hjælp af sterile kalibrerede mikrokapillærpipetter gennem stereotaktisk kirurgi; koordinater fra bregma (i mm): -2 anteroposterior, -1,5 lateral og -1,9 ventral. På de angivne tidspunkter blev hjerner fikseret, og sektioner blev forberedt til konfokal billeddannelse (Trinchero et al., 2017). Kun GC’er fra den septale dentate gyrus blev inkluderet i analysen, svarende til sektioner lokaliseret fra -0.96 til -2.30 mm fra bregma, i henhold til musens hjerneatlas (Paxinos og Franklin, 2001). Eksperimentelle protokoller blev godkendt af den institutionelle komité for pleje og brug af dyr i Fundación Instituto Leloir i overensstemmelse med principperne for biomedicinsk forskning med dyr fra Rådet for Internationale Organisationer for Medicinske Videnskaber og bestemmelserne angivet i Guide for the Care and Use of Laboratory Animals.
Løb
Løbedistancer blev registreret for hvert forsøg ved hjælp af trådløse løbehjul. I forsøgene i figur 1 blev dyrene opstaldet med et løbehjul i 7 eller 21 dage, som angivet. I denne tilstand løb musene ∼2 km/dag. I figur 2, 3, hvor musene løb i 1, 2 eller 3 måneder, var den overvågede distance ∼10 km/dag.
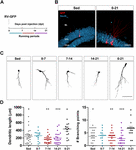
Figur 1. Lange, men ikke korte perioder med løb fremskynder den morfologiske modning af nye GC’er. (A) Forsøgsdesign. RV-GFP-injektion blev efterfulgt af eksponering for 1 uges frivillig løb ved de angivne vinduer eller i hele eksperimentet (0-21 dpi). (B) Repræsentative billeder af 21 dpi GC’er, der udtrykker GFP (rødt), taget fra stillesiddende grupper og 0-21 løbegrupper. NeuN (blå) markerer granulecellelaget (GCL) (ML, molekylært lag). Skala bar, 50 μm. (C) Repræsentative konfokale billeder af 21-dpi GFP-GC’er for de forskellige grupper. Skala, 50 μm. (D) Dendritisk kompleksitet (længde og forgreningssteder) for de forskellige løbevinduer. ∗, ∗∗∗ og ∗∗∗∗ betegner p < 0,05, p < 0,01 og p < 0,001 sammenlignet med 0-21-løbsgruppen efter Kruskal-Wallis-test efterfulgt af Dunn’s post hoc-test. Der blev ikke fundet nogen forskelle mellem nogen af grupperne, der løb i 7 dage. Prøvestørrelser (neuroner/mus): 27/3 (Sed), 14/3 (0-7), 27/3 (7-14), 22/3 (14-21) og 15/3 (0-21). Vandrette søjler angiver gennemsnit ± SEM. Åbne cirkler svarer til eksempel neuroner.
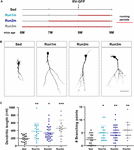
Figur 2. Virkninger af løb på forskellige neuronale kohorter. (A) Forsøgsdesign. RV-GFP-injektion blev efterfulgt af 3 ugers løb og forudgået af stillesiddende forhold (Run1m), 1 (Run2m) eller 2 måneders løb (Run3m). Alle grupper blev sammenlignet med stillesiddende mus (Sed). Den samlede dendritiske længde blev analyseret ved 21 dpi. (B) Repræsentative konfokale billeder GFP-GC’er. Skala bar, 50 μm. (C) Dendritisk kompleksitet (længde og forgreningspunkter) for de forskellige vinduer af løb. ∗, ∗∗∗ og ∗∗∗∗ betegner p < 0,05, p < 0,01 og p < 0,001 i forhold til Sed efter Kruskal-Wallis-test efterfulgt af Dunns post hoc-test. Prøvestørrelser (neuroner/mus): 20/3 (Sed), 19/3 (Run1m), 31/3 (Run2m) og 15/3 (Run3m). Vandrette søjler angiver gennemsnit ± SEM. Åbne cirkler svarer til eksempel neuroner.

Figur 3. Vedvarende virkninger af kronisk træning. (A) Forsøgsdesign. RV-GFP-injektion blev efterfulgt af 3 ugers løb (Run1m) eller forudgået af 1 måneds træning (Run-1m) eller 1 måneds træning og 1 måned uden løbehjul (Run-2m). Alle grupper blev sammenlignet med stillesiddende mus (Sed). Den samlede dendritiske længde blev analyseret ved 21 dpi. (B) Repræsentative konfokale billeder af mærkede GC’er. Skala bar, 50 μm. (C) Dendritisk kompleksitet (længde og forgreningspunkter) for de forskellige løbevinduer. ∗∗∗∗ angiver p < 0,001 sammenlignet med Sed efter Kruskal-Wallis-test efterfulgt af Dunn’s post hoc-test. Prøvestørrelser (neuroner/mus): 33/4 (Sed), 39/4 (Run1m), 15/4 (Run-1m) og 18/3 (Run-2m). (D) MFB-morfologi i CA3 blev analyseret for Run1m- og Run-1m-grupperne og sammenlignet med Sed. Repræsentative konfokale billeder. Skala bar, 5 μm. (E) ∗ og ∗∗∗ angiver p < 0,05 og p < 0,01 efter Kruskal-Wallis-test efterfulgt af Dunn’s post hoc-test. Prøvestørrelser: 27/4 (Sed), 32/4 (Run1m) og 18/4 (Run-1m). Vandrette søjler angiver gennemsnit ± SEM. Åbne cirkler svarer til eksempel boutons.
Immunofluorescens
Immunfarvning blev udført på 60-μm fritflydende koronale sektioner. Antistoffer blev påført i tris-buffered saline (TBS) med 3 % æselserum og 0,25 % Triton X-100. Immunofluorescens blev udført ved hjælp af anti GFP (kaninpolyklonalt; 1:500; Invitrogen), anti NeuN (musemonoklonalt; 1:50; en gave fra F.H. Gage, Salk Institute for Biological Studies, La Jolla, CA, USA), æsel anti-kanin Cy3 og æsel anti-mus Cy5-antistoffer (1:250; Jackson Immuno Research Laboratories).
Konfokal mikroskopi
For dendritiske længde målinger blev billeder erhvervet (40 ×; NA 1,3; oliedimmersion) fra 60-μm tykke sektioner, idet der blev taget Z stakke, herunder 35-50 optiske skiver, airy enhed = 1 med 0,8-μm intervaller (Trinchero et al, 2017). Dendritisk længde blev derefter målt ved hjælp af LSM Image Browser-softwaren fra projektioner af tredimensionelle rekonstruktioner på et enkelt plan i GC’er, der udtrykker GFP. Billeder af GFP-mærkede MFB’er i CA3-regionen blev erhvervet med 0,4-μm-intervaller (63×; NA 1,4; oliedimmersion) og en digital zoom på 6. Område og antal filopodier blev analyseret fra projektioner af tredimensionelle rekonstruktioner på et enkelt plan. Mossy fiber boutons (MFB), der opfyldte følgende kriterier, blev udvalgt til kvantificering: (i) Boutonens diameter var >tre gange større end fibrenes diameter, (ii) Boutonen var forbundet med den mosede fiber i mindst én ende (Toni et al., 2008). Filopodier blev identificeret som fremspring, der stammer fra store mossy terminaler (1 μm < længde < 20 μm) (Acsady et al., 1998). Filopodialforlængelser blev målt ved at tælle antallet af fremspring pr. terminal. Til billedoptagelse og analyse af morfologiske egenskaber var alle undersøgte eksperimentelle grupper blinde for operatøren.
Statistisk analyse
Medmindre andet er angivet, er data præsenteret som gennemsnit ± SEM. Normalitet blev vurderet ved hjælp af Shapiro-Wilks-test, D’Agostino-Pearson omnibus-test og Kolmogorov-Smirnov-test, med en p-værdi på 0,05. Når data opfyldte normalitetstests (Gaussisk fordeling og lige varians), blev uparret t-test med Welch’s korrektion eller ANOVA med Bonferroni’s post hoc-test anvendt som angivet. I de tilfælde, hvor dataene ikke opfyldte normaliteten, blev der anvendt ikke-parametriske test som følger: Mann-Whitneys test for uafhængige sammenligninger og Kruskal-Wallis-test for multiple sammenligninger.
Resultater
Vi har tidligere vist, at løb fremskynder udviklingen og den funktionelle integration af nye GC’er i den aldrende hippocampus (Trinchero et al., 2017). Vi undersøgte nu, om denne type plasticitet kræver et vedvarende aktivitetsniveau, der akkumuleres over tid, eller om kortere perioder med løb også kan udløse hurtigere integration, som tidligere observeret for eksponering for EE (Trinchero et al., 2019). For at adressere dette spørgsmål blev nye neuronale kohorter mærket i midaldrende mus (8 måneder gamle; 8M) ved hjælp af et retrovirus, der udtrykker GFP (RV-GFP). Mus fik lov til at bruge et løbehjul i 1 uge inden for forskellige vinduer af neuronal udvikling eller til at løbe i hele intervallet for neuronal vækst (3 uger; Figurer 1A,B). Som beskrevet tidligere viste nye GC’er langsom udvikling i stillesiddende mus, hvilket resulterede i korte dendritter med små forgreninger ved 3 uger. En uges løb ændrede ikke det generelle udseende af nye GC’er i nogen af de testede intervaller (Figurer 1C,D). I modsætning hertil resulterede løb i hele 3-ugers intervallet i øget dendritisk længde og forgrening, hvilket er i overensstemmelse med en accelereret neuronal integration.
De observerede virkninger af motion blev testet på en enkelt neuronal kohorte, den, der blev retroviralt mærket. Men da nye GC’er kontinuerligt genereres, er det tænkeligt, at GC’er, der er født på forskellige tidspunkter inden for træningsperioden, også kan påvirkes af aktiviteten. For at teste denne hypotese anvendte vi en simpel strategi til at mærke neuronale kohorter født på forskellige tidspunkter med hensyn til træningsinitiering ved at udsætte musene for løbehjul i forskellige intervaller, men altid analysere neuronal struktur 3 uger efter retroviral injektion (betegnet 1m for enkelhedens skyld). Tre kohorter blev således sammenlignet; en, der løb i 3 uger, mærket lige ved træningsstart (Run1m), en, der løb i 2 måneder, mærket 1 måned efter træningsstart (Run2m), og en, der løb 3 måneder, mærket 2 måneder efter træningsstart (Run3m) (Figur 2A). Vi observerede en lignende grad af neuronal vækst i alle forhold sammenlignet med stillesiddende mus, hvilket indikerer, at alle neuronale kohorter, der fødes i hjernen hos en midaldrende mus, der udfører frivillig løb, vil gennemgå hurtig vækst og integration (figur 2B,C). Dendritiske træer af GC’er i Run3m-mus var lidt længere end dem fra Run1m- eller Run2m-mus, hvilket tyder på, at fremme af neuronal integration kan reagere på en mekanisme, hvis virkning akkumuleres over tid. Alligevel resulterede 1 måneds løb i en næsten maksimal effekt på GC-udvikling.
Vi undersøgte derefter virkningerne af motion i den aldrende hjerne på neuronale kohorter født, når aktiviteten sluttede. Vi sammenlignede, hvordan løb i 3-4 uger påvirker udviklingen af nye GC’er, der er født lige ved starten (Run1m), ved slutningen (Run-1m) eller 1 måned efter afslutningen af træning (Run-2m; Figur 3A). Overraskende reagerede neuronale kohorter, der blev født i begyndelsen eller i slutningen af løbeperioden, på samme måde (figur 3B,C). I modsætning hertil viste kohorter født 1 måned efter afslutningen af træning (Run-2m) kun en subtil effekt.
For at integrere sig fuldt ud i kredsløbet etablerer GC’er glutamatergiske excitatoriske forbindelser på CA3-pyramidale celler gennem store MFB’er og rekrutterer GABAergisk feedforward-hæmning på pyramidale celler via filopodiale forlængelser, der opstår fra disse terminaler (Acsady et al, 1998; Toni et al., 2008; Sun et al., 2013; Restivo et al., 2015). Mens konfokalanalyse ikke afslørede ændringer i arealet af MFB’er af neuroner født ved Run-1m eller Run1m sammenlignet med kontroller, steg antallet af filopodier / MFB’er med ∼100% (Figurer 3D,E). Disse resultater indikerer, at fysisk træning specifikt øger konnektiviteten fra nye GC’er på det hæmmende lokale netværk (Trinchero et al., 2019).
Diskussion
Voksen neurogenese involverer en sekvens af komplekse udviklingstrin, der resulterer i integration af nye informationsforarbejdende enheder. Neurale stamceller i den subgranulære zone forlader deres hvilende tilstand og bliver til prolifererende neurale forstadieceller, der udvider forstadiepopulationen (transitforstærkende celler) (Bonaguidi et al., 2012). Forstadieceller genererer neuroner, der migrerer, udvikler sig og integrerer sig i kredsløbet. I løbet af dette udvidede tidsvindue er der en markant reduktion af den neuronale pulje på grund af apoptotisk celledød. Frivillig motion og EE udgør stærke stimuli til at øge den voksne hippocampale neurogenese hos gnavere gennem hele livet (van Praag et al., 1999a, b; Kronenberg et al., 2003, 2006; Wu et al., 2008; Kannangara et al., 2011). Neurogenese aftager i den aldrende hjerne, hovedsagelig som følge af reduktionen i størrelsen af progenitorcellepuljen. Både løb og EE kan modvirke den nedsatte neuronale produktion, der er rapporteret hos aldrende dyr, idet de virker gennem forskellige mekanismer (Kempermann et al., 2010). Løb virker på to niveauer for at øge neurogenese: øge proliferationshastigheden af neurale progenitorceller (van Praag et al., 1999b, 2005; Cooper et al., 2018) og fremskynde modningen og den funktionelle integration af neuroner under udvikling (Trinchero et al., 2017). EE øger overlevelsen og fremskynder også modningen af nye GC’er, men det påvirker ikke proliferation (Trinchero et al., 2017, 2019).
Løb fremmer også omforbindelse af neuronal konnektivitet og modulation af intrinsiske egenskaber i nye GC’er i løbet af den første uge af udviklingen i unge voksne mus (Sah et al., 2017). Vi har for nylig rapporteret en kritisk periode i løbet af den anden uge af GC’ernes modning i aldrende dyr, hvor EE inducerer dendritisk vækst og hurtigere integration af nye neuroner i kredsløbet (Trinchero et al., 2019). Vi spurgte her, om løb i 1 uge på et hvilket som helst tidspunkt af GCs udvikling ville påvirke deres integration, men fandt ingen effekt (Figur 1). Hele 3-ugers løbeperioden var nødvendig for at regulere neurogenese. Manglen på kortvarig modulation tyder på en mekanisme, der er medieret af faktorer, der skal opbygges for at udøve mærkbare ændringer. Interessant nok forværrer frivillig træning produktionen af BDNF, som akkumuleres over uger, før den når et plateau-niveau, der udøver maksimale handlinger (Vecchio et al., 2018). Selv om neurotrofiner er centrale mediatorer, er det plausibelt, at de virkninger, der er observeret her, er medieret af flere mekanismer. Motion øger også den elektriske aktivitet i dentate gyrus, øger blodgennemstrømningen og modulerer neuroinflammation (Piatti et al., 2011; Speisman et al., 2013; Speisman et al., 2013; Trinchero et al., 2017). Bidraget fra andre mekanismer kræver yderligere undersøgelser.
Vi viser her, at ∼3 uger gamle GC’er fra aldrende mus, der kronisk udsættes for et kørende hjul (op til 3 måneder), præsenterer en fuldt udviklet fænotype med lange og komplekse dendritiske arboriseringer, svarende til dem af nye GC’er genereret i unge voksne mus (Figur 2). Modne GC’er i unge voksne og midaldrende mus når tilsvarende dendritisk længde og kompleksitet ved slutningen af udviklingen, sammenlignelige med 3-ugers GC’er i aldrende mus, der er udsat for EE eller løb (Piatti et al., 2011; Trinchero et al., 2017, 2019). Dette akkumulerede bevis taler for en klar acceleration i hastigheden af modning fremkaldt af løb.
På niveauet af neuronalt output fremmede løb den hurtige vækst af filopodiale forlængelser, men ændrede ikke størrelsen af MBF’er (figurer 3D,E). Dette resultat tyder på, at nye GC’er integrerer hurtigt, men deres output kan være forudindtaget i retning af aktivering af GABAergiske interneuroner i CA3 (kontaktet af filopodier), snarere end pyramideceller, der kontaktes af MFB’er (Acsady et al., 1998; Toni et al., 2008; Sun et al., 2013; Restivo et al., 2015). Det er overraskende, at EE fremkaldte en markant stigning i både størrelsen af MFB’er og antallet af filopodiale forlængelser i aldrende mus, hvilket er i overensstemmelse med en mere afbalanceret modulering af neuronalt output (Trinchero et al., 2019). Vi spekulerer, at ændringer som følge af EE involverer aktivitetsafhængig remodellering af specifikke synapser, der bliver styrket til kodning af rumlige signaler (Nicoll og Schmitz, 2005; Holtmaat og Svoboda, 2009). I modsætning hertil kan løb repræsentere en generel stimulus for nye GC’er til at blive forberedt til at forbinde til specifikke mål, når kodning bliver nødvendig, samtidig med at den inhiberende tone fra GABAergiske interneuroner bevares, der kan fungere som en mekanisme, der begrænser postsynaptisk aktivitet, indtil den nye GC er blevet korrekt samlet i det omgivende netværk.
Vores resultater viser, at den aldrende hjerne genererer neurogene signaler, når mus fortsætter med at løbe i længere perioder (måneder). I denne sammenhæng vil efterfølgende neuronale kohorter født i løbende mus udvikle og integrere sig hurtigt, hvilket gør det muligt for aldrende kredsløb at akkumulere et betydeligt antal nye neuroner (figur 4). Den kontinuerlige inkorporering af nye GC’er med træk, der ligner det, der sker i yngre mus, resulterer i en forynget hippocampus med neuroner, der kan være forberedt til at reagere på fremtidige oplevelser.
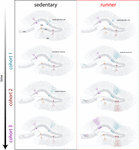
Figur 4. Løbeinduceret foryngelse af det hippocampale netværk hos midaldrende mus. Skematisk repræsentation af tidsforløbet af neuronal integration i stillesiddende (venstre) og løbende (højre) mus efter længerevarende intervaller med frivillig motion. I den subgranulære zone af dentate gyrus forbliver radial-glia-lignende celler (RGL) i en hvilende tilstand (øverst). Sedentære aldrende mus har en lav neurogenesehastighed, og nye neuroner udvikles langsomt (repræsentative kohorter er angivet med forskellige farver). I løbende mus øges produktionen af nye GC’er, og disse nye enheder udvikles og integreres hurtigere, hvilket udvider det neurale netværk på en kumulativ måde over et længere tidsrum. I sidste ende bliver disse nye kohorter af fuldt modne neuroner engageret til at behandle information efter behov.
Fra et bredere perspektiv er den øgede levetid, der er forbundet med det moderne samfund, ledsaget af en højere risiko for kognitiv tilbagegang. Derfor bliver det relevant at forstå de mekanismer, der ligger til grund for de velkendte fordele ved motion for hjernefunktionen. Desuden kan der være langsigtede forskelle mellem personer, der dyrker motion i forskellige intervaller i livet, og personer, der har dyrket motion kontinuerligt, med hensyn til at mindske risikoen for at udvikle neurodegenerative sygdomme (Llorens-Martin, 2018). Vores resultater viser, at kontinuerlig løb fremmer integrationen af mange neuronale kohorter og dermed forhøjer netværkets kompleksitet på en bemærkelsesværdig måde. Udformning af forskellige strategier til at øge effektiviteten af ny neuronintegration i hippocampus kan tjene som en lovende mekanisme for plasticitet for i sidste ende at forbedre den kognitive tilbagegang, der forekommer i den sunde og syge aldrende hjerne. Endelig vil en dissektion af de mekanismer, der ligger til grund for de forskellige aspekter af en sådan accelereret neuronal integration og udvikling, lære os en masse om potentialet for plasticitet af neurale netværk i den aldrende hjerne.
Datatilgængelighed
Dataene, der understøtter resultaterne af denne undersøgelse, er tilgængelige fra den tilsvarende forfatter efter rimelig anmodning.
Ethisk erklæring
Den dyreundersøgelse blev gennemgået og godkendt af komitéen for brug og pleje af forsøgsdyr på Leloir Institute.
Author Contributions
MT og MH udførte eksperimenterne og analyserede dataene. MT, MH og AS designede eksperimenterne og skrev manuskriptet. AS ydede finansiel støtte.
Funding
Dette arbejde blev støttet af det argentinske agentur for fremme af videnskab og teknologi (Grant# PICT2015-3814), National Institute of Neurological Disorders and Stroke og Fogarty International Center (Grant# R01NS103758) til AS, som er investigator i Consejo Nacional de Investigaciones Científicas y Técnicas (CONICET). MT blev støttet af et CONICET-stipendium.
Interessekonflikterklæring
Forfatterne erklærer, at forskningen blev udført uden kommercielle eller finansielle relationer, der kunne opfattes som en potentiel interessekonflikt.
Akkreditering
Vi takker medlemmer af AS’ laboratorium for indsigtsfulde diskussioner.
Acsady, L., Kamondi, A., Sik, A., Freund, T., og Buzsaki, G. (1998). GABAergiske celler er de vigtigste postsynaptiske mål for mossy fibers i rottehippocampus. J. Neurosci. 18, 3386-3403.
PubMed Abstract | Google Scholar
Altman, J., og Das, G. D. (1965). Autoradiografiske og histologiske beviser for postnatal hippocampal neurogenese hos rotter. J. Comp. Neurol. 124, 319-335.
Google Scholar
Bartsch, T., og Wulff, P. (2015). Hippocampus i aldring og sygdom: fra plasticitet til sårbarhed. Neuroscience 309, 1-16. doi: 10.1016/j.neuroscience.2015.07.084
PubMed Abstract | CrossRef Full Text | Google Scholar
Bonaguidi, M. A., Song, J., Ming, G. L., og Song, H. (2012). En forenende hypotese om pattedyrs neurale stamcelleegenskaber i den voksne hippocampus. Curr. Opin. Neurobiol. 22, 754-761. doi: 10.1016/j.conb.2012.03.013
PubMed Abstract | CrossRef Full Text | Google Scholar
Burke, S. N., og Barnes, C. A. (2006). Neural plasticitet i den aldrende hjerne. Nat. Rev. Neurosci. 7, 30-40.
PubMed Abstract | Google Scholar
Burke, S. N., og Barnes, C. A. (2010). Senescent synapser og hippocampal kredsløbsdynamik. Trends Neurosci. 33, 153-161. doi: 10.1016/j.tins.2009.12.003
PubMed Abstract | CrossRef Full Text | Google Scholar
Buzsaki, G., og Moser, E. I. (2013). Hukommelse, navigation og thetarytme i det hippocampale-entorhinale system. Nat. Neurosci. 16, 130-138. doi: 10.1038/nn.3304
PubMed Abstract | CrossRef Full Text | Google Scholar
Cooper, C., Moon, H. Y., og van Praag, H. (2018). På flugt efter hippocampal plasticitet. Cold Spring Harb. Perspect. Med. 8:a029736. doi: 10.1101/cshperspect.a029736
PubMed Abstract | CrossRef Full Text | Google Scholar
Duzel, E., van Praag, H., og Sendtner, M. (2016). Kan fysisk træning i alderdommen forbedre hukommelse og hippocampal funktion? Brain 139, 662-673. doi: 10.1093/brain/awv407
PubMed Abstract | CrossRef Full Text | Google Scholar
Eriksson, P. S., Perfilieva, E., Bjork-Eriksson, T., Alborn, A. M., Nordborg, C., Peterson, D. A., et al. (1998). Neurogenese i den voksne menneskelige hippocampus. Nat. Med. 4, 1313-1317.
PubMed Abstract | Google Scholar
Fan, X., Wheatley, E. G., og Villeda, S. A. (2017). Mekanismer for hippocampal aldring og potentialet for foryngelse. Annu. Rev. Neurosci. 40, 251-272. doi: 10.1146/annurev-neuro-072116-031357
PubMed Abstract | CrossRef Full Text | Google Scholar
Gebara, E., Sultan, S., Kocher-Braissant, J., og Toni, N. (2013). Voksen hippocampal neurogenese korrelerer omvendt med mikroglia under betingelser for frivillig løb og aldring. Front. Neurosci. 7:145. doi: 10.3389/fnins.2013.00145
PubMed Abstract | CrossRef Full Text | Google Scholar
Holtmaat, A., og Svoboda, K. (2009). Erfaringsafhængig strukturel synaptisk plasticitet i pattedyrs hjerne. Nat. Rev. Neurosci. 10, 647-658. doi: 10.1038/nrn2699
PubMed Abstract | CrossRef Full Text | Google Scholar
Kannangara, T. S., Lucero, M. J., Gil-Mohapel, J., Drapala, R. J., Simpson, J. M., Christie, B. R., et al. (2011). Løb reducerer stress og forbedrer cellegenese i aldrende mus. Neurobiol. Aging 32, 2279-2286. doi: 10.1016/j.neurobiolaging.2009.12.025
PubMed Abstract | CrossRef Full Text | Google Scholar
Kempermann, G., Fabel, K., Ehninger, D., Babu, H., Leal-Galicia, P., Garthe, A., et al. (2010). Hvorfor og hvordan fysisk aktivitet fremmer oplevelsesinduceret hjerneplasticitet. Front. Neurosci. 4:189. doi: 10.3389/fnins.2010.00189
PubMed Abstract | CrossRef Full Text | Google Scholar
Kempermann, G., Kuhn, H. G., og Gage, F. H. (1998). Erfaringsinduceret neurogenese i den senescent dentate gyrus. J. Neurosci. 18, 3206-3212.
PubMed Abstract | Google Scholar
Kronenberg, G., Bick-Sander, A., Bunk, E., Wolf, C., Ehninger, D., og Kempermann, G. (2006). Fysisk træning forhindrer aldersrelateret nedgang i precursorcelleaktivitet i musens dentate gyrus. Neurobiol. Aging 27, 1505-1513. doi: 10.1016/j.neurobiolaging.2005.09.016
PubMed Abstract | CrossRef Full Text | Google Scholar
Kronenberg, G., Reuter, K., Steiner, B., Brandt, M. D., Jessberger, S., Yamaguchi, M., et al. (2003). Subpopulationer af prolifererende celler i den voksne hippocampus reagerer forskelligt på fysiologiske neurogene stimuli. J. Comp. Neurol. 467, 455-463. doi: 10.1002/cne.10945
PubMed Abstract | CrossRef Full Text | Google Scholar
Kuhn, H. G., Dickinson-Anson, H., og Gage, F. H. (1996). Neurogenese i dentate gyrus hos den voksne rotte: aldersrelateret fald i neuronal progenitorproliferation. J. Neurosci. 16, 2027-2033.
PubMed Abstract | Google Scholar
Llorens-Martin, M. (2018). Træning af nye neuroner for at besejre Alzheimers sygdom. Brain Plast. 4, 111-126. doi: 10.3233/bpl-180065
PubMed Abstract | CrossRef Full Text | Google Scholar
Marlatt, M. W., Potter, M. C., Lucassen, P. J., og van Praag, H. (2012). Løb i hele middelalderen forbedrer hukommelsesfunktion, hippocampal neurogenese og BDNF-niveauer hos hunmus C57BL/6J-mus. Dev. Neurobiol. 72, 943-952. doi: 10.1002/dneu.22009
PubMed Abstract | CrossRef Full Text | Google Scholar
Meshi, D., Drew, M. R., Saxe, M., Ansorge, M. S., David, D., Santarelli, L., et al. (2006). Hippocampal neurogenese er ikke nødvendig for adfærdsmæssige virkninger af miljøberigelse. Nat. Neurosci. 9, 729-731. doi: 10.1038/nn1696
PubMed Abstract | CrossRef Full Text | Google Scholar
Moreno-Jiménez, E. P., Flor-García, M., Terreros-Roncal, J., Rábano, A., Cafini, F., Pallas-Bazarra, N., et al. (2019). Voksen hippocampal neurogenese er rigelig hos neurologisk sunde personer og falder kraftigt hos patienter med Alzheimers sygdom. Nat. Med. 25, 554-560.
Google Scholar
Morgenstern, N. A., Lombardi, G., og Schinder, A. F. (2008). Nyfødte granuleceller i den aldrende dentate gyrus. J. Physiol. 586, 3751-3757. doi: 10.1113/jphysiol.2008.154807
PubMed Abstract | CrossRef Full Text | Google Scholar
Nicoll, R. A., og Schmitz, D. (2005). Synaptisk plasticitet på hippocampale mossy fiber synapser. Nat. Rev. Neurosci. 6, 863-876.
PubMed Abstract | Google Scholar
O’Callaghan, R. M., Griffin, E. W., og Kelly, A. M. (2009). Langvarig eksponering på løbebånd beskytter mod aldersrelaterede neurodegenerative ændringer i rottehippocampus. Hippocampus 19, 1019-1029. doi: 10.1002/hipo.20591
PubMed Abstract | CrossRef Full Text | Google Scholar
Paxinos, G., og Franklin, K. B. J. (2001). Musens hjerne i stereotaksiske koordinater. Amsterdam: Elsevier.
Google Scholar
Piatti, V. C., Davies-Sala, M. G., Esposito, M. S., Mongiat, L. A., Trinchero, M. F., og Schinder, A. F. (2011). Tidspunktet for neuronal modning i den voksne hippocampus er moduleret af lokal netværksaktivitet. J. Neurosci. 31, 7715-7728. doi: 10.1523/JNEUROSCI.1380-11.2011
PubMed Abstract | CrossRef Full Text | Google Scholar
Restivo, L., Niibori, Y., Mercaldo, V., Josselyn, S. A., og Frankland, P. W. (2015). Udvikling af voksengenereret cellekonnektivitet med excitatoriske og inhiberende cellepopulationer i hippocampus. J. Neurosci. 35, 10600-10612. doi: 10.1523/JNEUROSCI.3238-14.2015
PubMed Abstract | CrossRef Full Text | Google Scholar
Sah, N., Peterson, B. D., Lubejko, S. T., S. T., Vivar, C. og van Praag, H. (2017). Løb reorganiserer kredsløb af en uge gamle voksenfødte hippocampale neuroner. Sci. Rep. 7:10903. doi: 10.1038/s41598-017-11268-z
PubMed Abstract | CrossRef Full Text | Google Scholar
Speisman, R. B., Kumar, A., Rani, A., Foster, T. C., og Ormerod, B. K. (2013). Daglig motion forbedrer hukommelsen, stimulerer hippocampal neurogenese og modulerer immun- og neuroimmune cytokiner i aldrende rotter. Brain Behav. Immun. 28, 25-43. doi: 10.1016/j.bbi.2012.09.013
PubMed Abstract | CrossRef Full Text | Google Scholar
Sun, G. J., Sailor, K. A., Mahmood, Q. A., Chavali, N., Christian, K. M., Song, H., et al. (2013). Sømløs rekonstruktion af intakte voksenfødte neuroner ved seriel end-block billeddannelse afslører kompleks axonal ledelse og udvikling i den voksne hippocampus. J. Neurosci. 33, 11400-11411. doi: 10.1523/JNEUROSCI.1374-13.2013
PubMed Abstract | CrossRef Full Text | Google Scholar
Toni, N., Laplagne, D. A., Zhao, C., Lombardi, G., Ribak, C. E., Gage, F. H., et al. (2008). Neuroner, der fødes i den voksne dentate gyrus, danner funktionelle synapser med målceller. Nat. Neurosci. 11, 901-907. doi: 10.1038/nn.2156
PubMed Abstract | CrossRef Full Text | Google Scholar
Trinchero, M. F., Buttner, K. A., Sulkes Cuevas, J. N., Temprana, S. G., Fontanet, P., Monzon Salinas, M. C., et al. (2017). Høj plasticitet af nye granulecelle i den aldrende hippocampus. Cell Rep. 21, 1129-1139. doi: 10.1016/j.celrep.2017.09.064
PubMed Abstract | CrossRef Full Text | Google Scholar
Trinchero, M. F., Herrero, M., Monzon-Salinas, M. C., and Schinder, A. F. (2019). Erfaringsafhængig strukturel plasticitet af voksenfødte neuroner i den aldrende hippocampus. Front. Neurosci. 13:739. doi: 10.3389/fnins.2019.00739
PubMed Abstract | CrossRef Full Text | Google Scholar
van Praag, H., Christie, B. R., Sejnowski, T. J., og Gage, F. H. (1999a). Løb forbedrer neurogenese, indlæring og langtidspotentiering hos mus. Proc. Natl. Acad. Sci. U.S.A. 96, 13427-13431.
Google Scholar
van Praag, H., Kempermann, G., og Gage, F. H. (1999b). Løb øger celleproliferation og neurogenese i den voksne mus dentate gyrus. Nat. Neurosci. 2, 266-270.
PubMed Abstract | Google Scholar
van Praag, H., Shubert, T., Zhao, C., og Gage, F. H. (2005). Motion forbedrer indlæring og hippocampal neurogenese hos aldrende mus. J. Neurosci. 25, 8680-8685.
PubMed Abstract | Google Scholar
Vecchio, L. M., Meng, Y., Xhima, K., Lipsman, N., Hamani, C., og Aubert, I. (2018). De neuroprotektive virkninger af motion: opretholdelse af en sund hjerne gennem aldring. Brain Plast. 4, 17-52. doi: 10.3233/bpl-180069
PubMed Abstract | CrossRef Full Text | Google Scholar
Wu, C. W., Chang, Y. T., Yu, L., Chen, H. I., Jen, C. J., Wu, S. Y., et al. (2008). Motion øger proliferationen af neurale stamceller og neuritvækst og overlevelse af neuronale forstadieceller i dentate gyrus hos midaldrende mus. J. Appl. Physiol. 105, 1585-1594. doi: 10.1152/japplphysiol.90775.2008
PubMed Abstract | CrossRef Full Text | Google Scholar
Wu, M. V., Luna, V. M. M., and Hen, R. (2015). Løb redder et frygtbaseret kontekstuelt diskriminationsunderskud i aldrende mus. Front. Syst. Neurosci. 9:114. doi: 10.3389/fnsys.2015.00114
PubMed Abstract | CrossRef Full Text | Google Scholar
Xu, B., Sun, A., He, Y., Qian, F., Liu, L., Chen, Y., et al. (2017). Løbeinduceret hukommelsesforbedring korrelerer med bevarelse af tynde pigge i hippocampalområdet CA1 hos gamle C57BL/6-mus. Neurobiol. Aging 52, 106-116. doi: 10.1016/j.neurobiolaging.2017.01.002
PubMed Abstract | CrossRef Full Text | Google Scholar




