Frontiers in Oncology
Introduktion
Glioblastoma og anaplastisk astrocytoma (ANA) er to af de mest almindelige primære hjernetumorer hos voksne (1). Der er en reel stigning i incidensraten, især hos ældre (1-3). I klinisk praksis er det vanskeligt at skelne patienter med glioblastom fra patienter med ANA før operation eller biopsi, fordi symptomerne og tegnene på de to tumorer er relativt ensartede og uspecifikke (4, 5). Behandlingen af dem er imidlertid forskellig, f.eks. kemoterapiprotokol, dosering og administrationsmåde (6). For patienter med ANA (WHO-grad III) anbefales det f.eks. at modtage strålebehandling eller TMZ efter resektion eller biopsi; mens det for patienter, der for nylig er diagnosticeret med glioblastom (WHO-grad IV), er strålebehandling plus samtidig TMZ, efterfulgt af adjuverende TMZ. Ifølge tidligere undersøgelser vokser glioblastom og ANA ved invasion i normalt hjernevæv, spredes gennem cerebrospinalvæsken (CSF) og strækker sig ud over en enkelt carotis- eller vertebralarteriefordeling, og de reagerer således begge dårligt på medicinsk behandling og bliver de førende årsager til kræftrelateret død hos voksne (7, 8). Desuden er prognosen for glioblastom og ANA forskellig. I den ældre befolkning er der ingen signifikant forskel i prognosen mellem glioblastom og ANA, men der kan være forskel i den yngre befolkning (9). Derfor er det svært, men afgørende at skelne glioblastom fra ANA.
Magnetic Resonance Imaging (MRI) er den optimale neuroimaging i den præoperative diagnose af glioblastom og ANA på grund af dens multiplanære evne og overlegne blødtvævskontrast. Selv om nogle undersøgelser viste, at tilstedeværelsen af ringlignende forstærkning og nekrose var tegn på glioblastom, fremstår både glioblastom og ANA i de fleste tilfælde som uregelmæssige former på MR-billeder (hyperdense på T2-vægtede sekvenser og hypodense på T1-vægtede sekvenser) med forskellige grader af Gd-baseret kontrastforstærkning og ødem, hvoraf forskellene normalt var umærkelige for det menneskelige øje (10-12).
For nylig er teksturanalyse (TA), også kendt som radiomik, blevet anvendt i vid udstrækning inden for forskellige områder. Forskere fandt, at TA var en gennemførlig og lovende metode til at lette differentialdiagnosen, da den muliggjorde erhvervelse af yderligere kvantitative oplysninger fra MR-billeder, som var usynlige for menneskelig vurdering (13-15). TA beskriver frekvensfordelingen og den rumlige organisering af voxelværdien for at afsløre de mulige forskelle i tumorvæv (16). Tidligere undersøgelser har undersøgt muligheden for at anvende TA til differentialdiagnostik, subtypeklassificering af tumorer og påvisning af heterogenitet i tumorvæv (17-19). Til vores erkendelse er anvendelsen af TA i differentialdiagnostik mellem glioblastoma og ANA endnu ikke blevet rapporteret. Formålet med denne undersøgelse var at evaluere den diskriminerende evne af MRI-teksturanalyse ved hjælp af maskinlæringsalgoritmer til at differentiere glioblastoma og ANA.
Materialer og metoder
Patientudvælgelse
Vi søgte retrospektivt i vores institutions database og screenede alle patienter, der histopatologisk blev diagnosticeret som glioblastoma eller ANA, fra januar 2015 til december 2018. Kvalificeringskriterier for kvalificerede patienter var: (1) afgørende histopatologisk diagnose af glioblastoma eller ANA; (2) udførlige elektroniske patientjournaler, især patologisk materiale; (3) diagnostisk MR-scanning på vores institution før kirurgisk resektion. Eksklusionskriterier var: (1) historie af intrakraniel sygdom (f.eks. hjernetraume, intrakraniel infektion eller andre typer hjernetumorer), under hensyntagen til interferens af arvæv på intensiteten af billederne; (2) tilstedeværelse af bevægelsesartefakt på MR-scanning; (3) historie af behandlinger før MR-scanning (f.eks. kirurgi, kemoterapi eller strålebehandling); (4) patienter, der ikke opfyldte kriterierne for diagnose af glioblastoma eller ANA i henhold til 2016 WHO-klassifikationssystemet. En ledende neuropatolog med 10 års erfaring vurderede, om patienten opfyldte kriterierne (WHO-klassifikationssystemet fra 2016) for glioblastom eller ANA. Det institutionelle review board godkendte denne retrospektive undersøgelse. Der blev indhentet skriftligt informeret samtykke fra de deltagere, der blev indskrevet i denne undersøgelse. Den etiske komité for Sichuan University og radiologisk afdeling i vores institution har godkendt brugen af statistikkerne til denne undersøgelse.
MR-billedindsamling
For alle patienter inkluderet i denne undersøgelse var kontrastforstærkede T1-vægtede sekvenser tilgængelige og blev indhentet på 3.0T Siemens Trio Scanner med følgende parametre: TR/TE/TI = 1900/2.26/900 ms, flipvinkel = 9 °, 20 aksiale skiver med tykkelse = 5 mm, aksial FOV = 25,6 × 25,6 cm2 og datamatrix = 256 × 256. Kontrastforstærket T1-vægtet billeddannelse brugte gadopentetatdimeglumin (0,1 mmol/Kg) var kontrastmidlet til kontrastforstærket billede, og multi-direktionelle data for kontrastforstærket MRI blev indsamlet i løbet af den kontinuerlige intervaltid på 90-250 s.
Texturudtrækning
I vores undersøgelse blev LifeX-pakken (http://www.lifexsoft.org) brugt til at udtrække teksturtræk. Post-kontrast T1-vægtede (T1C) billeder blev udvalgt til yderligere analyse på grund af den klare skildring af tumorens placering og grænse (20). Region of interest (ROI) blev manuelt tegnet skive for skive i det aksiale plan langs læsionerne på kontrastforstærkede billeder for at opnå teksturtrækninger. To erfarne neurokirurger, der var blinde for patienternes lægejournaler og histopatologiske diagnose, tegnede ROI’erne efterfulgt af redigering af en ledende radiolog og en ledende neurokirurg. Uoverensstemmelser blev behandlet ved at drøfte og rådføre sig med den ledende radiolog og den ledende neurokirurg. I alt 40 teksturtræk blev udtrukket fra MR-billederne, herunder minValue, meanValue, maxValue, stdValue og parametre afledt af seks matricer: Histogrambaseret matrix (HISTO), Shape, Gray-level co-occurrence matrix (GLCM), Gray-level run length matrix (GLRLM), Gray-level zone length matrix (GLZLM) og Neighborhood gray-level dependence matrix (NGLDM).
Features Selection
Der var i alt 40 teksturtræk i alt afledt af seks udvalgte matricer. Forklaringen på de 40 teksturtræk blev vist i Supplerende tabel 1. Statistikkerne for disse teksturtræk blev vist i tillægstabel 2. Featureudvælgelse blev foretaget for at bestemme relevante features og dermed undgå overpasning. Desuden kunne den maskinlæringsalgoritme, der blev anvendt i denne undersøgelse, ikke tage alle 40 teksturfunktioner med i analysen. Der blev anvendt tre uafhængige funktionsudvælgelsesmetoder til at udvælge optimale teksturfunktioner, herunder afstandskorrelation, mindste absolutte krympning og udvælgelsesoperator (LASSO) og gradientkorrelationsbeslutningstræ (GBDT). Dermed blev der dannet tre delmængder af teksturfunktioner, som udgjorde tre forskellige datasæt.
Klassifikation
Linær diskriminantanalyse (LDA) er en robust klassifikationsmetode til at adskille to klasser ved at søge efter den lineære kombination af prædiktorer, der maksimerer adskillelsen mellem grupperne. I denne undersøgelse blev der opstillet tre klassifikationsmodeller baseret på LDA-algoritmen: Afstandskorrelation + LDA, LASSO + LDA og GBDT + LDA. Datasættene blev henholdsvis indlæst i LDA-algoritmen og uafhængigt af hinanden. Hvert datasæt blev tilfældigt opdelt i en trænings- og valideringsgruppe i forholdet 4:1. Den model, der blev trænet i træningsgruppen, blev derefter anvendt på den uafhængige valideringsgruppe for at evaluere dens ydeevne. For at vurdere LDA-algoritmens robusthed blev proceduren gentaget i 100 cyklusser med forskellig, tilfældig og uafhængig sagstildeling. Der blev fastlagt en forvirringsmatrix ved hjælp af den sande tildeling fra histopatologien og forudsigelserne fra LDA-algoritmen. Standardfølsomhed, specificitet, arealerne under receiver operating characteristic curve (AUC) og nøjagtighed blev beregnet for både trænings- og valideringsgruppen for at afsløre modellernes diskriminerende evne. Sammenligningen af tre modeller (Distance Correlation + LDA, LASSO + LDA og GBDT + LDA) blev udført for at bestemme den optimale diskriminerende model for glioblastoma og ANA. Flowdiagrammet for MRI-klassificering ved hjælp af teksturtræk er vist i figur 1.
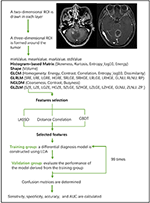
Figur 1. Flowdiagram over MRI-klassificering ved hjælp af teksturtræk. ANA, anaplastisk astrocytoma; LDA, lineær diskriminantanalyse; MRI, Magnetic Resonance Imaging; LASSO, least absolute shrinkage and selection operator; GBDT, gradient correlation decision tree; HISTO, histogrambaseret matrix; GLCM, Gray-level co-occurrence matrix; GLRLM, Gray-level run length matrix; GLZLM, Gray-level zone length matrix; NGLDM, Neighborhood gray-level dependence matrix; AUC, area under receiver operating characteristic curve (område under den karakteristiske modtagerkurve).
Resultater
Patientkarakteristika
I alt 133 patienter med glioblastom (n = 76) eller ANA (n = 57) opfyldte inklusionskriterierne. Alle patienter med glioblastom blev indskrevet i denne undersøgelse, mens 10 patienter med ANA blev udelukket i henhold til udelukkelseskriterierne. Endelig blev 76 patienter med glioblastom og 46 patienter med ANA inkluderet i denne undersøgelse. Patienternes gennemsnitsalder var henholdsvis 46,9 (15-67) og 40,0 (7-69). Alle patienter gennemgik kirurgisk tumorresektion på vores neurokirurgiske afdeling fra 2015 til 2018. Figur 2 viser to tilfælde af det aksiale plan af kontrastforstærkede billeder hos patienter med glioblastom og ANA.
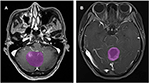
Figur 2. Eksempler på to tilfælde fra de kontrastforstærkede MR-billeder hos patienter med glioblastom og ANA. (A) Kontrastforstærkede billeder med ANA, (B) kontrastforstærkede billeder med glioblastom. ANA, Anaplastic astrocytoma.
Glioblastoma vs. ANA
Der var tre modeller, der blev analyseret i denne undersøgelse, herunder Distance Correlation + LDA, LASSO + LDA, GBDT + LDA. De teksturfunktioner, der blev anvendt til klassificering i disse modeller, blev vist i Supplerende tabel 3. Præstationen af hver model blev præsenteret i tabel 1 (herunder følsomhed, specificitet, nøjagtighed og AUC for trænings- og valideringsgruppen). LASSO + LDA opnåede den bedste præstation med de højeste AUC’er i både trænings- og valideringsgruppen. Følsomhed, specificitet, nøjagtighed og AUC for træningsgruppen var henholdsvis 0,989, 0,993, 0,996 og 0,997, og for valideringsgruppen var de henholdsvis 0,927, 0,989, 0,968 og 0,974. Desuden viste afstandskorrelation + LDA og GBDT + LDA også lovende evne til at skelne glioblastoma fra ANA med AUC ≥0,95 for både træningsgrupper og valideringsgrupper.

Tabel 1. Diskrimination mellem glioblastoma og ANA.
Figur 3 viser forholdet mellem de kanoniske diskriminerende funktioner fra LASSO + LDA-modellerne for glioblastoma- og ANA-grupperne (trekanter og cirkler) og for gruppernes centroider (firkanter). Der blev observeret minimal overlapning i denne figur. Kvalitativt set kunne analysen af de data, der var udvalgt af LASSO, adskille glioblastoma fra ANA. Figur 4 viser fordelingen af den direkte LDA-funktion bestemt for glioblastoma og ANA for en af de 100 uafhængige træningscyklusser i dataanalysen for at illustrere LASSO + LDA-modellens ydeevne. Der var tydelige forskydninger af LDA-funktionens værdier, med venstre forskydning for ANA og højre forskydning for glioblastoma.
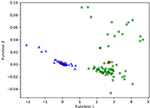
Figur 3. Forholdet mellem de kanoniske diskriminerende funktioner fra LASSO + LDA-modellerne for glioblastoma- og ANA-grupperne (trekanter og cirkler) og for gruppernes centroider (firkanter). Der blev observeret minimal overlapning i denne figur. Kvalitativt set kunne analysen af de data, der var udvalgt af LASSO, adskille glioblastoma fra ANA. LASSO, least absolute shrinkage and selection operator; LDA, lineær diskriminantanalyse; ANA, Anaplastic astrocytoma.
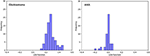
Figur 4. Fordeling af den direkte LDA-funktion bestemt for glioblastoma og ANA for en af de 100 uafhængige træningscyklusser i dataanalysen for at illustrere LASSO + LDA-modellens ydeevne. Der var tydelige forskydninger af LDA-funktionsværdierne, med venstre forskydning for ANA og højre forskydning for glioblastoma. Der observeres et minimalt overlap mellem de to grupper, og der ses en stærk kvalitativ lighed mellem plottet for cyklusser og trekanter. LDA, lineær diskriminantanalyse; ANA, anaplastisk astrocytoma; LASSO, least absolute shrinkage and selection operator.
Diskussion
Den differentielle diagnose før behandling mellem glioblastoma og ANA er vigtig i betragtning af den betydelige forskel i behandlingsstrategi og patientprognose. MR-scanning, den vigtigste radiologiske præoperative undersøgelse for hjernetumorer, anbefales stærkt som den gode følsomhed i læsionsdetektion. Den nøjagtige diagnose før operationen er imidlertid stadig en udfordring, fordi begge tumorer har samme karakteristika på konventionelle MR-billeder, som ikke kan vurderes med det blotte øje (4, 5). I denne undersøgelse ekstraherede vi teksturfunktioner, der giver en kvantitativ beskrivelse af billederne for at maksimere udnyttelsen af MR-undersøgelsen, hvormed der blev etableret tre LDA-baserede modeller. Resultaterne viste, at MRI-baseret teksturanalyse kombineret med LDA-algoritmen kunne muliggøre en gennemførlig differentiering mellem glioblastoma og ANA.
TA er en matematisk tilgang til at karakterisere heterogeniteten af voxelværdi på billeder. Det kunne visualisere rumlig histologisk heterogenitet, som er usynlig for vurdering med det menneskelige øje (21). Teoretisk set kan læsionsbilledernes karakteristika analyseres kvantitativt som teksturtræk på grund af deres forskellige forstærkede mønstre på MR-billeder (22). Desuden tyder tidligere undersøgelser på, at teksturtrækkene kan afspejle en række unormale patologiske processer i tumoren såsom ødem, effusion og nekrose, hvilket giver en potentiel mekanisme for teksturtræk til at skelne glioblastoma fra ANA (23, 24).
Kunstig intelligens er blevet udforsket i vid udstrækning i de seneste undersøgelser. Kombineret med teksturegenskaber udvundet af billeder blev det rapporteret, at det kunne hjælpe med tumorklassificering, klinisk diagnose og resultatforudsigelse. En undersøgelse, der havde til formål at evaluere den diagnostiske ydeevne af TA-baserede maskinlæringsalgoritmer til differentiering af PCNSL fra glioblastoma, præsenterede optimal ydeevne med en gennemsnitlig AUC på 0,921, mens AUC’en for tre læsere alle var <0,8. Forskerne konkluderede således, at den diagnostiske ydeevne af TA-baserede maskinlæringsalgoritmer var bedre end den diagnostiske ydeevne af menneskelige læsere (25). Andre undersøgelser med lignende formål viste også lignende resultater med AUC’er højere end 0,85 (18, 26). Desuden rapporterede forskere, der havde til formål at anvende maskinlæring til klassificering af astrocytomer, også om lovende evne til diskrimination (27). I vores undersøgelse blev klassifikationsmodellerne etableret på grundlag af LDA-algoritmer. LDA er en statistisk klassifikator, der kombinerer de indtastede parametre i en diskriminant funktion for at klassificere tilfælde i forskellige grupper (28). Vores resultater viste, at den LDA-baserede model repræsenterede lovende præstationer med hensyn til præcis diagnose mellem glioblastoma og ANA.
At vedtage optimale funktioner til maskinlæringsalgoritmer var en udfordring, men var nødvendigt i forhold til diagnostiske præstationer. Tidligere undersøgelser udfører funktionsudvælgelse med varierede metoder: Det er en af de vigtigste faktorer, der er blevet anvendt ved udvælgelse af funktioner, med forskellige metoder: Mann-Whitney U-test med AUC af ROC, Student’s t-test med rekursiv funktionel eliminering, tilfældig skov og entropibaseret diskretisering, henholdsvis (18, 25, 29, 30). På grundlag af resultaterne af disse undersøgelser kunne vi drage den konklusion, at den passende udvælgelsesmetode spiller en afgørende rolle for klassifikatorens ydeevne. Hvad angår vores undersøgelse, blev der uddraget et relativt stort antal parametre fra forskellige matricer, hvilket øger chancen for at udvælge de optimale funktioner, men også øger vanskelighederne ved udvælgelsen. Derfor blev tre metoder til udvælgelse af funktioner (afstandskorrelation, LASSO og GBDT) evalueret for at vælge den metode med den bedste ydeevne. Resultaterne af denne undersøgelse viste, at LASSO+LDA var den egnede diskriminerende model for glioblastoma fra ANA med den højeste AUC i testgruppen på 0,997. LASSO blev foreslået som en ikke-lineær variabel udvælgelsesmetode for neurale netværk i en tidligere undersøgelse med den fordel, at den minimerer den fælles sum af kvadrerede fejl. Den kunne producere fortolkelige modeller (svarende til delmængdeudvælgelse), når den samtidig udviser stabilitet i ridge-regressionen. Tidligere undersøgelser har vist, at denne metode er mere effektiv end andre moderne metoder til udvælgelse af variabler (31). Vi må dog fortolke resultaterne forsigtigt, idet den yderligere informationsgevinst ved at sammenligne forskellige maskinlæringsteknikker er ret begrænset, især fordi alle de undersøgte klassificerings-/featureudvælgelsesmetoder tilsyneladende har en ret sammenlignelig ydeevne, og variationen i AUC måske delvis skyldes den statistiske gruppe. Derfor kan vores undersøgelse kun betragtes som en hypotesegenerering for fremtidige, større undersøgelser.
Der var nogle begrænsninger i vores undersøgelse. For det første var bias i patientudvælgelsen uundgåelig som en retrospektiv enkeltcenterstudie. For det andet var antallet af inkluderede patienter relativt lille, og der var behov for et større antal patienter i yderligere undersøgelser for at validere resultaterne. For det tredje er ANA nu opdelt i tre kategorier i henhold til Verdenssundhedsorganisationens 2016-klassifikation af tumorer i centralnervesystemet: IDH-mutant, IDH- vildtype og NOS (32). Evnen af maskinlæring til at skelne subtyper af ANA var påkrævet for at blive udforsket i fremtidige undersøgelser. For det fjerde blev maskinlæringsmodellerne i vores undersøgelse faktisk ikke valideret i andre datasæt. Vi anvendte ikke andre institutioners datasæt, fordi teksturtræk kan være forskellige, når de udtrækkes fra billeder, der er erhvervet med forskellige scannere eller protokoller. Dette kan betragtes som et tveægget sværd. På den ene side kunne vi få et sæt kontrollerede variabler, men på den anden side kunne vi ikke garantere, at resultaterne kunne anvendes bredt. Analyseprotokollen og billedbehandlingsproceduren var open source-pakker, og undersøgelse med en stor population er påkrævet for at validere og reproducere vores resultater.
Slutning
I dette arbejde ekstraherede vi kvantitative parametre fra kontrastforstærkede MR-billeder og anvendte tre feature-selektionsmetoder til at vælge de mest diskriminerende parametre. Derefter anvendte vi LDA-algoritmen til at analysere de udvalgte parametre. Vores undersøgelse viser, at teksturfunktioner har lovende evne til at skelne glioblastoma fra ANA. Multicenterundersøgelser med et større antal patienter er berettiget til at bekræfte dette foreløbige resultat.
Datatilgængelighed
Vi deler gerne vores data til alle kvalificerede forskere uden unødige forbehold. Kontakt venligst tilsvarende forfatter, hvis der er noget, de har brug for.
Ethisk erklæring
Studierne, der involverer menneskelige deltagere, blev gennemgået og godkendt af den etiske komité ved Sichuan University. Skriftligt informeret samtykke til at deltage i denne undersøgelse blev givet af deltagernes værge/nærmeste pårørende. Der blev indhentet skriftligt informeret samtykke fra den/de enkelte person(er) og den/de mindreåriges værge/nærmeste pårørende til offentliggørelse af potentielt identificerbare billeder eller data, der indgår i denne artikel.
Author Contributions
ZT, CC, JX og XM bidrog til udformning og design af undersøgelsen. CC og XO indskrev kvalificerede patienter og indhentede lægejournaler og MRI-billeder af hver patient. YF og ZT udførte teksturanalyse. JW opstillede modellerne og udførte andre statistiske analyser. ZT skrev det første udkast til manuskriptet. CC skrev dele af manuskriptet. Alle forfattere bidrog til revision af manuskriptet, læste og godkendte den indsendte version.
Interessekonflikt erklæring
Forfatterne erklærer, at forskningen blev udført uden kommercielle eller finansielle relationer, der kunne opfattes som en potentiel interessekonflikt.
Supplementært materiale
Det supplerende materiale til denne artikel kan findes online på: https://www.frontiersin.org/articles/10.3389/fonc.2019.00876/full#supplementary-material
Abkortelser
ANA, Anaplastic astrocytoma; LDA, lineær diskriminantanalyse; MRI, Magnetic Resonance Imaging; MR, Magnetic Resonance; LASSO, Least absolute shrinkage and selection operator; GBDT, Gradient correlation decision tree; CSF, Cerebrospinal fluid; TA, Texture analysis; ROI, Regions of interest; HISTO, Histogrambaseret matrix; GLCM, Grey-level co-occurrence matrix; GLRLM, Grey-level run length matrix; GLZLM, Grey-level zone length matrix; NGLDM, Neighborhood grey-level dependence matrix; AUC, Area under receiver operating characteristic curve; PCNSL, Primary central nervous system lymphoma; MLP, Multilayer perceptron; IDH, Isocitrate dehydrogenase.
1. Torre LA, Bray F, Siegel RL, Ferlay J, Lortet-Tieulent J, Jemal A. Global cancer statistics, 2012. CA Cancer J Clin. (2015) 65:87-108. doi: 10.3322/caac.21262
PubMed Abstract | CrossRef Full Text | Google Scholar
2. Chen W, Zheng R, Baade PD, Zhang S, Zeng H, Bray F, et al. Kræftstatistik i Kina, 2015. CA Cancer J Clin. (2016) 66:115-32. doi: 10.3322/caac.21338
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Wen PY, Kesari S. Maligne gliomer hos voksne. N Engl J Med. (2008) 359:492-507. doi: 10.1056/NEJMra0708126
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Grimm SA, Chamberlain CM. Anaplastisk astrocytom. CNS Oncol. (2016) 5:145-57. doi: 10.2217/cns-2016-0002
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Batash R, Asna N, Schaffer P, Francis N, Schaffer M. Glioblastoma multiforme, diagnose og behandling; nyere litteraturgennemgang. Curr Med Chem. (2017) 24:3002-9. doi: 10.2174/0929867324666170516123206
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Weller M, van den Bent M, Hopkins K, Tonn JC, Stupp R, Falini AE, et al. EANO guideline for the diagnosis and treatment of anaplastic gliomas and glioblastoma. Lancet Oncol. (2014) 15:e395-403. doi: 10.1016/s1470-2045(14)70011-7
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Souhami L, Seiferheld W, Brachman D, Podgorsak EB, Werner-Wasik M, Lustig R, et al. Randomiseret sammenligning af stereotaktisk radiokirurgi efterfulgt af konventionel strålebehandling med carmustin med konventionel strålebehandling med carmustin til patienter med glioblastoma multiforme: rapport om Radiation Therapy Oncology Group 93-05-protokol. Int J Radiat Oncol Biol Phys. (2004) 60:853-60. doi: 10.1016/j.ijrobp.2004.04.011
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Burger PC, Heinz ER, Shibata T, Kleihues P. Topografisk anatomi og CT-korrelationer i det ubehandlede glioblastoma multiforme. J Neurosurg. (1988) 68:698-704. doi: 10.3171/jns.1988.68.5.0698
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Wick W, Platten M, Meisner C, Felsberg J, Tabatabai G, Simon M, et al. Temozolomid kemoterapi alene versus strålebehandling alene til malignt astrocytom hos ældre: det randomiserede fase 3-forsøg NOA-08. Lancet Oncol. (2012) 13:707-15. doi: 10.1016/s1470-2045(12)70164-x
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Chen W, Silverman HD. Fremskridt i evalueringen af primære hjernetumorer. Semin Nucl Med. (2008) 38:240-50. doi: 10.1053/j.semnuclmed.2008.02.005
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Burger PC, Vogel FS, Green SB, Strike AT. Glioblastoma multiforme og anaplastisk astrocytoma. Patologiske kriterier og prognostiske konsekvenser. Cancer. (1985) 56:1106-11.
PubMed Abstract | Google Scholar
12. Omuro A, DeAngelis ML. Glioblastom og andre maligne gliomer: en klinisk gennemgang. JAMA. (2013) 310:1842-50. doi: 10.1001/jama.2013.280319
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Lakhman Y, Veeraraghavan H, Chaim J, Feier D, Goldman DA, Moskowitz CS, et al. Differentiering af uterin leiomyosarcoma fra atypisk leiomyom: diagnostisk nøjagtighed af kvalitative MR-billeddannelsestræk og gennemførlighed af teksturanalyse. Eur Radiol. (2017) 27:2903-15. doi: 10.1007/s00330-016-4623-9
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Skogen K, Schulz A, Dormagen JB, Ganeshan B, Helseth E, Server A. Diagnostic performance of texture analysis on MRI in grading cerebral gliomas. Eur J Radiol. (2016) 85:824-9. doi: 10.1016/j.ejrad.2016.01.013
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Gibbs P, Turnbull WL. Texturanalyse af kontrastforstærkede MR-billeder af brystet. Magn Reson Med. (2003) 50:92-8. doi: 10.1002/mrm.10496
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Castellano G, Bonilha L, Li LM, Cendes F. Texturanalyse af medicinske billeder. Clin Radiol. (2004) 59:1061-9. doi: 10.1016/j.crad.2004.07.008
PubMed Abstract | CrossRef Full Text | Google Scholar
17. Davnall F, Yip CS, Ljungqvist G, Selmi M, Ng F, Sanghera B, et al. Vurdering af tumorheterogenitet: et nyt billeddannelsesværktøj til klinisk praksis? Indsigt i billeddannelse. (2012) 3:573-89. doi: 10.1007/s13244-012-0196-6
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Xiao DD, Yan PF, Wang YX, Osman MS, Zhao YH. Glioblastom og primær lymfom i centralnervesystemet: præoperativ differentiering ved hjælp af MRI-baseret 3D-teksturanalyse. Clin Neurol Neurosurg. (2018) 173:84-90. doi: 10.1016/j.clineuro.2018.08.004
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Itakura H, Achrol AS, Mitchell LA, Loya JJ, Liu T, Westbroek EM, et al. Magnetic resonance image features identify glioblastoma phenotypic subtypes with distinct molecular pathway activities. Sci Transl Med. (2015) 7:303ra138. doi: 10.1126/scitranslmed.aaa7582
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Nioche C, Orlhac F, Boughdad S, Reuze S, Goya-Outi J, Robert C, et al. LIFEx: et freewareprogram til beregning af radiomiske egenskaber i multimodal billeddannelse for at fremskynde fremskridt i karakteriseringen af tumorheterogenitet. Cancer Res. (2018) 78:4786-9. doi: 10.1158/0008-5472.Can-18-0125
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Hu LS, Ning S, Eschbacher JM, Gaw N, Dueck AC, Smith KA, et al. Multiparametrisk MRI og teksturanalyse til visualisering af rumlig histologisk heterogenitet og tumorudbredelse i glioblastoma. PLoS ONE. (2015) 10:e0141506. doi: 10.1371/journal.pone.0141506
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Florez E, Nichols T, Parker EE, Lirertte ST, Howard CM, Fatemi A. Multiparametrisk magnetisk resonansbilleddannelse til vurdering af primære hjernetumorer gennem radiomiske egenskaber: en metrik til guidet strålebehandlingsplanlægning. Cureus. (2018) 10:e3426. doi: 10.7759/cureus.3426
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Mahmoud-Ghoneim D, Alkaabi MK, de Certaines JD, Goettsche MF. Indvirkningen af billedets dynamiske område på teksturklassificering af hjernens hvide substans. BMC Med Imaging. (2008) 8:18. doi: 10.1186/1471-2342-8-18
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Ahn SY, Park CM, Park SJ, Kim HJ, Song C, Lee SM, et al. Prognostisk værdi af computertomografiske teksturtrækninger i ikke-småcellede lungekræftformer, der behandles med definitiv sideløbende kemoradioterapi. Invest Radiol. (2015) 50:719-25. doi: 10.1097/rli.00000000000000000174
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Suh HB, Choi YS, Bae S, Ahn SS, Chang JH, Kang SG, et al. Primært lymfom i centralnervesystemet og atypisk glioblastom: Differentiering ved hjælp af radiomisk tilgang. Eur Radiol. (2018) 28:3832-9. doi: 10.1007/s00330-018-5368-4
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Mouthuy N, Cosnard G, Abarca-Quinones J, Michoux N. Multiparametrisk magnetisk resonansbilleddannelse til differentiering af højgradsgliomer og hjernemetastaser. J Neuroradiol. (2012) 39:301-7. doi: 10.1016/j.neurad.2011.11.002
PubMed Abstract | CrossRef Full Text | Google Scholar
27. Glotsos D, Spyridonos P, Cavouras D, Ravazoula P, Dadioti PA, Nikiforidis G. Et billedanalyse-system baseret på supportvektormaskiner til automatisk graddiagnostik af astrocytomer i hjerne-tumorer i klinisk rutine. Med Inform Internet Med. (2005) 30:179-93. doi: 10.1080/14639230500077444
PubMed Abstract | CrossRef Full Text | Google Scholar
28. Dellacasa Bellingegni A, Gruppioni E, Colazzo G, Davalli A, Sacchetti R, Guglielmelli E, et al. NLR, MLP, SVM og LDA: en sammenlignende analyse af EMG-data fra personer med transradial amputation. J Neuroeng Rehabil. (2017) 14:82. doi: 10.1186/s12984-017-0290-6
PubMed Abstract | CrossRef Full Text | Google Scholar
29. Ion-Margineanu A, Van Cauter S, Sima DM, Maes F, Sunaert S, Himmelreich U, et al. Klassificering af glioblastoma multiforme opfølgende progressive vs. responsive former ved hjælp af multiparametriske MRI-egenskaber. Front Neurosci. (2016) 10:615. doi: 10.3389/fnins.2016.00615
PubMed Abstract | CrossRef Full Text | Google Scholar
30. Fetit AE, Novak J, Peet AC, Peet AC, Arvanitits NT. Tre-dimensionelle teksturelle træk ved konventionel MRT forbedrer den diagnostiske klassificering af hjernetumorer hos børn. NMR Biomed. (2015) 28:1174-84. doi: 10.1002/nbm.3353
PubMed Abstract | CrossRef Full Text | Google Scholar
31. Sun K, Huang SH, Wong DS, Jang SS. Design og anvendelse af en variabel udvælgelsesmetode for flerlags perceptron neuralnetværk med LASSO. IEEE Trans Neural Netw Learn Syst. (2017) 28:1386-96. doi: 10.1109/tnnls.2016.2542866
PubMed Abstract | CrossRef Full Text | Google Scholar
32. Louis DN, Perry A, Reifenberger G, von Deimling A, Figarella-Branger D, Cavenee WK, et al. Verdenssundhedsorganisationens 2016-klassifikation af tumorer i centralnervesystemet: et resumé. Acta Neuropathol. (2016) 131:803-20. doi: 10.1007/s00401-016-1545-1
PubMed Abstract | CrossRef Full Text | Google Scholar




