Frontiers in Pharmacology
Introduktion
Olanzapin er et af de mest udbredte andengenerations antipsykotika (SGA’er) til behandling af skizofreni, bipolar lidelse og psykotiske symptomer. Ud over at forbedre de vigtigste symptomer på psykose viser olanzapin stor acceptabilitet, mindsker afbrydelsen af alle årsager og forebygger fremtidige tilbagefald (Leucht et al., 2009). Mange randomiserede kliniske forsøg (RCT’er) og metaanalyser har antydet, at olanzapin er et af de mest effektive antipsykotiske lægemidler til patienter med skizofreni (Leucht et al., 2013; Huhn et al., 2019).
Den mest almindelige bivirkning ved olanzapin er vægtøgning (Allison et al., 1999). Olanzapin fremkalder den største vægtøgning af de SGA’er. Comparison of Atypicals for First Episode (CAFE)-forsøget viste, at 80 % af de patienter, der blev behandlet med olanzapin, tog mere end 7 % af deres oprindelige kropsvægt på i uge 52 (McEvoy et al., 2007). Ophørsprocenten for olanzapin på grund af vægtøgning eller ledsagende metaboliske virkninger var 2-8 gange højere end for andre antipsykotika i Clinical Antipsychotic Trials in Intervention Effectiveness (CATIE)-forsøget (Lieberman et al., 2005) (CATIE) (Lieberman et al., 2005). Ud over at være forbundet med nedsat overholdelse af lægemiddelbehandlingen er vægtøgning også forbundet med betydelig medicinsk morbiditet og mortalitet. I betragtning af den høje fedmefrekvens hos patienter med skizofreni (42 %) bør den potentielle risiko for olanzapin-induceret vægtøgning vurderes omhyggeligt (Newcomer, 2006). Nogle randomiserede kontrollerede forsøg (RCT-undersøgelser) har fundet, at patienter med psykiske sygdomme dør op til 30 år tidligere end den generelle befolkning (Das-Munshi et al., 2017). Den vigtigste dødsårsag i denne befolkning er hjertesygdomme. En væsentlig risikofaktor for hjertesygdom og for tidlig død hos disse patienter er vægtøgning (Fekadu et al., 2015).
De mekanismer, der ligger til grund for antipsykotika-induceret vægtøgning og negative metaboliske virkninger, er ikke velforstået (Correll et al., 2011). Olanzapin er forbundet med forhøjet appetit og fødeindtagelse og nedsat aktivitet eller forringelse af den metaboliske regulering (Roerig et al., 2005; Henderson et al., 2015). Fountaine et al. rapporterede, at olanzapin hos raske mænd øgede kropsvægten gennem øget fødeindtagelse uden tegn på nedsat aktivitets- eller udgiftsniveau (Fountaine et al., 2010). Denne observation er i overensstemmelse med observationer af mandlige unge indlagte patienter med skizofreni (Gothelf et al., 2002). Patienterne havde et signifikant øget kropsmasseindeks som følge af øget kalorieindtag efter 4-ugers olanzapinbehandling (Gothelf et al., 2002). De nuværende beviser vedrørende sammenhængen mellem appetit og vægtøgning er imidlertid ikke entydige (Poyurovsky et al., 2007; Case et al., 2010). Case et al. rapporterede, at tidlige appetitændringer ikke konsekvent var korreleret med den samlede vægtændring i fire forskellige forsøg (Case et al., 2010). Endvidere har ingen undersøgelse rapporteret det nøjagtige tidspunkt for appetitforøgelse, sammenlignet vægtøgningshastighed i forhold til tidspunktet for øget appetit eller vurderet forskelle i vægtøgning og metaboliske virkninger mellem patienter med øget eller uændret appetit. Derfor evaluerede vi sammenhængen mellem appetitforøgelse og olanzapin-inducerede vægtændringer og ledsagende metaboliske virkninger hos lægemiddelnaive første-episode-patienter med skizofreni.
Materialer og metoder
Deltagere
Denne undersøgelse blev gennemført i Mental Health Institute of the Second Xiangya Hospital, Central South University, Kina mellem december 2016 og april 2019. Deltagerne blev vurderet for skizofreni i overensstemmelse med de kriterier, der er defineret i Diagnostic and Statistical Manual of Mental Disorders-Fifth Edition (DSM-5) (A.P. Association, 2013). Da antipsykotika-naiv/første episode-patienter synes at tage mere på i vægt efter olanzapinbehandling (Correll et al, 2011), inkluderede vi første-episode skizofreni-patienter i alderen 18-50 år blev inkluderet i denne undersøgelse.
Udelukkelseskriterierne omfattede (i) klinisk unormale fund af fysiske undersøgelser, laboratorieprøver eller elektrokardiogram (EKG)-resultater; (ii) lidelser såsom intellektuel funktionsnedsættelse, stof- eller alkoholforstyrrelse, en diagnose af andre specifikke systemiske sygdomme i henhold til DSM-5-kriterierne; (iii) kardiovaskulære og metaboliske sygdomme såsom diabetes mellitus, dyslipidæmi og hypertension; (iv) en historie med spiseforstyrrelser; (v) streng diæt inden for måneden før screeningen eller under undersøgelsen; og (vi) graviditet eller amning.
Intervention
Fremtidige undersøgelser har antydet, at hastigheden af olanzapin-induceret vægtøgning var hurtigst i løbet af de første 12 ugers behandling (Correll et al, 2009). Derfor blev deltagerne behandlet med olanzapin (15-20 mg/dag kl. 20.00 om aftenen) i 12 uger. Den indledende dosis olanzapin var 5 mg/dag og blev derefter justeret til 15-20 mg/dag i den første uge.
Bedømmelse
Baselinevurderinger omfattede demografiske oplysninger, en grundig sygehistorie, antropometriske målinger (vægt og højde), appetit, fysisk undersøgelse og laboratorieanalyser. Appetitten blev vurderet dagligt, 30 min. før frokost, med fire standardiserede spørgsmål: Sult, Føler mig mæt, Tænker på mad og Overspisning. Svarene blev bedømt på en skala fra 0 til 10, hvor 0 = “slet ikke” og 10 = “ekstremt”. Appetitstigning blev defineret som en >10% stigning i baseline appetitscore. Appetitnedsættelse blev defineret som et >10 % fald i baseline-appetitscorerne. Den positive og negative syndromskala (PANSS) blev anvendt til at vurdere sværhedsgraden af skizofrenisymptomer. Bivirkninger blev evalueret ved hjælp af Treatment Emergent Symptom Scale (TESS). Ved hvert opfølgningsbesøg blev alle baseline-evalueringer (herunder fysisk undersøgelse, antropometriske målinger, appetit og TESS) gentaget undtagen PANSS. PANSS blev revurderet i uge 12.
Før behandlingen og i fastende tilstand blev vægt og højde målt, efter at deltagerne havde fjernet sko med let indendørs tøj. Appetit blev vurderet før frokost og var baseret på bedømmelsen af vurderingslægen på undersøgelsesdagen. Laboratoriearbejde, herunder plasmaglukose, lever- og nyrefunktion, blev vurderet ved hjælp af enzymatiske procedurer med Boehringer Mannheim/Hitachi 714 automatiseret kemianalysator. Insulin blev målt med en fastfase enzyme-linked immunosorbent assays (ELISA).
De primære resultater var procentdelen af patienter, der havde øget appetit, og tidsrummet mellem olanzapinbehandling og øget appetit. Sekundære resultater omfattede ændringer i vægt, kropsmasseindeks (BMI), fastende glukose, fastende insulin og insulinresistensindeks, lipidprofiler, som omfattede triglycerider, kolesterol, lipoprotein med høj densitet (HDL-C) og lipoprotein med lav densitet (LDL-C) samt PANSS-score. BMI blev beregnet i henhold til kriterierne fra Working Group on Obesity in China: sund vægt (18,5 ≤ BMI <25 kg/m2), overvægt (25 ≤ BMI ≤ 28 kg/m2) og fedme (BMI > 28 kg/m2). Dyslipidæmi blev defineret som kolesterol ≥ 5,18 mmolċl-1, triglycerider ≥ 1,70 mmolċl-1, HDL-C < 1,04 mmolċl-1 eller LDL-C ≥ 3,37 mmolċl-1 baseret på de kinesiske retningslinjer for dyslipidæmi (Hu, 2017). En analyse af andelen af patienter, der tog mere end 7 % af deres baseline-kropsvægt på efter 12 uger, hvilket er grænsen for klinisk signifikant vægtøgning, blev også inkluderet (Kanders et al., 1991).
Statistisk analyse
Statistical Package for Social Sciences, version 25.0 (SPSS v25.0) blev anvendt til statistisk analyse. Kontinuerlige variabler og kategoriske variabler beskrives ved hjælp af sammenfattende statistikker (gennemsnit og standardafvigelser) eller hhv. hyppigheder og procentdele. Student’s t-test og chi square-analyser blev anvendt til at analysere forskelle mellem grupperne i ændringer af kropsvægt, BMI, fastende glukose og insulin, insulinresistensindeks, triglycerid, kolesterol, HDL-C og LDL-C fra baseline til hvert tidspunkt. Vi undersøgte sammenhængen mellem vægt, BMI, insulinresistensindeks, LDL-C og appetit ved hjælp af lineær regressionsanalyse. En P-værdi (p) < 0,05 blev betragtet som statistisk signifikant.
Resultater
I alt 33 skizofrene indlagte patienter (gennemsnitsalder, 23,5 år; interval 18-36 år) blev indskrevet i undersøgelsen. Der var en højere andel af kvindelige patienter (63,6 %, 21/33). Alle patienter var i det normale BMI-interval (gennemsnitlig BMI, 21,3 ± 1,7 kg/m2). Den gennemsnitlige varighed af skizofreni var 11,2 ± 3,7 (interval 5-18) måneder. To kvindelige patienter faldt ud af undersøgelsen efter 4 uger på grund af øget appetit; de resterende 31 (93,9 %) deltagere gennemførte undersøgelsen (tabel 1).
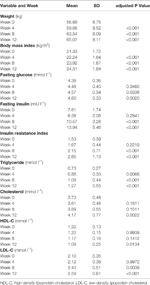
Tabel 1 Oversigt over vægt og metaboliske målinger efter undersøgelse.
Appetitstigning efter olanzapinbehandling
Efter 12 ugers olanzapinbehandling havde 77,4 % (24/31) patienter øget appetit, og 22,6 % (7/31) patienter havde uændret appetit. Som det fremgår af figur 1, begyndte appetitforøgelsen for de 24 patienter, der havde øget appetit, inden for de første 8 uger af olanzapinbehandlingen og varede indtil behandlingens afslutning. Den gennemsnitlige tid fra olanzapinbehandlingsstart til appetitstigning var 20,3 dage (SD = 14,4), og 25,0 % (6/24) og 70,8 % (17/24) øgede deres appetit inden for henholdsvis 1 uge og 4 uger. To patienter øgede deres appetit på den 3. dag efter olanzapinbehandling. Der blev ikke fundet nogen signifikant forskel i olanzapin-induceret appetit mellem forskellige køn ved hjælp af tovejsanalyse ANOVA.
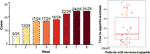
Figur 1 Antal patienter med øget appetit i løbet af 8 ugers olanzapinbehandlingsperioder.
Ændringer i kropsvægt og BMI efter olanzapinbehandling
Signifikante stigninger i vægt og BMI blev observeret efter olanzapinbehandling (tabel 1). Den gennemsnitlige vægtøgning var 7,9 kg i løbet af 12-ugers perioden med olanzapinbehandling, hvor patienterne tog 2,4, 4,0 og 1,5 kg på i henholdsvis den første, anden og tredje 4-ugers periode. Kvindelige patienter var mere tilbøjelige til at tage på i vægt (P < 0,001), med en gennemsnitlig vægtøgning på 9,19 kg i løbet af undersøgelsesperioden sammenlignet med en vægtøgning på 5,90 kg hos mandlige patienter. Af de samlede patienter øgede 80,6 % (25/31) og 61,3 % (19/31) deres oprindelige kropsvægt med henholdsvis mere end 7 % og 10 % i løbet af den 12 ugers olanzapinbehandling (Supplerende tabel 1). Efter 12 uger blev 51,6 % (16/31) af patienterne overvægtige (BMI>25 kg/m2).
Ændringer af metaboliske forstyrrelser efter olanzapinbehandling
Signifikante stigninger i fastende glukose, fastende insulin, insulinresistensindeks, triglycerid, kolesterol og LDL-C og fald i HDL-C blev observeret efter 12 uger (Tabel 1). Ingen af de patienter, der indgik i undersøgelsen, havde dyslipidæmi ved baseline. Baseret på kinesiske retningslinjer for dyslipidæmi havde 38,7 % (12/31) af patienterne dyslipidæmi efter 12 ugers olanzapinbehandling.
Appetitstigning og olanzapininduceret vægtøgning
For at påvise effekten af øget appetit på olanzapininduceret vægtøgning inddelte vi patienterne i to grupper (gruppe med øget appetit og gruppe med uændret appetit ) baseret på, om appetitten steg eller ikke steg efter 12 ugers olanzapinbehandling.
Sammenlignet med gruppen med uændret appetit var der signifikante stigninger i vægt- og BMI-niveauer i gruppen med øget appetit efter 12 ugers olanzapinbehandling (Tabel 2). Figur 2 viste sammenligningen af vægtøgning og metabolisk relaterede resultater mellem grupper med øget og uændret appetit. Detaljerede analyser blev præsenteret i Supplerende tabel 2. Vægtforøgelsen mellem to grupper var signifikant (P = 0,01) ved hjælp af tovejsanalyse ANOVA. Den gennemsnitlige vægt steg med 9,1 kg (SD = 4,1) i den appetitforøgede gruppe og 3,9 kg (SD = 2,0) i den uændrede appetitgruppe med signifikant forskel mellem de to grupper i løbet af 12 ugers olanzapinbehandlingsperiode. En større procentdel af patienterne (91,7 %) i gruppen med øget appetit tog mere end 7 % af deres oprindelige kropsvægt på efter 12 uger sammenlignet med patienterne i gruppen med uændret appetit (42,9 %; χ2 = 8,27, df = 1, p = 0,004). Tilsvarende steg flere patienter i gruppen med øget appetit (19/24, 79,2 %) mere end 10 % af den oprindelige kropsvægt efter 12 uger sammenlignet med patienter i gruppen med uændret appetit (0,0 %; χ2 = 14,32, df = 1, p < 0,001) (Supplerende tabeller 3-5) (Supplerende tabeller 3-5). Efter 12 ugers olanzapinbehandling blev 58,3 % af patienterne overvægtige i gruppen med øget appetit sammenlignet med 28,6 % af patienterne i gruppen med uændret appetit. Appetitstigning medierede stærkt olanzapin-induceret vægtøgning med medierende effekt 66,2 %.

Tabel 2 Deskriptiv statistik over resultatmålinger mellem grupper med øget og uændret appetit ved baseline og ugerne 4, 8 og 12.
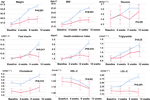
Figur 2 Sammenligning af kropsvægt, BMI, glukose- og lipidniveauer mellem grupper med øget og uændret appetit. Blå linje angiver patienter med øget appetit; rød linje angiver patienter med uændret appetit.
Appetitstigning og Olanzapin-inducerede metaboliske forstyrrelser
Der var signifikante forskelle i insulin (p = 0,017), insulinresistensindeks (p = 0,015) og LDL-C (p = 0,001) mellem appetitstigningsgruppen og den uændrede gruppe efter 12 uger (Figur 2 og Tabel 2). Fire patienter i appetitforøgelsesgruppen havde kolesterol ≥ 5,18 mmolċl-1, ni havde triglycerider ≥ 1,70 mmolc-1, seks havde HDL-C < 1,04 mmolc-1, og tre havde LDL-C ≥ 3,37 mmolc-1 ved uge 12. I alt 13/24 patienter i gruppen med øget appetit havde dyslipidæmi efter 12 uger, mens ingen af patienterne i gruppen med uændret appetit udviklede dyslipidæmi i løbet af undersøgelsesperioden (tabel 3).

Tabel 3 Dyslipidæmi defineret ved hver enkelt resultatmåling i grupperne med øget appetit og uændret appetit.
Den maksimale vægtøgning, der blev nået 1 måned efter måneden med appetitforøgelse
I gruppen med øget appetit analyserede vi den gennemsnitlige vægtøgning for hver patient på fire tidspunkter: før måneden med tid til appetitforøgelse (-1M), måneden med tid til appetitforøgelse (0M), en måned efter appetitforøgelse (+1M) og to måneder efter appetitforøgelse (+2M). Sammenlignet med -1M var der en stigning i vægtøgning ved 0M, men denne ændring var ikke signifikant (-1M vs. 0M, 1,4 ± 1,2 kg vs. 3,1 ± 1,4 kg). Vægtforøgelsen gik ind i maksimal vækst ved +1M, med en 4,3 ± 2.4 kg stigning. Vægtvæksten blev langsommere ved +2M (p < 0,001) med 1,6 ± 1,5 kg. Vægtforøgelsen ved +2M bremsede op og stabiliseredes, og der blev ikke observeret nogen signifikante forskelle sammenlignet med -1M (Figur 3 og Supplerende tabel 6).
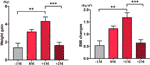
Figur 3 Gennemsnitlig vægtforøgelseshastighed i gruppen med øget appetit. Den gennemsnitlige vægtøgning for hver patient pr. måned i løbet af undersøgelsesperioden blev analyseret på fire tidspunkter: før måneden med øget appetit (-1M), måneden med øget appetit (0M), 1 måned efter måneden med øget appetitøgning (+1M), og 2 måneder efter måneden med øget appetit (+2M). ** angiver P < 0.01, *** angiver P < 0.001.
Førre øget appetit forudsiger mere vægtøgning i 1 måned efter måneden for appetitforøgelse
Vi sammenlignede yderligere vægtøgningshastigheden for deltagere med øget appetit inden for 4 uger (A) og deltagere med øget appetit mellem 4 og 8 uger (B). Ved 0M var vægtøgningshastighederne mellem deltagere med øget appetit inden for 4 uger og deltagere med en øget appetit mellem 4 og 8 uger ikke signifikant forskellige. Deltagere med tidligere øget appetit viste imidlertid en signifikant øget vægtøgningshastighed ved +1M. Disse resultater viste, at tidligere øget appetit kunne føre til en større vægtøgning i opfølgningsperioden (figur 4). Der blev observeret lignende ændringer i BMI i løbet af de fire tidspunkter (figur 3 og 4).
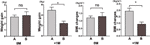
Figur 4 Sammenligning af vægtøgningshastighed hos deltagere med øget appetit i forskellige måneder. Vi sammenlignede vægtøgningshastigheden for deltagere med øget appetit inden for 4 uger (A) og deltagere med øget appetit mellem 4 og 8 uger (B) i måneden med tid til øget appetit (0M) og 1 måned efter måneden med tid til øget appetit (+1M). ns, angiver ikke signifikant, * angiver P < 0,05.
Appetit og hastighed af ændringer i stofskifteforstyrrelser
Detaljerede beskrivende data for ændringer i vægt, BMI, fastende glukose, insulin, insulinresistensindeks, triglycerid, kolesterol, HDL-C og LDL-C er opsummeret i tabel 2 For at undersøge sammenhængen mellem øget appetit og glukose- og lipidmetabolisme analyserede vi ændringer i disse indikatorer på fire tidspunkter i gruppen med øget appetit. Der blev ikke observeret signifikante hastighedsændringer for glukose, triglycerid, HDL-C og LDL-C på noget tidspunkt. Signifikante stigninger i hastighederne for insulin og insulinresistensindeks blev kun observeret ved +2M (Supplerende figur 1 og Supplerende tabel 6). Yderligere sammenligninger tydede på, at deltagere med øget appetit inden for 4 uger ikke viste signifikant øget hastighed af insulin og insulinresistensindeks ved 0M og +1M sammenlignet med deltagere med øget appetit mellem 4 og 8 uger (Supplerende figur 2).
Forudsigelsen af appetit på Olanzapin-induceret vægtøgning og metaboliske forstyrrelser
Vi udførte lineær regressionsanalyse for at evaluere effekten af appetitforøgelse på vægtøgning, blodglukose- og lipidniveauer. Efter at have kontrolleret for statistisk signifikante variabler såsom køn, alder, højde og varighed inkluderede vi vægtøgning, BMI, fastende glukose, insulin, insulinresistensindeks, triglycerider, kolesterol, HDL-C og LDL-C som afhængige variabler og appetit som den uafhængige variabel i regressionsanalysen. Appetitstigning var forbundet med ændringer i vægt (β = 0.67, p = 0.0003), BMI (β = 0.63, p = 0.0004), insulin (β = 0.49, p = 0.019), insulinresistensindeks (β = 0.51, p = 0.0149) og LDL-C (β = 0.61, p = 0,0035) (Supplerende tabel 7).
Signifikante baseline-til-endpunkt-forbedringer af kliniske symptomer (evalueret ved PANSS, p < 0,001) blev observeret efter olanzapinbehandling. Der blev ikke observeret nogen signifikant forskel i PANSS mellem grupperne med øget appetit og uændret appetit (p > 0,05).
Bivirkninger
Af alle de 31 patienter, der afsluttede undersøgelsen, var der ni (29.0%) patienter rapporterede hypoaktivitet, otte (25,8%) patienter rapporterede somnolens, fire (12,9%) patienter havde unormal leverprøve, to (6,5%) patienter rapporterede akathisia, fire (12,9%) patienter havde forstoppelse, en (3.2 %) patient havde diarré, og to (6,5 %) patienter følte sig svimmel, og 80,6 % (25/31) patienter øgede deres kropsvægt med mere end 7 % i løbet af undersøgelsesperioden.
Diskussion
I denne prospektive undersøgelse viste de vigtigste resultater, at 77,4 % af patienterne øgede deres appetit efter olanzapinbehandling, og disse patienter, der øgede deres appetit, tog mere på i vægt end de patienter med uændret appetit (9,1 kg vs. 3,9 kg). Tilsvarende øgede flere patienter i gruppen med øget appetit deres oprindelige kropsvægt med mere end 7 eller 10 %, hvilket tyder på, at øget appetit er forbundet med betydelig vægtøgning hos lægemiddelnaive skizofreni-patienter i første episode, der behandles med olanzapin. Desuden understøttede lineær regressionsanalyse også, at appetitforøgelse var stærkt forbundet med olanzapin-induceret vægtøgning. Disse resultater var i overensstemmelse med tidligere rapporter (Gothelf et al., 2002; Cope et al., 2005). Murashita et al. (2005) observerede øgede appetitstimulerende ghrelinniveauer og kropsfedtprocent hos skizofrenipatienter, der blev behandlet med olanzapin. Resultaterne fra en randomiseret dobbeltblind undersøgelse tydede på, at olanzapin i højere grad end clozapin fremkaldte madtrang og spiseforstyrrelser (Murashita et al., 2005; Kluge et al., 2007). Lignende resultater blev også rapporteret i mus, der blev behandlet med olanzapin (Cope et al., 2005). Virkningen af olanzapin på flere receptorsteder, især D2- og 5H3-receptorerne, som modulerer appetitten, er også blevet anvendt til behandling af anorexia nervosa og kemoterapi-induceret kvalme og opkastning (Kluge et al., 2007; Tan et al., 2009; Kafantaris et al., 2011).
Vi fandt også, at 70,8 % af patienterne øgede deres appetit inden for de første 4 uger af den indledende olanzapinbehandling med et gennemsnit på 20,3 dage for at øge. Nogle patienter øgede endda deres appetit så tidligt som den tredje dag efter olanzapinbehandling. Det er interessant, at patienter, hvis appetit blev øget tidligere i tiden, sandsynligvis tog mere på i vægt end patienter, hvis appetit blev øget senere i tiden, og vægtøgningen toppede 1 måned efter, at den øgede appetit opstod. Selv om der ikke blev fundet nogen signifikant forskel i olanzapin-induceret appetit mellem mandlige og kvindelige patienter, var det mere sandsynligt, at kvindelige patienter tog på i vægt (P < 0,001). Appetit bør derfor betragtes som en indikator til forudsigelse af olanzapininduceret vægtøgning, især hos kvindelige patienter. I kliniske indstillinger bør læger være mere opmærksomme på patienter, hvis appetit stiger tidligt efter olanzapinbehandling, og bør starte en plan for at forebygge vægt.
Olanzapinbehandlede patienter udviste en stigning på mere end 7% af den oprindelige kropsvægt, hvilket er i overensstemmelse med tidligere resultater (Gothelf et al., 2002; Wu et al., 2008). Ud over en betydelig vægtøgning havde patienter med olanzapinbehandling signifikant forstyrret glukose- og lipidmetabolisme efter 12 uger, hvilket er i overensstemmelse med tidligere offentliggjorte observationer hos patienter med skizofreni (Correll et al., 2011). Sammenlignet med patienter i gruppen med uændret appetit havde gruppen med øget appetit signifikante lipidabnormaliteter. Fasting glukose var ikke signifikant forskellig mellem de to grupper. Deltagere med tidlig øget appetit viste ikke øget insulinhastighed og insulinresistensindeks i de følgende måneder efter øget appetit. Det er muligt, at glukoseniveauerne er uafhængige af vægtøgning, da appetitten ikke påvirkede glukoseniveauerne.
Negative fysiske sundhedsresultater forbundet med antipsykotika, såsom vægtøgning, metaboliske forstyrrelser og relateret morbiditet, er længe blevet anerkendt (Wu et al., 2016). Tidligere undersøgelser har antydet, at appetitten kan forudsige olanzapin-induceret vægtøgning og negative metaboliske virkninger (Gothelf et al., 2002; Poyurovsky et al., 2007; Fountaine et al., 2010). Så vidt vi ved, er dette den første undersøgelse, der vurderer sammenhængen mellem appetit, vægtøgning og metaboliske forstyrrelser efter olanzapinbehandling hos lægemiddelnaive skizofrenipatienter i første episode af skizofreni i første fase. Nogle resultater giver os flere beviser for, hvordan man vælger medicin fornuftigt i klinisk arbejde og giver flere fordele til forebyggelse af olanzapin-induceret vægtøgning og metaboliske forstyrrelser.
Der er flere begrænsninger i vores undersøgelse. For det første målte denne undersøgelse ikke fødeindtagelse såsom måltider og snacks, selv om alle inkluderede patienter fik den samme standardiserede fødevaremenu. Et højt fedt- og fruktoseindtag kan mindske appetitkontrollen ved at påvirke den centrale appetitregulering. Faktisk har diæter med højt fructoseindhold negative virkninger på central appetitsignalering og kognitiv funktion (Lowette et al., 2015; Dalvi et al., 2017). For det andet undersøgte vi ikke leptin- og ghrelin-niveauer i løbet af undersøgelsesperioden. Leptin og ghrelin, der udskilles fra henholdsvis fedtvæv og mave, spiller afgørende roller i reguleringen af fødeindtagelse og energimetabolisme (Cui et al., 2017). Flere undersøgelser fandt et øget leptinniveau og et nedsat ghrelinniveau i de første par uger efter påbegyndelse af olanzapinbehandling (Basoglu et al., 2010; Stip et al., 2012; Lu et al., 2015). Stigningen i leptinniveauet forbliver stabil i flere uger, men ghrelinniveauet stiger i den længere periode (Sentissi et al., 2008). Yderligere undersøgelser bør overvåge leptin- og ghrelinreaktionerne på appetitforøgelse samt deres relationer til metaboliske parametre og kliniske virkninger. Desuden overvågede vi ikke aktivitetsniveauet i løbet af undersøgelsesperioden. Selv om nogle undersøgelser rapporterede, at olanzapin øgede kropsvægten udelukkende ved at øge appetitten og fødeindtagelsen uden signifikante forskelle i hvilenergiforbruget (Gothelf et al., 2002; Fountaine et al., 2010). En række undersøgelser rapporterede om nedsat fysisk aktivitet med olanzapinmedicinering (Perez-Cruzado et al., 2018). I vores undersøgelse rapporterede 29,0 % patienter hypoaktivitet og 25,8 % patienter rapporterede somnolens i løbet af den 12 ugers olanzapinbehandlingsperiode. Hillebrand et al. (2005) fandt, at olanzapinbehandling reducerede fysisk fysisk aktivitet hos rotter, der var udsat for aktivitetsbaseret anoreksi. Olanzapinbehandling reducerede også aktivitetsniveauet hos patienter med anorexia nervosa, uden signifikante forskelle i kropsvægt og plasma leptinniveauer sammenlignet med ubehandlede patienter. Vores tidligere undersøgelse viste, at livsstilsinterventioner, som omfattede psykoedukative, diæt- og motionsprogrammer, kan reducere antipsykotika-induceret vægtøgning (Wu et al., 2008). Desuden ville det være bedre at sammenligne flere patienter med sunde kontroller af samme alder, hvilket kan hjælpe med at fortolke olanzapin-induceret appetitstigning og metaboliske ændringer er specifikt relateret til dets farmakologiske egenskaber. Yderligere undersøgelser bør fokusere på mekanismerne bag den øgede appetit efter olanzapinbehandling (Koopmann et al., 2012; Sweeney et al., 2017; Mancuso et al., 2019). Belønningssystemet i striatalregioner kan være forbundet med antipsykotika-associeret vægtøgning (Nielsen et al., 2016). Ændret aktivitet i den subgenuale anterior cingulære cortex kan også delvist understøtte øget appetit efter olanzapinbehandling (Pawlowski et al., 2018). Billeddannelsesundersøgelser bør udføres for at undersøge olanzapinmodulation af relateret dyb hjerneaktivitet relateret til appetit.
Konklusioner
Sammenfattende har vores undersøgelse vist, at appetit er relateret til olanzapin-induceret vægtøgning og dyslipidæmi hos drug-naïve første-episode patienter med skizofreni. Vurdering af appetitændringer er en nem og praktisk måde til forudsigelse af vægtøgning, hvilket giver klinikere mere tid og flere muligheder for interventionsstrategier. Tidlige kostopfindelser, der har til formål at mindske appetitten og reducere fødeindtaget, kan være nyttige for vægtkontrol hos skizofreni-patienter, der behandles med olanzapin.
Data Availability Statement
Datasættene genereret til denne undersøgelse er tilgængelige på anmodning til den tilsvarende forfatter.
Ethisk erklæring
Denne undersøgelse blev udført i overensstemmelse med Helsinki-erklæringen (G.A.o.t.W.M. Association, 2013) og godkendt af den etiske komité for det andet Xiangya-hospital, Central South University. Efter en fuldstændig beskrivelse af undersøgelsen til deltagerne blev der indhentet informeret samtykke før deltagelse i undersøgelsen.
Author Contributions
JH analyserede og fortolkede patientdataene og var en vigtig bidragyder til at skrive manuskriptet. G-RH udformede og udførte hovedsageligt undersøgelsen. YeY, C-CL, J-MX, Y-JL og X-JP hjalp med rekruttering af patienter, overvågning af datakvaliteten og dokumentation af behandlingskrævende bivirkninger. YiY hjalp med at revidere manuskriptet. J-PZ vejledte undersøgelsesdesignet. RR-W var ansvarlig for det overordnede indhold. Alle forfattere læste og godkendte det endelige manuskript.
Funding
Dette arbejde blev støttet af Key R&D Program Projects, National Science Foundation of China (Grant No.2016YFC1306900) og National Nature Science Foundation of China (Grant No.81622018 og nr. 81901401).
Interessekonflikt
Forfatterne erklærer, at forskningen blev udført uden kommercielle eller økonomiske relationer, der kunne opfattes som en potentiel interessekonflikt.
Akkreditering
Vi vil gerne anerkende det værdifulde bidrag fra deltagerne og støtten fra deres praktiserende læger. Vi vil også gerne takke flere anonyme korrekturlæsere for deres værdifulde kommentarer og forslag til forbedring af artiklens kvalitet.
Supplementært materiale
Det supplerende materiale til denne artikel kan findes online på: https://www.frontiersin.org/articles/10.3389/fphar.2020.00739/full#supplementary-material
Supplement Figur 1 | Hastighed af blodglukose- og lipidændringer i gruppen med øget appetit. De gennemsnitlige ændringsværdier for hver patient pr. måned i løbet af undersøgelsesperioden blev analyseret på fire tidspunkter: før måneden med øget appetit (-1M), måneden med øget appetit (0M), 1 måned efter måneden med øget appetitforøgelse (+1M) og 2 måneder efter måneden med øget appetit (+2M).
Supplement Figur 2 | Sammenligning af insulin- og insulinresistensindeksændringshastigheder hos deltagere med øget appetit i forskellige måneder. Vi sammenlignede hastigheden for deltagere med øget appetit inden for 4 uger (A) og deltagere med øget appetit mellem 4-8 uger (B) i måneden med tid til øget appetit (0M) og 1 måned efter måneden med tid til øget appetit (+1M).
Tabel 1 | Antal patienter, der havde øget den oprindelige kropsvægt med mere end 7 % eller 10 % ved uge 4, 8 og 12.
Tabel 2 | Antal patienter, der havde øget den oprindelige kropsvægt med mere end 7 % eller 10 % ved uge 4, 8 og 12 hos patienter med øget appetit.
Supplementtabel 3 | Antal patienter, der havde øget den oprindelige kropsvægt med mere end 7 % eller 10 % i ugerne 4, 8 og 12 hos patienter med uændret appetit.
Supplementtabel 4 | Sammenligning af antal med 7 % eller 10 % vægtforøgelse mellem patienter med øget appetit og patienter med uændret appetit i ugerne 4, 8 og 12.
Supplementtabel 5 | Analyse af hastigheden af den gennemsnitlige vægtøgning, glukose- og lipidændringer i gruppen med øget appetit på fire tidspunkter: før måneden med tid til appetitforøgelse (-1M), måneden med tid til appetitforøgelse (0M), 1 måned efter måneden med tid til appetitforøgelse (+1M) og 2 måneder efter måneden med tid til appetitforøgelse (+2M). ns angiver ikke signifikant, * angiver p-værdi < 0,05, ** angiver p-værdi < 0,01, *** angiver p-værdi < 0,001.
Supplement Tabel 6 | Estimater af appetiteffekter på vægtøgning og metabolisk relaterede resultatmål fra generel lineær blandet model, mens der kontrolleres for alder, sygdomsvarighed og køn.
Supplement Tabel 7-1 | Ændringerne af vægt, BMI, insulin, IRI og LDL-C pr. patient i løbet af behandlingsperioden i forskellige grupper.
Supplement Tabel 7-2 | Estimater af appetiteffekter på vægtøgning og metabolisk-relaterede resultatmål.
Abkortelser
SGA’er, Andengenerations antipsykotika; RCT, Randomiseret klinisk forsøg; CAFÉ, The Comparison of Atypicals for First Episode; CATIE, The Clinical Antipsychotic Trials in Intervention Effectiveness; DSM-5, The Diagnostic and Statistical Manual of Mental Disorders-Fifth Edition; EKG, elektrokardiogram; PANSS, The Positive and Negative Syndrome Scale; TESS, Treatment Emergent Symptom Scale; ELISA, Enzyme-linked immunosorbent assays; BMI, Body mass index; HDL-C, High density lipoprotein; LDL-C, Low density lipoprotein.
Allison, D. B., Mentore, J. L., Heo, M., Chandler, L. P., Cappelleri, J. C., Infante, M. C., et al. (1999). Antipsykotisk induceret vægtøgning: en omfattende forskningssyntese. Am. J. Psychiatry 156, 1686-1696. doi: 10.1176/ajp.156.11.1686
PubMed Abstract | CrossRef Full Text | Google Scholar
Association, A.P. (2013). Diagnostic and statistical manual of mental disorders (DSM-5®) (Arlington, VA: American Psychiatric Pub).
Google Scholar
Basoglu, C., Oner, O., Gunes, C., Semiz, U. B., Ates, A. M., Algul, A., et al. (2010). ghrelin, cholecystokininin, visfatin, leptin og agouti-relaterede proteinniveauer under 6-ugers olanzapinbehandling hos mandlige patienter med psykose i første episode med første episode. Int. Clin. Psychopharmacol. 25, 165-171. doi: 10.1097/YIC.0b013e3283377850
PubMed Abstract | CrossRef Full Text | Google Scholar
Case, M., Treuer, T., Karagianis, J., Karagianis, J., Hoffmann, V. P. (2010). Appetitens potentielle rolle i forbindelse med forudsigelse af vægtændringer under behandling med olanzapin. BMC Psychiatry 10, 72. doi: 10.1186/1471-244X-10-72
PubMed Abstract | CrossRef Full Text | Google Scholar
Cope, M., Nagy, T., Fernandez, J., Geary, N., Casey, D., Allison, D. (2005). Antipsykotisk lægemiddelinduceret vægtøgning: udvikling af en dyremodel. Int. J. Obes. 29, 607. doi: 10.1038/sj.ijo.0802928
CrossRef Full Text | Google Scholar
Correll, C. U., Manu, P., Olshanskiy, V., Napolitano, B., Kane, J. M., Malhotra, A. K. (2009). Kardiometabolisk risiko ved andengenerations antipsykotiske lægemidler ved førstegangsbrug hos børn og unge. Jama 302, 1765-1773. doi: 10.1001/jama.2009.1549
PubMed Abstract | CrossRef Full Text | Google Scholar
Correll, C. U., Lencz, T., Malhotra, A. K. (2011). Antipsykotiske lægemidler og fedme. Trends Mol. Med. 17, 97-107. doi: 10.1016/j.molmed.2010.10.010
PubMed Abstract | CrossRef Full Text | Google Scholar
Cui, H., Lopez, M., Rahmouni, K. (2017). De cellulære og molekylære grundlag for leptin- og ghrelinresistens i fedme. Nat. Rev. Endocrinol. 13, 338-351. doi: 10.1038/nrendo.2016.222
PubMed Abstract | CrossRef Full Text | Google Scholar
Dalvi, P. S., Chalmers, J. A., Luo, V., Han, D. Y., Wellhauser, L., Liu, Y., et al. (2017). Høj fedt inducerer akut og kronisk inflammation i hypothalamus: effekt af fedtholdig kost, palmitat og TNF-alpha på appetitregulerende NPY-neuroner. Int. J. Obes. (Lond) 41, 149-158. doi: 10.1038/ijo.2016.183
PubMed Abstract | CrossRef Full Text | Google Scholar
Das-Munshi, J., Chang, C.-K., Dutta, R., Morgan, C., Nazroo, J., Stewart, R., et al. (2017). Etnicitet og overdødelighed ved alvorlig psykisk sygdom: en kohortestudie. Lancet Psychiatry 4, 389-399. doi: 10.1016/S2215-0366(17)30097-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Fekadu, A., Medhin, G., Kebede, D., Alem, A., A., Cleare, A. J., Prince, M., et al. (2015). Overdødelighed ved alvorlig psykisk sygdom: 10-årig befolkningsbaseret kohortestudie i Etiopien på landet. Br. J. Psychiatry 206, 289-296. doi: 10.1192/bjp.bp.114.149112
PubMed Abstract | CrossRef Full Text | Google Scholar
Fountaine, R. J., Taylor, A. E., Mancuso, J. P., Greenway, F. L., Byerley, L. O., Smith, S. R., et al. (2010). Øget fødeindtagelse og energiforbrug efter administration af olanzapin til raske mænd. Obesity 18, 1646-1651. doi: 10.1038/oby.2010.6
PubMed Abstract | CrossRef Full Text | Google Scholar
G.A.o.t.W.M. Association (2013). Verdenslægeforeningens Helsinki-erklæring: etiske principper for medicinsk forskning med deltagelse af mennesker som forsøgspersoner. JAMA 10 (20) 2191-2194. doi: 10.1001/jama.2013.281053
CrossRef Full Text | Google Scholar
Gothelf, D., Falk, B., Singer, P., Kairi, M., Phillip, M., Zigel, L., et al. (2002). Vægtforøgelse i forbindelse med øget fødeindtagelse og lavt sædvanligt aktivitetsniveau hos mandlige unge skizofrene indlagte patienter, der behandles med olanzapin. Am. J. Psychiatry 159, 1055-1057. doi: 10.1176/appi.ajp.159.6.1055
PubMed Abstract | CrossRef Full Text | Google Scholar
Henderson, D. C., Vincenzi, B., Andrea, N. V., Ulloa, M., Copeland, P. M. (2015). Patofysiologiske mekanismer for øget kardiometabolisk risiko hos personer med skizofreni og andre alvorlige psykiske sygdomme. Lancet Psychiatry 2, 452-464. doi: 10.1016/S2215-0366(15)00115-7
PubMed Abstract | CrossRef Full Text | Google Scholar
Hillebrand, J. J., van Elburg, A. A., A. A., Kas, M. J., van Engeland, H., Adan, R. A. (2005). Olanzapin reducerer fysisk aktivitet hos rotter udsat for aktivitetsbaseret anoreksi: mulige implikationer for behandling af anorexia nervosa? Biol. Psychiatry 58, 651-657.
PubMed Abstract | Google Scholar
Hu, D.-Y. (2017). Nye retningslinjer og evidens for forebyggelse og behandling af dyslipidæmi og aterosklerotisk kardiovaskulær sygdom i Kina. Chronic Dis. Trans. Med. 3, 73. doi: 10.1016/j.cdtm.2016.11.001
CrossRef Full Text | Google Scholar
Huhn, M., Nikolakopoulou, A., Schneider-Thoma, J., Krause, M., Samara, M., Peter, N., et al. (2019). Sammenlignende effekt og tolerabilitet af 32 orale antipsykotika til akut behandling af voksne med multiepisode skizofreni: en systematisk gennemgang og netværksmetaanalyse. Lancet 394 (10202), 939-951. doi: 10.1016/S0140-6736(19)31135-3
PubMed Abstract | CrossRef Full Text | Google Scholar
Kafantaris, V., Leigh, E., Hertz, S., Berest, A., Schebendach, J., Sterling, W. M., et al. (2011). En placebokontrolleret pilotundersøgelse af adjunktiv olanzapin til unge med anorexia nervosa. J. Child Adolesc. Psychopharmacol. 21, 207-212. doi: 10.1089/cap.2010.0139
PubMed Abstract | CrossRef Full Text | Google Scholar
Kanders, B., Forse, R., Blackburn, G. (1991). Metoder inden for fedme. Conn “s Current Therapy. Ed. Rakel, R. E. (Philadelphia: WB Saunders), 524-532.
Google Scholar
Kluge, M., Schuld, A., Himmerich, H., Dalal, M., Schacht, A., Wehmeier, P. M., et al. (2007). Clozapin og olanzapin er forbundet med madtrang og binge eating: resultater fra en randomiseret dobbeltblind undersøgelse. J. Clin. Psychopharmacol. 27, 662-666. doi: 10.1097/jcp.0b013e31815a8872
PubMed Abstract | CrossRef Full Text | Google Scholar
Koopmann, A., von der Goltz, C., Grosshans, M., Dinter, C., Vitale, M., Wiedemann, K., et al. (2012). Forbindelsen af det appetitlige peptid acetyleret ghrelin med alkoholtrang hos tidligt abstinente alkoholafhængige personer. Psychoneuroendocrinology 37, 980-986. doi: 10.1016/j.psyneuen.2011.11.005
PubMed Abstract | CrossRef Full Text | Google Scholar
Leucht, S., Corves, C., Arbter, D., Engel, R. R., Li, C., Davis, J. M. (2009). Andengenerations- versus førstegenerations-antipsykotiske lægemidler til behandling af skizofreni: en metaanalyse. Lancet 373, 31-41. doi: 10.1016/S0140-6736(08)61764-X
PubMed Abstract | CrossRef Full Text | Google Scholar
Leucht, S., Cipriani, A., Spineli, L., Mavridis, D., Orey, D., Richter, F., et al. (2013). Sammenlignende effekt og tolerabilitet af 15 antipsykotiske lægemidler ved skizofreni: en metaanalyse af flere behandlinger. Lancet 382, 951-962. doi: 10.1016/S0140-6736(13)60733-3
PubMed Abstract | CrossRef Full Text | Google Scholar
Lieberman, J. A., Stroup, T. S., McEvoy, J. P., Swartz, M. S., Rosenheck, R. A., Perkins, D. O., et al. (2005). Effektivitet af antipsykotiske lægemidler hos patienter med kronisk skizofreni. New Engl. J. Med. 353, 1209-1223. doi: 10.1056/NEJMoa051688
CrossRef Full Text | Google Scholar
Lowette, K., Roosen, L., Tack, J., Vanden Berghe, P. (2015). Effekter af diæter med højt fructoseindhold på central appetitsignalering og kognitiv funktion. Front. Nutr. 2, 5. doi: 10.3389/fnut.2015.00005
PubMed Abstract | CrossRef Full Text | Google Scholar
Lu, M. L., Wang, T. N., Lin, T. Y., Shao, W. C., Chang, S. H., Chou, J. Y., et al. (2015). Differentielle virkninger af olanzapin og clozapin på plasmaniveauer af adipocytokiner og total ghrelin. Prog. Neuropsychopharmacol. Biol. Psychiatry 58, 47-50.
PubMed Abstract | Google Scholar
Mancuso, C., Izquierdo, A., Slattery, M., Becker, K. R., Plessow, F., Thomas, J. J., et al. (2019). Ændringer i appetitregulerende hormoner efter fødeindtagelse er forbundet med ændringer i rapporteret appetit og et mål for hedonisk spisning hos piger og unge kvinder med anoreksi nervosa. Psychoneuroendocrinology 113, 104556. doi: 10.1016/j.psyneuen.2019.104556
PubMed Abstract | CrossRef Full Text | Google Scholar
McEvoy, J. P., Lieberman, J. A., Perkins, D. O., Hamer, R. M., Gu, H., Lazarus, A., et al. (2007). Effektivitet og tolerabilitet af olanzapin, quetiapin og risperidon i behandlingen af tidlig psykose: en randomiseret, dobbeltblind 52-ugers sammenligning. Am. J. Psychiatry 164, 1050-1060. doi: 10.1176/ajp.2007.164.7.1050
PubMed Abstract | CrossRef Full Text | Google Scholar
Murashita, M., Kusumi, I., Inoue, T., Takahashi, Y., Hosoda, H., Kangawa, K., et al. (2005). Olanzapin øger plasma ghrelin niveauet hos patienter med skizofreni. Psychoneuroendocrinology 30, 106-110. doi: 10.1016/j.psyneuen.2004.05.008
PubMed Abstract | CrossRef Full Text | Google Scholar
Newcomer, J. W. (2006). Medicinsk risiko hos patienter med bipolar lidelse og skizofreni. J. Clin. Psychiatry 67, e16. doi: 10.4088/JCP.1106e16
PubMed Abstract | CrossRef Full Text | Google Scholar
Nielsen, M. Ø., Rostrup, E., Wulff, S., Glenthøj, B., Glenthøj, B., Ebdrup, B. H. (2016). Striatal belønningsaktivitet og antipsykotika-associeret vægtændring hos patienter med skizofreni i initialbehandling. JAMA Psychiatry 73, 121-128. doi: 10.1001/jamapsychiatry.2015.2582
PubMed Abstract | CrossRef Full Text | Google Scholar
Pawlowski, M., Abshir-Ahmed, Y., Beitinger, P., Steiger, A. (2018). S241. Undersøgelse af mekanismen for øget appetit efter Olanzapin ved sLORETA under søvn. Biol. Psychiatry 83, S441-S442.
Google Scholar
Perez-Cruzado, D., Cuesta-Vargas, A., Vera-Garcia, E., Mayoral-Cleries, F. (2018). Medicinering og fysisk aktivitet og fysisk fitness ved alvorlig psykisk sygdom. Psychiatry Res. 267, 19-24. doi: 10.1016/j.psychres.2018.05.055
PubMed Abstract | CrossRef Full Text | Google Scholar
Poyurovsky, M., Fuchs, C., Pashinian, A., Levi, A., Faragian, S., Maayan, R., et al. (2007). Afdæmpende virkning af reboxetin på appetit og vægtøgning hos olanzapinbehandlede skizofrenipatienter: en dobbeltblind placebokontrolleret undersøgelse. Psychopharmacology 192, 441-448. doi: 10.1007/s00213-007-0731-1
PubMed Abstract | CrossRef Full Text | Google Scholar
Roerig, J. L., Mitchell, J. E., de Zwaan, M., Crosby, R. D., Gosnell, B. A., Steffen, K. J., et al. (2005). En sammenligning af virkningerne af olanzapin og risperidon versus placebo på spiseadfærd. J. Clin. Psychopharmacol. 25, 413-418. doi: 10.1097/01.jcp.0000177549.36585.29
PubMed Abstract | CrossRef Full Text | Google Scholar
Sentissi, O., Epelbaum, J., Olie, J. P., Poirier, M. F. (2008). Leptin- og ghrelin-niveauer hos patienter med skizofreni under forskellige antipsykotikabehandlinger: en gennemgang. Schizophr. Bull. 34, 1189-1199. doi: 10.1093/schbul/sbm141
PubMed Abstract | CrossRef Full Text | Google Scholar
Stip, E., Lungu, O. V., Anselmo, K., Letourneau, G., Mendrek, A., Stip, B., et al. (2012). Neurale ændringer i forbindelse med behandling af appetitinformation hos skizofrene patienter efter 16 ugers behandling med olanzapin. Transl. Psychiatry 2, e128. doi: 10.1038/tp.2012.53
PubMed Abstract | CrossRef Full Text | Google Scholar
Sweeney, P., Li, C., Yang, Y. (2017). Appetitundertrykkende rolle af mediale septale glutamatergiske neuroner. Proc. Natl. Acad. Sci. 114, 13816-13821. doi: 10.1073/pnas.1707228114
CrossRef Full Text | Google Scholar
Tan, L., Liu, J., Liu, X., Chen, J., Yan, Z., Yang, H., et al. (2009). Klinisk forskning af Olanzapin til forebyggelse af kemoterapi-induceret kvalme og opkastning. J. Exp. Clin. Cancer Res. 28, 131. doi: 10.1186/1756-9966-28-131
PubMed Abstract | CrossRef Full Text | Google Scholar
Wu, R.-R., Zhao, J.-P., Jin, H., Shao, P., Fang, M.-S., Guo, X.-F., et al. (2008). Livsstilsintervention og metformin til behandling af antipsykotisk induceret vægtøgning: et randomiseret kontrolleret forsøg. Jama 299, 185-193. doi: 10.1001/jama.2007.56-b
PubMed Abstract | CrossRef Full Text | Google Scholar
Wu, R., Zhang, F., Gao, K., Ou, J., Shao, P., Jin, H., et al. (2016). Metforminbehandling af antipsykotika-induceret dyslipidæmi: en analyse af to randomiserede, placebokontrollerede forsøg. Mol. Psychiatry 21, 1537. doi: 10.1038/mp.2015.221
PubMed Abstract | CrossRef Full Text | Google Scholar




