Kemi
Dannelsen af en opløsning er et eksempel på en spontan proces, en proces, der opstår under bestemte betingelser uden brug af energi fra en ekstern kilde. Nogle gange omrører vi en blanding for at fremskynde opløsningsprocessen, men det er ikke nødvendigt; en homogen opløsning ville blive dannet, hvis vi ventede længe nok. Emnet spontanitet er af afgørende betydning for studiet af kemisk termodynamik og behandles mere indgående i et senere kapitel i denne tekst. I forbindelse med diskussionen i dette kapitel er det tilstrækkeligt at se på to kriterier, der begunstiger, men ikke garanterer, den spontane dannelse af en opløsning:
- et fald i systemets indre energi (en exotermisk ændring, som omtalt i det foregående kapitel om termokemi)
- en stigning i systemets uorden (hvilket indikerer en stigning i systemets entropi, som du vil lære om i det senere kapitel om termodynamik)
I opløsningsprocessen sker der ofte, men ikke altid, en ændring i den indre energi, da der absorberes eller udvikles varme. Der opstår altid en stigning i uorden, når der dannes en opløsning.
Når styrkerne af de intermolekylære tiltrækningskræfter mellem opløste og opløsningsmiddelarter i en opløsning ikke er forskellige fra dem, der findes i de adskilte komponenter, dannes opløsningen uden nogen ledsagende energiforandring. En sådan opløsning kaldes en ideel opløsning. En blanding af ideelle gasser (eller gasser som helium og argon, der nærmer sig ideal opførsel) er et eksempel på en ideel opløsning, da de enheder, som disse gasser består af, ikke oplever nogen væsentlige intermolekylære tiltrækningskræfter.
Når beholdere med helium og argon forbindes, blandes gasserne spontant på grund af diffusion og danner en opløsning (figur 2). Dannelsen af denne opløsning indebærer tydeligvis en stigning i uorden, da helium- og argonatomerne optager et volumen, der er dobbelt så stort som det volumen, de hver især optog før blandingen.
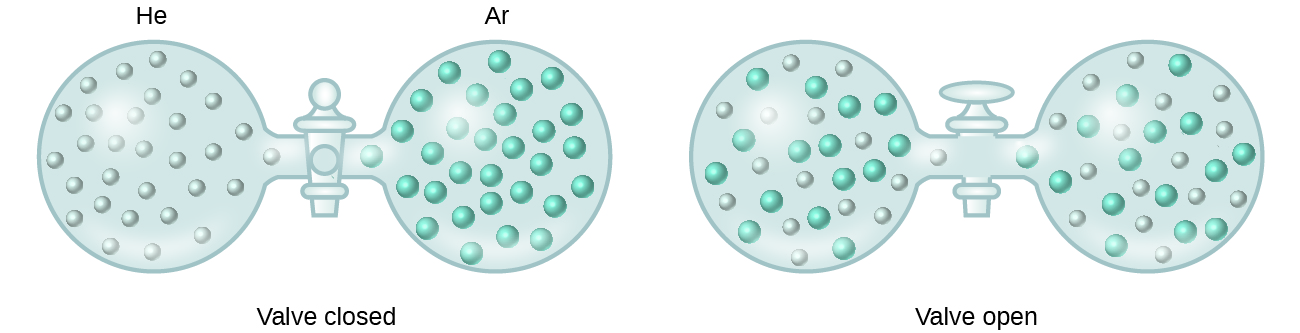
Ideale opløsninger kan også dannes, når strukturelt ens væsker blandes. For eksempel danner blandinger af alkoholerne methanol (CH3OH) og ethanol (C2H5OH) ideelle opløsninger, ligesom blandinger af carbonhydraterne pentan, C5H12, og hexan, C6H14, danner ideelle opløsninger. Hvis methanol og ethanol eller pentan og hexan anbringes i de i figur 2 viste pærer, vil der ske den samme diffusion og efterfølgende blanding af disse væsker som for He- og Ar-gasserne (dog med en meget langsommere hastighed), hvilket giver løsninger uden nogen væsentlig ændring i energi. I modsætning til en blanding af gasser oplever komponenterne i disse væske-væske-løsninger imidlertid rent faktisk intermolekylære tiltrækningskræfter. Men da molekylerne i de to stoffer, der blandes, strukturelt set er meget ens, er de intermolekylære tiltrækningskræfter mellem ens og uens molekyler stort set de samme, og opløsningsprocessen medfører derfor ikke nogen mærkbar energiforøgelse eller -nedgang. Disse eksempler illustrerer, hvordan diffusion alene kan være den drivkraft, der er nødvendig for at forårsage den spontane dannelse af en opløsning. I nogle tilfælde kan de relative størrelser af de intermolekylære tiltrækningskræfter mellem opløste og opløsningsmiddelarter imidlertid forhindre opløsning.
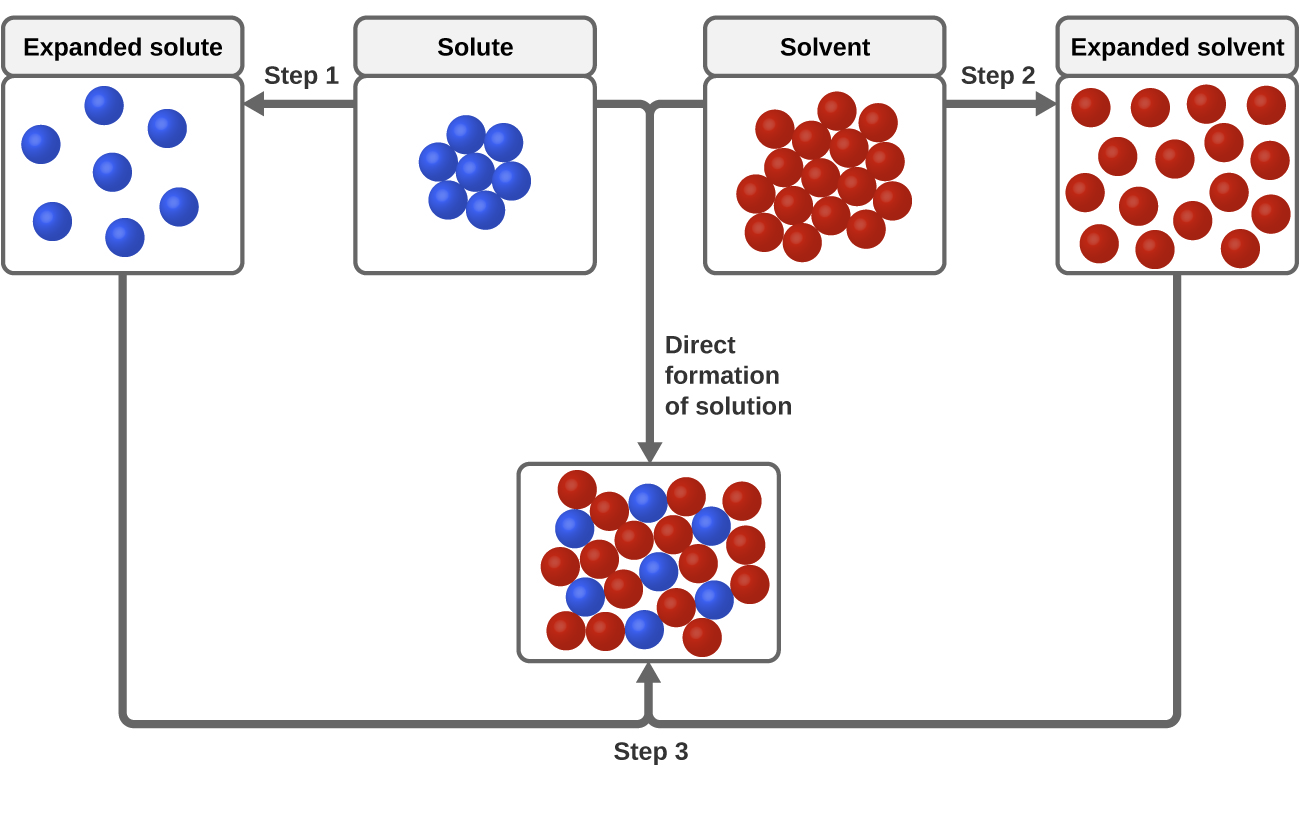
Tre typer af intermolekylære tiltrækningskræfter er relevante for opløsningsprocessen: opløst-opløst, opløsningsmiddel-opløsningsmiddel og opløst-opløsningsmiddel. Som illustreret i figur 3 kan dannelsen af en opløsning ses som en trinvis proces, hvor der forbruges energi til at overvinde tiltrækninger mellem opløst-opløst og opløsningsmiddel-opløsningsmiddel (endoterme processer) og frigives, når der etableres tiltrækninger mellem opløst-opløsningsmiddel (en exoterm proces, der kaldes solvering). De relative størrelser af de energiforandringer, der er forbundet med disse trinvise processer, bestemmer, om opløsningsprocessen som helhed vil frigøre eller optage energi. I nogle tilfælde dannes der ikke opløsninger, fordi den energi, der kræves for at adskille opløser- og opløsningsmiddelarter, er så meget større end den energi, der frigives ved solvitation.
For eksempel vil madolier og vand ikke blandes i nævneværdigt omfang for at give opløsninger (figur 4). Hydrogenbinding er den dominerende intermolekylære tiltrækningskraft i flydende vand; de upolære kulbrintemolekyler i madolier er ikke i stand til hydrogenbinding, men holdes i stedet sammen af dispersionskræfter. Hvis der skal dannes en olie-vand-opløsning, skal man overvinde den meget stærke hydrogenbinding i vand samt de betydeligt stærke dispersionskræfter mellem de relativt store oliemolekyler. Og da de polære vandmolekyler og de upolære oliemolekyler ikke ville opleve en meget stærk intermolekylær tiltrækning, ville meget lidt energi blive frigjort ved solvitation.

På den anden side vil en blanding af ethanol og vand blandes i alle proportioner for at give en opløsning. I dette tilfælde er begge stoffer i stand til at skabe hydrogenbindinger, og derfor er opløsningsprocessen tilstrækkeligt exotermisk til at kompensere for de endoterme adskillelser af opløste og opløsningsmiddelmolekyler.
Som nævnt i begyndelsen af dette modul er spontan opløsningsdannelse begunstiget, men ikke garanteret, af exoterme opløsningsprocesser. Mens mange opløselige forbindelser faktisk opløses med frigivelse af varme, opløses nogle endotermisk. Ammoniumnitrat (NH4NO3) er et sådant eksempel og bruges til at fremstille øjeblikkelige kuldepakker til behandling af skader som den, der er vist i figur 5. En tyndvægget plastikpose med vand er forseglet inde i en større pose med fast NH4NO3. Når den mindre pose brydes, dannes der en opløsning af NH4NO3, som absorberer varme fra omgivelserne (det skadede område, som pakken påføres) og giver et koldt kompres, der mindsker hævelsen. Endoterme opløsninger som denne kræver et større energiinput for at adskille de opløste arter, end der genvindes, når de opløste stoffer solveres, men de er ikke desto mindre spontane på grund af den stigning i uorden, der følger med dannelsen af opløsningen.


Se denne korte video, der illustrerer endoterme og exoterme opløsningsprocesser.
Nøglebegreber og resumé
En opløsning dannes, når to eller flere stoffer kombineres fysisk for at give en blanding, der er homogen på molekylært niveau. Opløsningsmidlet er den mest koncentrerede komponent og bestemmer opløsningens fysiske tilstand. De opløste stoffer er de andre komponenter, der typisk er til stede i koncentrationer, der er lavere end opløsningsmidlets. Opløsninger kan dannes endotermisk eller exotermisk, afhængigt af de relative størrelser af de intermolekylære tiltrækningskræfter mellem opløsningsstofferne og opløsningsmidlerne. Ideelle opløsninger dannes uden nogen nævneværdig energiforandring.
Kemi Opgaver i slutningen af kapitlet
- Hvordan adskiller opløsninger sig fra forbindelser? Fra andre blandinger?
- Hvilke af de vigtigste egenskaber ved opløsninger kan vi se i de opløsninger af K2Cr2O7, der er vist i figur 1?
- Når KNO3 opløses i vand, er den resulterende opløsning betydeligt koldere, end vandet oprindeligt var.
(a) Er opløsningen af KNO3 en endotermisk eller en exotermisk proces?
(b) Hvilke konklusioner kan du drage om de intermolekylære tiltrækninger, der er involveret i processen?
(c) Er den resulterende opløsning en ideel opløsning?
- Giv et eksempel på hver af følgende typer af opløsninger:
(a) en gas i en væske
(b) en gas i en gas
(c) et fast stof i et fast stof
- Oplys de vigtigste typer af intermolekylære tiltrækninger i hver af følgende opløsninger:
(a) Opløsningen i figur 1.
(b) NO(l) i CO(l)
(c) Cl2(g) i Br2(l)
(d) HCl(aq) i benzen C6H6(l)
(e) Methanol CH3OH(l) i H2O(l)
(e) Methanol CH3OH(l) i H2O(l)
- Forudsig, om hvert af følgende stoffer vil være mere opløseligt i vand (polært opløsningsmiddel) eller i et kulbrinte som f.eks. heptan (C7H16, upolært opløsningsmiddel):
(a) vegetabilsk olie (upolært)
(b) isopropylalkohol (polært)
(c) kaliumbromid (ionisk)
- Varme frigives, når nogle opløsninger dannes; varme absorberes, når andre opløsninger dannes. Giv en molekylær forklaring på forskellen mellem disse to typer spontane processer.
- Ved udsættelse af Pd-metal for H2-gas kan der dannes opløsninger af hydrogen i palladium. Koncentrationen af hydrogen i palladiumet afhænger af det anvendte tryk af H2-gas, men på en mere kompleks måde end den, der kan beskrives med Henrys lov. Under visse betingelser opløses 0,94 g hydrogengas i 215 g palladiummetal.
(a) Bestem molariteten af denne opløsning (opløsningens massefylde = 1,8 g/cm3).
(b) Bestem molaliteten af denne opløsning (opløsningens massefylde = 1,8 g/cm3).
(c) Bestem vægtprocenten af hydrogenatomer i denne opløsning (opløsningens massefylde = 1,8 g/cm3).




