Natriumchlorid, NaCl
Natriumchloridmolekylet er det klassiske tilfælde af ionisk binding, idet det dannes ved ionisering af natrium- og kloratomer og tiltrækning af de resulterende ioner.
Et natriumatom har en 3s elektron uden for en lukket skal, og det kræver kun 5,14 elektronvolt energi at fjerne denne elektron. Kloren mangler en elektron til at fylde en skal, og frigiver 3,62 eV, når den får denne elektron (dens elektronaffinitet er 3,62 eV) Det betyder, at det kun kræver 1,52 eV energi at donere en af natriumelektronerne til kloren, når de er langt fra hinanden. Når de resulterende ioner bringes tættere på hinanden, bliver deres elektriske potentielle energi mere og mere negativ og når op på -1,52 eV ved en afstand på ca. 0,94 nm. Det betyder, at hvis neutrale natrium- og kloratomer befandt sig tættere på hinanden end 0,94 nm, ville det være energimæssigt gunstigt at overføre en elektron fra Na til Cl og danne ionbindingen.
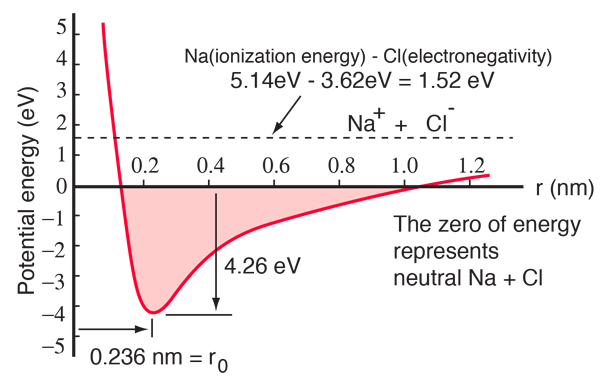
Potentialeenergikurven viser, at der er et minimum ved 0,236 nm adskillelse og derefter en stejl stigning i potentialet, som repræsenterer en frastødende kraft. Denne frastødende kraft er mere end blot en elektrostatisk frastødning mellem elektronskyerne fra de to atomer. Den har en kvantemekanisk karakter, der er rodfæstet i Pauli-eksklusionsprincippet, og kaldes ofte blot “eksklusionsprincippets repulsion”. Når ionerne er langt fra hinanden, overlapper bølgefunktionerne for deres kerneelektroner ikke væsentligt, og de kan have identiske kvantetal. Når de kommer tættere på hinanden, medfører det stigende overlap af bølgefunktionerne, at nogle af dem tvinges ind i højere energitilstande. Ingen to elektroner kan indtage den samme tilstand, så efterhånden som der dannes et nyt sæt energitilstande for det sammensatte system med to kerner, fyldes de lavere energitilstande op, og nogle af elektronerne presses ind i højere tilstande. Dette kræver energi og opleves som en frastødning, der forhindrer ionerne i at komme tættere på hinanden.
Potentiale-diagrammet ovenfor er for gasformigt NaCl, og miljøet er anderledes i den normale faste tilstand, hvor natriumklorid (almindeligt bordsalt) danner kubiske krystaller. Ionadskillelsen er 0,28 nm, hvilket er noget større end i den gasformige tilstand.
En vigtig del af studiet af molekylestruktur er beskrivelsen af de kemiske bindinger, der dannes mellem atomerne. De klassiske studier er de ekstreme ionbindinger i natriumklorid og kovalente bindinger i brintmolekylet.
| Kemiske bindinger | Pauli-repulsion i ionbindinger |
Bindelingsenergi eksempel




