1.10: ATP
ATP Struktur und Funktion
Das Herzstück von ATP ist das Nukleotid Adenosinmonophosphat (AMP). Wie die anderen Nukleotide besteht AMP aus einer stickstoffhaltigen Base (einem Adeninmolekül), die an ein Ribosemolekül gebunden ist, und einer einzigen Phosphatgruppe. Das Anfügen einer zweiten Phosphatgruppe an dieses Kernmolekül führt zur Bildung von Adenosindiphosphat (ADP); das Anfügen einer dritten Phosphatgruppe bildet Adenosintriphosphat (ATP).
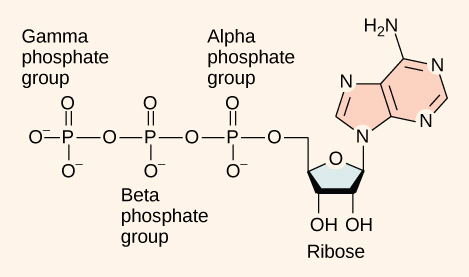
ATP (Adenosintriphosphat) hat drei Phosphatgruppen, die durch Hydrolyse entfernt werden können, um ADP (Adenosindiphosphat) oder AMP (Adenosinmonophosphat) zu bilden. Wenn überhaupt keine Phosphate vorhanden sind, wird das Molekül als „Nukleosid“ und nicht als „Nukleotid“ bezeichnet.
Die Phosphorylierung oder Kondensation von Phosphatgruppen an AMP ist ein endergonischer Prozess. Im Gegensatz dazu ist die Hydrolyse (Abspaltung durch Wasser) von einer oder zwei Phosphatgruppen von ATP, ein Prozess, der als Dephosphorylierung bezeichnet wird, exergonisch. Und warum? Wir erinnern uns daran, dass sich die Begriffe endergonisch und exergonisch auf das Vorzeichen der Differenz der freien Energie einer Reaktion zwischen den Produkten und den Reaktanten, ΔG, beziehen. In diesem Fall weisen wir der Reaktion ausdrücklich eine Richtung zu, entweder in Richtung der Phosphorylierung oder der Dephosphorylierung des Nukleotids. Bei dieser Phosphorylierungsreaktion sind die Reaktanten das Nukleotid und ein anorganisches Phosphat, während die Produkte ein phosphoryliertes Nukleotid und Wasser sind. Bei der Dephosphorylierungs-/Hydrolysereaktion sind die Reaktanten das phosphorylierte Nukleotid und Wasser, während die Produkte anorganisches Phosphat und das Nukleotid minus ein Phosphat sind.
Die freie Energie nach Gibbs ist eine „Zustandsfunktion“, es spielt keine Rolle, wie die Reaktion abläuft, man betrachtet nur den Anfangs- und Endzustand. Die Reaktanten ATP und Wasser sind durch ihren atomaren Aufbau und die Art der Bindungen zwischen den einzelnen Atomen charakterisiert, und jeder dieser Bindungen und ihren möglichen Konfigurationen kann eine bestimmte freie Energie zugeordnet werden – das gilt auch für die Produkte. Bei der Hydrolyse von ATP werden die Bindungen aufgebrochen und in einer neuen Anordnung wiederhergestellt. Wenn wir die Reaktion vom Standpunkt der Produkte und Reaktanten aus betrachten und fragen: „Wie können wir die Atome und Bindungen in den Reaktanten rekombinieren, um die Produkte zu erhalten?“, so stellt man fest, dass eine Phosphoanhydridbindung zwischen einem Sauerstoff und einem Phosphor im ATP gebrochen werden muss, eine Bindung zwischen einem Sauerstoff und einem Wasserstoff im Wasser gebrochen wird, eine Bindung zwischen dem OH (das aus der Wasserspaltung stammt) und dem Phosphor (aus dem freigesetzten PO3-2) gebildet wird und eine Bindung zwischen dem H (das aus der Wasserspaltung stammt) und dem terminalen Sauerstoff am phosphorylierten Nukleotid gebildet werden muss. Die Summe der Energieänderungen, die mit all diesen Bindungsumlagerungen verbunden sind (einschließlich derjenigen, die direkt mit Wasser verbunden sind), macht diese Reaktion exergonisch. Eine ähnliche Analyse könnte mit der umgekehrten Reaktion durchgeführt werden.
Mögliche Übung
Ziehen Sie die obige Abbildung von ATP und Ihr Wissen darüber, wie ein Wassermolekül aussieht, heran, um eine Abbildung der oben beschriebenen Reaktionsschritte zu zeichnen: Aufbrechen der Phosphoanhydrid-Bindung, Aufbrechen von Wasser und Bildung neuer Bindungen zur Bildung von ADP und anorganischem Phosphat. Markieren Sie die Atome in verschiedenen Farben, wenn das hilft.
Ein weiterer Gedanke-
Die oben dargestellte Beschreibung der Bindungsumlagerungen erklärt nicht, warum die Trennung der Addition einer dritten Phosphatgruppe an ADP zur Herstellung von ATP (unter Standardbedingungen) endergonisch ist. Können Sie anhand der Vorher-Nachher-Strukturen erklären, warum die Hinzufügung eines Phosphats Arbeit erfordert (mit positivem ∆G), die Abspaltung eines Phosphats aber ein negatives ∆G darstellt?




