CHEM 101 – Elektrolyte
ALLGEMEINE CHEMIE-THEMEN
Elektrolyte
Dissoziation ionischer Verbindungen in Wasser führt zur Bildung beweglicher wässriger ionischer Spezies.Chemische Gleichungen zur Auflösung und Dissoziation in Wasser. Starke und schwache Elektrolyte.
Elektrolyte (musikalische Begleitung zu diesem Thema) sind Stoffe, die in wässriger Lösung ionische Spezies bilden. Das Vorhandensein von Ladungsträgern in Lösung kann mit einem einfachen Experiment nachgewiesen werden. Die Leitfähigkeit wässriger Medien kann mit Hilfe eines Elektrodenpaares beobachtet werden, das an eine Spannungsquelle angeschlossen ist und in die Lösung getaucht wird. Der Strom, den die Lösung leitet, kann dann leicht gemessen werden, und eine Glühbirne kann als visueller Indikator für die Leitfähigkeit einer Lösung verwendet werden.
Wenn dieses Experiment mit reinem Wasser durchgeführt wird, leuchtet die Glühbirne überhaupt nicht. Wasser selbst leitet Elektrizität nicht leicht; es ist ein Beispiel für einen molekularen Stoff, der ein Nichtelektrolyt ist. Dies gilt auch für viele andere molekulare Stoffe. So ist beispielsweise Haushaltszucker (Saccharose, C12H22O11) recht gut in Wasser löslich, aber eine Zuckerlösung leitet den Strom offenbar nicht besser als Wasser allein. Führen wir dagegen das Experiment mit einer frei löslichen ionischen Verbindung wie Natriumchlorid durch, leuchtet die Glühbirne hell.
Lassen Sie uns darstellen, was unserer Meinung nach bei diesen gegensätzlichen Fällen der Auflösung einer molekularen und einer ionischen Verbindung vor sich geht, indem wir die folgenden chemischen Gleichungen schreiben:
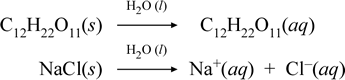
Die erste Gleichung oben stellt die Auflösung eines Nichtelektrolyten, der molekularen Verbindung Saccharose, dar. Die zweite Gleichung stellt die Auflösung einer ionischen Verbindung, Natriumchlorid, dar.Der entscheidende Unterschied zwischen den beiden chemischen Gleichungen ist in diesem Fall die Bildung von wässrigen ionischen Spezies als Produkte. Die Ionen können in einem homogenen Gemisch frei diffundieren, und wenn eine Spannung angelegt wird, bewegen sich die Ionen entsprechend der Energiedifferenz des elektrischen Potenzials zwischen den Elektroden, wodurch elektrischer Strom fließt. Beachten Sie, dass Wasser nicht auf der Reaktionsseite dieser Gleichungen steht, sondern oberhalb des Pfeils, was darauf hinweist, dass Wasser die Umgebung bestimmt, in der der Auflösungsprozess stattfindet. Der überstöchiometrische Status von Wasser in dieser Symbolik kann als ein Auflösungsprozess verstanden werden, der mit Wasser als Lösungsmittel abläuft. Wir werden Wasser nicht als Reaktant bei der Bildung einer wässrigen Lösung durch einen einfachen Auflösungsprozess schreiben. Es gibt viele Fälle, in denen eine Substanz mit Wasser reagiert, wenn sie sich mit Wasser vermischt und darin auflöst. Diese Reaktion eines gelösten Stoffes in wässriger Lösung führt zu chemisch unterschiedlichen Produkten. In solchen Fällen kann Wasser in der chemischen Gleichung explizit als reagierende Spezies ausgewiesen werden.
Starke und schwache Elektrolyte
Wenn sich eine lösliche ionische Verbindung wie Natriumchlorid in Wasser auflöst und eine wässrige Lösung aus solvatisierten Ionen bildet, ist der in der chemischen Gleichung verwendete Pfeil nach rechts insofern gerechtfertigt, als (solange die Löslichkeitsgrenze nicht erreicht ist) das feste Natriumchlorid, das dem Lösungsmittel Wasser zugesetzt wird, vollständig dissoziiert. Mit anderen Worten, es findet tatsächlich eine 100%ige Umwandlung von NaCl(s) in Na+(aq) und Cl-(aq) statt. In unserem Leitfähigkeitsexperiment ist eine Natriumchloridlösung aufgrund der vielen Ionen sehr leitfähig, und die Glühbirne leuchtet hell. In einem solchen Fall sagen wir, dass Natriumchlorid ein starker Elektrolyt ist.
Betrachten wir im Gegensatz dazu die molekulare Substanz Essigsäure, HC2H3O2.Wenn Essigsäure in Wasser gelöst wird, bildet sie eine undissoziierte, solvatisierte, molekulare Spezies, symbolisiert als HC2H3O2(aq), ähnlich wie der Fall mit Saccharose oben. Wenn wir jedoch unseren Leitfähigkeitstest mit einer Essigsäurelösung durchführen, stellen wir fest, dass die Glühbirne leuchtet, wenn auch eher schwach im Vergleich zu der Helligkeit, die bei der Natriumchloridlösung beobachtet wurde. In diesem Fall muss zumindest eine teilweise Bildung von Ionen aus Essigsäure in Wasser stattfinden. Eine chemische Gleichung, die diesen Prozess darstellt, muss die Bildung von Ionen zeigen. Ein vernünftiger Vorschlag für eine solche Gleichung wäre:
![]()
Zwei Dinge sind hier wichtig zu beachten. Erstens handelt es sich um einen Fall, in dem wir Wasser als Reaktionspartner einbeziehen. Die beiden molekularen Substanzen, Wasser und Essigsäure, reagieren und bilden die mehratomigen Ionen Hydronium und Acetat. Die Gleichung, die dies darstellt, ist eine Ionengleichung. Das zweite diskussionswürdige Merkmal ist der Ersatz des Pfeils nach rechts durch das Symbol der doppelten Pfeile mit einem Balken, das ein chemisches Gleichgewicht anzeigt. In diesem Fall ist die Gleichgewichtsbedingung für die Reaktion zugunsten der Reaktanten, d. h. in einer wässrigen Essigsäurelösung verbleibt der größte Teil der Essigsäure als Essigsäuremoleküle, und nur ein kleiner Teil hat zu jedem Zeitpunkt H+ an Wasser abgegeben, um die Ionen zu bilden. Die geringe Anzahl der gebildeten Ionen erklärt, warum die Essigsäurelösung den Strom nicht so gut leitet wie die Natriumchloridlösung, was dazu führt, dass die Glühbirne unseres Leitfähigkeitsdetektors nur schwach leuchtet. Wir unterscheiden also zwischen starken Elektrolyten, wie Natriumchlorid, und Essigsäure, die ein Beispiel für einen schwachen Elektrolyten ist.
Wie der Name Essigsäure schon sagt, ist auch diese Substanz eine Säure und ein schwacher Elektrolyt. Dementsprechend stufen wir Essigsäure als schwache Säure ein. Unsere erste (und am wenigsten allgemeine) Definition einer Säure ist eine Substanz, die in Wasser Hydronium-Ionen erzeugt, was genau das ist, was unsere obige Ionengleichung zeigt, wenn man bedenkt, dass eine schwache Säure relativ geringe Mengen an Hydronium-Ionen erzeugt.
Chemiker lieben Abkürzungen, und eine wichtige Abkürzung für das Hydronium-Ion ist H+(aq), und diese wird häufig verwendet. Dies wird in der verkürzten Version der obigen Gleichung gezeigt, die unten abgebildet ist. Zur Verdeutlichung: H+ selbst wäre nur ein isoliertes Proton (für 1H); daher ist es auch wichtig zu wissen, dass eine solche Spezies in wässriger Lösung nicht existiert.
Außerdem sind die Pfeile ungleich lang, um das reaktionsbegünstigte Gleichgewicht anzuzeigen, in dem es viel weniger Ionen als Essigsäuremoleküle gibt.
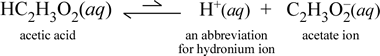
Durch die Darstellung von Hydronium als H+(aq) ist die Ionengleichung für Essigsäure in Wasser formal ausgeglichen, ohne ein Wassermolekül als Reaktanten einzubeziehen, was in der obigen Gleichung implizit ist.
Ammoniak: Ein Beispiel für einen schwachen Elektrolyten, der eine schwache Base ist
Essigsäure ist, wie wir gerade gesehen haben, eine molekulare Verbindung, die eine schwache Säure und ein Elektrolyt ist. Ammoniak, NH3, eine weitere einfache molekulare Verbindung, reagiert ebenfalls in geringem Maße mit Wasser und bildet Ammonium- und Hydroxidionen. Unsere erste, am wenigsten allgemeine Definition einer Base ist eine Substanz, die in Wasser Hydroxid-Ionen bildet. Ammoniak ist also eine schwache Base und leitet, wie Essigsäure, den Strom nicht annähernd so gut wie wässriges Salz. Ammoniak ist also auch ein schwacher Elektrolyt.
![]()
Die Symbolik unserer chemischen Gleichung deutet wiederum auf ein reaktionsbegünstigtes Gleichgewicht für den schwachen Elektrolyten hin.
Erweiterungen und Verbindungen
Ein eher quantitativer Ansatz für Gleichgewichte verwendet schwache Säuren und schwache Basen als wichtige Beispiele.




