CHEM 245 – Enzymhemmung
BIOCHEMISTRISCHE THEMEN
Enzymhemmung
Arten von Hemmstoffen und Hemmung.Reversible und irreversible Hemmstoffe und Hemmung. Modelle für und kinetische Effekte von kompetitiver und nichtkompetitiver Hemmung. Gemischte Hemmung.Beispiele für Enzyminhibition.
Die Spezifität von Enzymen ist nicht streng auf Substrate beschränkt. Oft wird die Aktivität eines Enzyms durch spezifische Wechselwirkungen mit Molekülen, die als Inhibitoren bezeichnet werden, reduziert. Die Hemmung von Enzymen ist eines der wichtigsten Phänomene der Biochemie. So entfalten beispielsweise viele Medikamente, Antibiotika und Toxine ihre Wirkung durch ihre Fähigkeit, ein Enzym zu hemmen. Inhibitoren, die dem Substrat strukturell ähnlich sind, sind häufig kompetitive Inhibitoren, da sie um die Bindung an das aktive Zentrum konkurrieren. Die Hemmung eines Enzyms kann reversibel sein (wie es in der Regel der Fall ist, wenn ein Inhibitor über nichtkovalente Wechselwirkungen an das Enzym bindet) oder irreversibel (wie es in zahlreichen Fällen vorkommt, in denen Inhibitoren über kovalente Modifikationen des Enzyms wirken, die vielleicht auf einen kritischen Rest für die Katalyse abzielen).
Wir können uns mehrere einfache Modelle für die reversible Hemmung vorstellen. Das einfachste ist die direkte Blockade des aktiven Zentrums durch den Inhibitor. Dies würde im Falle eines Moleküls mit einer gewissen strukturellen Ähnlichkeit zum Substrat gesehen werden. Die Bindung von Substrat und Inhibitor schließen sich in diesem Modell der kompetitiven Hemmung gegenseitig aus.
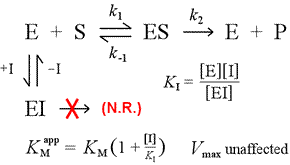
Rechts ist ein einfaches mechanistisches Modell für kompetitive Hemmung dargestellt. Der Inhibitor I bindet nur an das freie Enzym E mit einer Dissoziationskonstante KI und blockiert die Bindung des Substrats (S). Indem ein Teil des Enzyms im inaktiven EI-Komplex gebunden wird, steht bei einer gegebenen Substratkonzentration weniger Enzym zur Verfügung, um sich mit dem Substrat zu verbinden und ES zu bilden und dann möglicherweise in Produkte umzuwandeln. Es wird ein Anstieg der zum Erreichen von ½Vmax erforderlichen Zeit beobachtet, wodurch sich der scheinbare Wert von KM erhöht.
Durch den Anstieg auf immer höhere Konzentrationen kann das Substrat den Inhibitor überwältigen und ihn für das freie Enzym so weit verdrängen, dass die wahre Vmax noch erreicht werden kann.
Wir können uns leicht vorstellen, dass ein Molekül, das dem Substrat in bestimmten strukturellen Schlüsselmerkmalen ähnelt, mit dem Substrat um die Bindung am aktiven Zentrum konkurrieren könnte. Dies wird als Substratanalogon bezeichnet, und sie sind häufige Beispiele für kompetitive Hemmstoffe von Enzymen. Wenn die Art und Weise, wie Enzyme die Reaktionsgeschwindigkeit erhöhen, darin besteht, dass sie selektiv den Übergangszustand der Reaktion stabilisieren, dann sollte ein solches Übergangszustandsanalogon ein sehr guter kompetitiver Inhibitor sein, wenn wir ein Molekül finden können, das dem Übergangszustand (in Struktur und Polarität oder Ladung) ähnelt.
Wir werden das Modell der kompetitiven Hemmung der nicht-kompetitiven Hemmung gegenüberstellen, bei der der Hemmstoff nur an den Enzym-Substrat-Komplex bindet. Man kann sich dies als Ergebnis einer Enzym-Substrat-Wechselwirkung vom Typ induced-fit vorstellen, bei der eine Bindungsstelle für einen Inhibitor ausschließlich in der induzierten Konformation von ES zur Verfügung steht.
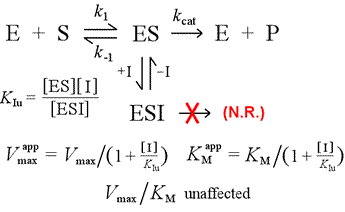
Links: Ein mechanistisches Modell für nichtkompetitive Hemmung. In diesem Modell bindet der Inhibitor nur den ES-Komplex, nicht aber das freie Enzym. Der ternäre Komplex, ESI, bildet keine Produkte. Dies hat zur Folge, dass die scheinbare Vmax sinkt. Die Dissoziationskonstante des Inhibitors für ESI wird als KIu bezeichnet. In einem Effekt, der durch das Prinzip von Le Châtelier erklärt wird, ist die scheinbare KM niedriger, da die Bindung des Inhibitors einen Teil des Produkts (ES) des ES-Bildungs „gleichgewichts“ entfernt.
Ein Modell für die Hemmung, bei dem der Inhibitor sowohl das freie Enzym als auch den Enzym-Substrat-Komplex bindet, ist die gemischte Hemmung. Die Dissoziationskonstante des Inhibitors kann sich zwischen E und ES unterscheiden (d. h. KI ≠ KIu). Der Sonderfall, in dem KI = KIu ist, wird als nichtkompetitive Hemmung bezeichnet. Man beachte, dass in diesem Fall KM nicht beeinflusst wird, während Vmax gesenkt wird.
Typen der reversiblen Enzymhemmung – eine Zusammenfassung
Wir haben gesehen, dass die verschiedenen Modelle der reversiblen Hemmung nach den Auswirkungen auf die kinetischen Parameter unterschieden werden können. Die folgende Tabelle fasst die Arten der Hemmung und ihre Auswirkungen auf diese Parameter zusammen.

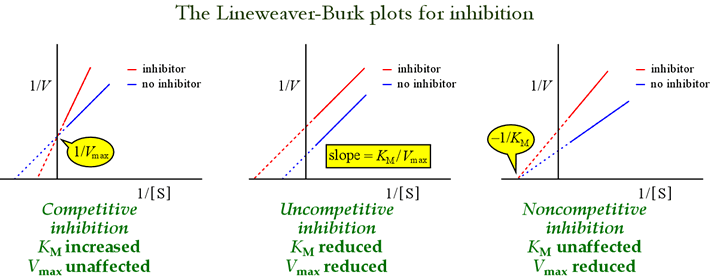
Die Lineweaver-Burk-Diagramme oder doppelt-reziproken Diagramme sind nützlich, um die Muster der Hemmung zu identifizieren. Die folgende Abbildung zeigt, wie sich verschiedene Arten von Hemmungen auf den Plot auswirken.
Beispiele für Enzymhemmung
Das erste und am weitesten verbreitete Medikament, Acetylsalicylat (Salicylat = Orthohydroxybenzoat), allgemein bekannt als Aspirin, ist ein wirksames Analgetikum (Schmerzmittel), Antipyretikum (Fiebersenker) und entzündungshemmendes Mittel. Die medizinischen Eigenschaften der Weidenrinde waren in einigen Kulturen schon seit Jahrhunderten bekannt. Im 19. Jahrhundert stellte man fest, dass der Wirkstoff eine Kombination aus und Salicylalkohol ist. Auf der Grundlage dieser und anderer Beobachtungen sowie von Fortschritten in der chemischen Synthese wurde Aspirin Mitte des Jahrhunderts von Hoffman, einem Chemiker der Firma Bayer, hergestellt. Modernere Untersuchungen haben ergeben, dass die medizinischen Eigenschaften von Aspirin weitgehend auf seiner Fähigkeit beruhen, ein als Cyclooxygenase bekanntes Enzym irreversibel zu hemmen, das für die Synthese von Prostaglandinen und Thromboxanen erforderlich ist.
Cyclooxygenasen katalysieren den ersten Schritt der Umwandlung von Arachidonat in eine Vorstufe von Prostaglandinen und Thromboxanen, Prostaglandin G2 (PGG2, Strukturen und Reaktion). Die Reaktion nutzt zwei Moleküle O2 und wandelt die C20:4-Fettsäure in ein peroxidiertes Molekül um, das einen Cyclopentanring enthält (PGG2 – PG steht für „Prostaglandin“). Das Cyclooxygenase-Enzym besitzt auch eine Hydroperoxidase-Aktivität, die PGG2 in PGH2 umwandelt. Die Bezeichnung „Cyclooxygenase“ (COX) würde daher eher als Prostaglandin-Endoperoxid-H-Synthase (PGHS) zutreffen. Die Hemmung der Cyclooxygenase-Aktivität durch Aspirin ist auf dessen Fähigkeit zurückzuführen, einen Serinrest (Ser530) des Enzyms chemisch zu verändern. Der Serinrest erhält durch Aspirin eine Acetylgruppe, eine irreversible Veränderung. Somit ist Aspirin ein Beispiel für einen irreversiblen Hemmstoff. Eigentlich gibt es zwei COX-Isoenzyme: eine konstitutive Form, COX-1 (PGHS-1), und eine induzierte Form (unter Entzündungsbedingungen), COX-2 (PGHS-2). Nichtsteroidale entzündungshemmende Medikamente (NSAIDs) wie Aspirin, Ibuprofen und Naproxen hemmen im Allgemeinen beide Isoformen. Infolgedessen verursachen diese Medikamente unerwünschte Nebenwirkungen, z. B. Magen-Darm-Reizungen. Ein aktuelles Ziel der pharmakologischen Forschung ist daher die Entwicklung von COX-2-spezifischen Hemmstoffen, von denen man annimmt, dass sie den Großteil der analgetischen und entzündungshemmenden Wirkung von NSAIDs vermitteln.
Verwandte Themenseiten:
- Einführung in die chemische Kinetik
- Einführung in die Enzymologie
- Enzymkinetik
- Michaelis-Menten-Gleichung




