Enzymhemmung
Enzyme sind für die meisten, wenn nicht für alle lebensnotwendigen Prozesse erforderlich. Enzyme katalysieren eine Reaktion, indem sie die für die Reaktion erforderliche Aktivierungsenergie verringern. Enzyme müssen jedoch streng reguliert werden, um sicherzustellen, dass die Menge des Produkts nicht auf ein unerwünschtes Niveau ansteigt. Dies wird durch Enzymhemmung erreicht.
Arten der Hemmung
Reversible und irreversible Hemmstoffe sind Chemikalien, die sich an ein Enzym binden, um dessen Aktivität zu unterdrücken. Eine Methode, dies zu erreichen, besteht darin, sich fast dauerhaft an ein Enzym zu binden. Diese Art von Inhibitoren wird als irreversibel bezeichnet. Andere Chemikalien können jedoch vorübergehend an ein Enzym binden. Diese werden als reversibel bezeichnet. Reversible Inhibitoren binden entweder an eine aktive Stelle (kompetitive Inhibitoren) oder an eine andere Stelle des Enzyms (nicht-kompetitive Inhibitoren).
 Abb. 1 – Diagramm zur Darstellung der Wirkung von kompetitiven und nicht-kompetitiven Enzyminhibitoren.
Abb. 1 – Diagramm zur Darstellung der Wirkung von kompetitiven und nicht-kompetitiven Enzyminhibitoren.Kompetitive Inhibitoren
Kompetitive Inhibitoren konkurrieren mit dem Substrat an der aktiven Stelle und erhöhen daher Km (die Michaelis-Menten-Konstante). Die Vmax bleibt jedoch unverändert, da die Reaktion bei ausreichender Substratkonzentration immer noch abgeschlossen werden kann. Die grafische Darstellung der Enzymaktivität in Abhängigkeit von der Substratkonzentration wäre aufgrund der Erhöhung von Km nach rechts verschoben, während die Lineweaver-Burke-Kurve im Vergleich zu derjenigen ohne Inhibitor steiler wäre.
Nichtkompetitive Inhibitoren
Nichtkompetitive Inhibitoren binden an eine andere Stelle des Enzyms und verringern somit VMAX. Die KM bleibt jedoch unverändert. Dies wird durch ein niedrigeres Maximum in einem Diagramm, in dem die Enzymaktivität gegen die Substratkonzentration aufgetragen wird, und einen höheren y-Achsenabschnitt in einem Lineweaver-Burke-Diagramm im Vergleich zu einem Diagramm ohne Inhibitor deutlich.
| Kompetitiv | Nichtkompetitiv | |
| Wo wirkt es? | Aktiver Standort | Alternativer Standort |
| Veränderung der Km | Erhöhung | Unverändert |
| Änderung von Vmax | Unverändert | Abnahme |
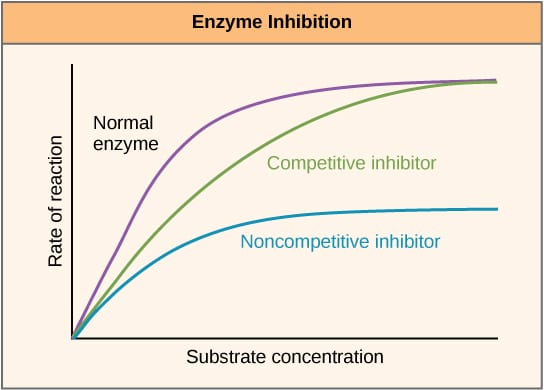 Abb. 2 – Diagramm zur Darstellung der Auswirkung von Enzyminhibitoren auf die Reaktionsgeschwindigkeit und wie diese mit der Substratkonzentration variiert.
Abb. 2 – Diagramm zur Darstellung der Auswirkung von Enzyminhibitoren auf die Reaktionsgeschwindigkeit und wie diese mit der Substratkonzentration variiert.Allosterische Hemmung
Allosterische Enzyme zeigen eine sigmoidale Kurve im Gegensatz zu der hyperbolischen Kurve von Michaelis-Menten-Enzymen. Dies liegt daran, dass die meisten allosterischen Enzyme mehrere Untereinheiten enthalten, die sich gegenseitig beeinflussen können, wenn das Substrat an das Enzym bindet. Eine Hemmung kann sich entweder auf K0,5, d. h. die Substratkonzentration für die Halbsättigung, oder auf Vmax oder auf beides auswirken. Dies führt zu einer Verschiebung der Kurve nach rechts und im Falle einer Verringerung von Vmax zu einer Verschiebung der Kurve nach unten.
Allosterische Enzyme haben zwei Zustände: einen Zustand mit geringer Affinität, der als „T“-Zustand bezeichnet wird, und einen Zustand mit hoher Affinität, den „R“-Zustand. Inhibitoren wirken, indem sie bevorzugt an den T-Zustand eines allosterischen Enzyms binden und das Enzym veranlassen, diesen Zustand niedriger Affinität beizubehalten.
Dies ist äußerst nützlich, um die Menge eines Enzymprodukts zu begrenzen, da das Produkt dann dieselbe Art von Enzym hemmen kann, um sicherzustellen, dass die Produktmenge nicht zu groß ist. Dies wird als Rückkopplungshemmung bezeichnet. So hemmt ATP beispielsweise allosterisch die Pyruvatkinase, um eine vermehrte Bildung von Pyruvat zu verhindern, so dass schließlich weniger ATP gebildet wird. Außerdem wird die Phosphofructokinase durch Citrat, ein Zwischenprodukt des Kreb-Zyklus, allosterisch gehemmt. Das bedeutet, dass die Glykolyse bei hoher ATP-Bildung aus dem Kreb-Zyklus eingeschränkt wird.
 Abb. 3 – Diagramm zur Veranschaulichung des Mechanismus der allosterischen Hemmung und Aktivierung.
Abb. 3 – Diagramm zur Veranschaulichung des Mechanismus der allosterischen Hemmung und Aktivierung.Phosphorylierung
Die Phosphorylierung ist ein weiterer Mechanismus, durch den Enzyme gehemmt werden können. Dies geschieht in der Regel durch die Wirkung von Kinase-Enzymen, die ein Enzym je nach Situation entweder hemmen oder aktivieren können. Die Kinase-Enzyme spalten eine Phosphatgruppe von ATP ab und binden sie an das Enzym. In Situationen, in denen dies zu einer Erhöhung der Enzymaktivität führt, entsteht eine Kaskadenreaktion, die es ermöglicht, aus einem kleinen Reiz eine große Reaktion zu erzeugen.
Zymogene
Enzyme können auch in einem inaktiven Zustand sezerniert werden, der als Zymogen bezeichnet wird. Zymogene sind ein nützlicher Mechanismus, der es ermöglicht, Enzyme sicher an verschiedene Orte zu transportieren, ohne dass das Enzym auf dem Weg dorthin aktiv wird und seine Funktion ausübt. Sie bleiben aufgrund einer Anlagerung von Aminosäuren im Protein inaktiv. Um ein Zymogen zu aktivieren, muss daher ein anderes Enzym diese zusätzlichen Aminosäuren abspalten. Chymotrypsinogen zum Beispiel wird von der Bauchspeicheldrüse synthetisiert, ist aber inaktiviert und kann nicht funktionieren. Auf dem Weg in den Darm spaltet ein anderes Enzym (Trypsin) die zusätzlichen Aminosäuren ab, um die aktivierte Form, das Chymotripsin, herzustellen.
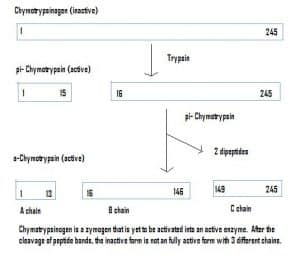 Abb. 4 – Diagramm zur Darstellung der Aktivierung von Chymotrypsinogen im Magen-Darm-System und der in jeder Phase beteiligten Enzyme.
Abb. 4 – Diagramm zur Darstellung der Aktivierung von Chymotrypsinogen im Magen-Darm-System und der in jeder Phase beteiligten Enzyme.Klinische Relevanz – Pharmakokinetik
Die wichtigste klinische Anwendung der Enzyminhibition ist die Verwendung von Arzneimitteln. ACE-Hemmer sind ein gängiges Mittel zur Behandlung von Bluthochdruck. Angiotensin I wird durch die Wirkung des Angiotensin Converting Enzyms (ACE) in Angiotensin II umgewandelt. Angiotensin II verursacht jedoch zahlreiche Wirkungen, die mit einem Anstieg des Blutdrucks verbunden sind. Daher wurden ACE-Hemmer entwickelt, um die Wirkung von ACE kompetitiv zu hemmen, was zu einer geringeren Bildung von Angiotensin II und einem niedrigeren Blutdruck führt.
Alternativ bindet Penicillin irreversibel an das aktive Zentrum eines Enzyms namens DD-Transpeptidase. DD-Transpeptidase ist für den letzten Schritt der bakteriellen Zellwandsynthese verantwortlich. Durch die Hemmung dieses Enzyms können die Bakterien keine Zellwand synthetisieren und daher kein Leben erhalten.
Schließlich ist Cyanid ein Beispiel für einen nicht-kompetitiven Hemmstoff. Cyanid bindet sich an das letzte Enzym in der Elektronentransportkette und hindert dieses Enzym daran, die Reaktion von Sauerstoff zu Wasser zu katalysieren. Dadurch wird der Elektronenfluss in der Elektronentransportkette verhindert und es kann kein ATP erzeugt werden, was zum Tod führt.




