Fakten über Barium
Barium, benannt nach dem griechischen Wort barys für „schwer“, ist ein relativ dichtes und reaktives Erdalkalimetall. Es kommt in der Natur nur in Verbindung mit anderen Elementen vor, und bariumhaltige Verbindungen werden auf vielfältige Weise verwendet; man findet sie in Rattengift, als Beschwerungsmittel in Ölbohrflüssigkeiten und in der weißen Flüssigkeit, die bei einem Röntgendiagnosetest, dem Bariumeinlauf, zur Darstellung der Eingeweide verwendet wird.
Die Fakten
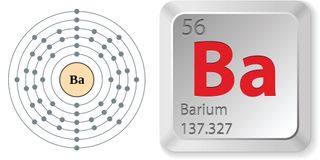
- Atomzahl (Anzahl der Protonen im Kern): 56
- Atomsymbol (im Periodensystem der Elemente): Ba
- Atomgewicht (durchschnittliche Masse des Atoms): 137.327
- Dichte: 2,09 Unzen pro Kubikzoll (3.62 Gramm pro Kubikzentimeter)
- Phase bei Raumtemperatur: fest
- Schmelzpunkt: 1.341 Grad Fahrenheit (727 Grad Celsius)
- Siedepunkt: 3.447 F (1.897 C)
- Anzahl der natürlichen Isotope (Atome des gleichen Elements mit einer unterschiedlichen Anzahl von Neutronen): 7
- Häufigstes Isotop: Ba-138
Entdeckung des Bariums
Vincenzo Casciarolo, ein italienischer Alchemist des 17. Jahrhunderts, entdeckte Barium zum ersten Mal in Form von ungewöhnlichen Kieselsteinen, die jahrelang leuchteten, nachdem sie Hitze ausgesetzt waren, so die Royal Society of Chemistry. Er nannte diese Kieselsteine nach seiner Heimatstadt „Bologna-Steine“, aber später wurde festgestellt, dass es sich um Bariumsulfat (BaSO4) handelte. Im späten 18. Jahrhundert wurden Bariumoxid (BaO) und Bariumcarbonat (BaCO3) von dem deutschen Chemiker Carl Scheele bzw. dem englischen Chemiker William Withering entdeckt.
Reines Bariummetall wurde erst 1808 in der Royal Institution in London isoliert und identifiziert. Der bekannte Chemiker und Erfinder Sir Humphry Davy nutzte die Elektrolyse, um das Barium aus geschmolzenen Bariumsalzen wie Bariumhydroxid (Ba(OH)2) zu trennen. Bei der Elektrolyse wird ein elektrischer Strom durch die ionische Substanz geleitet, um die Ionen voneinander zu trennen. Da die Bariumsalze geschmolzen waren, bewegten sich die Bariumionen leicht zu dem Behälter mit der negativen Elektrode, und die anderen negativen Ionen bewegten sich leicht in die entgegengesetzte Richtung zu dem Behälter mit der positiven Elektrode.
Quellen für Barium
Barium kommt in der Natur wegen seiner hohen Reaktivität nur in Verbindung mit anderen Elementen vor. Barium kommt am häufigsten in Verbindung mit Sulfat und Karbonat vor, kann aber auch Verbindungen mit Hydroxid, Chlorid, Nitrat, Chlorat und anderen negativen Ionen bilden. Etwa 0,05 Prozent der Erdkruste bestehen aus Barium, was es zum 17. häufigsten Element in der Erdkruste macht, wie Robert E. Krebs in seinem Buch „The History and Use of Our Earth’s Chemical Elements: A Reference Guide“ (Greenwood Publishing Group, 2006). Die Bergbaureserven im Vereinigten Königreich, Italien, der Tschechischen Republik, den Vereinigten Staaten und Deutschland enthalten über 400 Millionen Tonnen Barium, so John Emsley in seinem Buch „Nature’s Building Blocks: An A-Z Guide to the Elements“ (Oxford University Press, 1999).
Um reines elementares Barium zu erhalten, muss es von anderen Elementen, die in natürlich vorkommenden Bariumverbindungen vorhanden sind, getrennt werden. Barium kann durch Elektrolyse aus Bariumchlorid extrahiert werden. Barium kann auch durch Reduktion von Bariumoxid mit Aluminium oder Silizium in einem Hochtemperatur-Niederdruck-Vakuum gewonnen werden.
Eigenschaften von Barium
Reines Barium ist ein weiches, silbrig-weißes Metall. Es gehört zu den Erdalkalimetallen und steht zusammen mit Beryllium, Magnesium, Kalzium, Strontium und Radium in Gruppe 2 des Periodensystems. Jedes ihrer Atome enthält zwei Valenzelektronen (äußerste Elektronen). Barium befindet sich in der 5. Periode oder Reihe, d. h. es hält seine Valenzelektronen in der fünften Schale und kann die Elektronen sehr leicht verlieren bzw. oxidiert werden. Dies erklärt die hohe Reaktivität von Barium, insbesondere mit elektronegativen Elementen wie Sauerstoff.
Kommerzielle Verwendung von Barium
Elementares Barium hat nicht viele praktische Verwendungsmöglichkeiten, was wiederum auf seine hohe Reaktivität zurückzuführen ist. Seine starke Anziehungskraft auf Sauerstoff macht es jedoch als „Getter“ nützlich, um die letzten Spuren von Luft in Vakuumröhren zu entfernen. Reines Barium kann auch mit anderen Metallen kombiniert werden, um Legierungen zu bilden, die zur Herstellung von Maschinenelementen wie Lagern oder Zündkerzen in Verbrennungsmotoren verwendet werden. Da Barium seine Elektronen locker halten kann, geben seine Legierungen beim Erhitzen leicht Elektronen ab und verbessern die Effizienz der Zündkerzen, so Krebs.
Bariumhaltige Verbindungen haben eine Vielzahl kommerzieller Anwendungen. Bariumsulfat oder Baryt wird in Lithopon (ein aufhellendes Pigment in Druckerpapier und Farbe), in Ölbohrflüssigkeiten, bei der Glasherstellung und bei der Herstellung von Gummi verwendet. Bariumcarbonat wird als Rattengift verwendet, und Bariumnitrat und Bariumchlorat erzeugen grüne Farben in Feuerwerkskörpern.
Barium im Körper
Der durchschnittliche Erwachsene enthält etwa 22 mg Barium, da es in Lebensmitteln wie Karotten, Zwiebeln, Salat, Bohnen und Getreidekörnern enthalten ist. Der Bariumgehalt in den Zähnen kann Wissenschaftlern sogar dabei helfen, festzustellen, wann Säuglinge vom Stillen auf feste Nahrung umsteigen. Diese geringen Bariumkonzentrationen haben keine biologische Bedeutung und sind nicht schädlich.
Große Mengen an löslichen Bariumsalzen können jedoch giftig und sogar tödlich sein, wie John Emsley in seinem Buch „The Elements of Murder: A History of Poison“ (Oxford University Press, 2005). Barium kann Erbrechen, Koliken, Durchfall, Zittern und Lähmungen verursachen. Es gab eine Handvoll Morde mit Bariumverbindungen, darunter der Mord an einem Mann in Mansfield, Texas, im Jahr 1994 durch seine 16-jährige Tochter Marie Robards, die Bariumacetat aus ihrem Highschool-Chemielabor gestohlen hatte. Mehrere Patienten wurden auch versehentlich durch Barium getötet, als bei einem gastroenterologischen Diagnosetest, einem so genannten Bariumeinlauf, irrtümlich lösliches Bariumcarbonat statt unlöslichem Bariumsulfat verwendet wurde.
Ärzte führen Bariumeinläufe durch, um Anomalien des Dickdarms und des Rektums sichtbar zu machen und zu diagnostizieren, so die Johns Hopkins Medicine. Während des Eingriffs wird Bariumsulfat über das Rektum eingeflößt, um die Innenwände des Dickdarms zu beschichten. Anschließend wird normalerweise Luft verabreicht, um sicherzustellen, dass die Bariumbeschichtung alle Oberflächenanomalien ausfüllt. Anschließend wird mit Röntgenstrahlen ein Bild des unteren GI-Trakts erstellt. Bariumsulfat absorbiert Röntgenstrahlen und erscheint auf dem Röntgenfilm weiß, während die Luft und das umgebende Gewebe schwarz erscheinen. Die Analyse des Röntgenbildes des Bariumeinlaufs ermöglicht es den Ärzten, Erkrankungen wie Colitis ulcerosa, Morbus Crohn, Polypen, Krebs und das Reizdarmsyndrom zu diagnostizieren.




