Frontiers in Neuroscience
Introduction
Die Generierung neuer Neuronen im erwachsenen Hippocampus, einer Hirnregion, die an der räumlichen Navigation und der Gedächtnisbildung beteiligt ist (Buzsaki und Moser, 2013), ist eine auffällige Form der Plastizität, die bei mehreren Spezies, einschließlich des Menschen, lebenslang anhält (Altman und Das, 1965; Eriksson et al, 1998; Moreno-Jiménez et al., 2019). Unter den vielen Bedingungen, die die Neurogenese im Hippocampus von Erwachsenen regulieren, ist einer der zuverlässigsten Prozesse, der weithin beschrieben wurde, der altersbedingte Rückgang der Neuronenproduktion, während die bereits vorhandenen Neuronenpopulationen bei normaler Alterung konstant bleiben (Kuhn et al., 1996; Kempermann et al., 1998; Burke und Barnes, 2010). Das Altern beeinträchtigt viele Funktionen des Gehirns, darunter die synaptische Übertragung und die Plastizität, die vermutlich zum Gedächtnisverlust beitragen (Burke und Barnes, 2006; Fan et al., 2017). Da der Hippocampus besonders anfällig für altersbedingte Veränderungen und Neurodegeneration ist, ist es wichtig, Strategien zur Verbesserung der Plastizität in dieser Struktur zu finden, um die Auswirkungen der Alterung zu verhindern oder abzumildern (Bartsch und Wulff, 2015). Körperliche Bewegung und kognitive Stimuli verbessern die Gesundheit des Gehirns und neigen dazu, die Auswirkungen des Alterns abzuschwächen. Einer der direkten Vorteile könnte sich aus dem aktivitätsabhängigen Anstieg des vom Gehirn abgeleiteten neurotrophen Faktors (BDNF) ergeben, der nachweislich die synaptische Plastizität wiederherstellt, die Neurogenese fördert und das Lernen bei Mäusen mittleren Alters verbessert (Marlatt et al., 2012; Trinchero et al., 2017). Bewegung reduziert auch die Mikroglia-Aktivierung, erhöht die aktivitätsabhängige synaptische Plastizität, die Proliferation von neuralen Vorläuferzellen und beschleunigt die Entwicklung und Integration von adulten Körnerzellen (GCs) im alternden Hippocampus (van Praag et al., 2005; Kronenberg et al., 2006; O’Callaghan et al., 2009; Marlatt et al., 2012; Gebara et al., 2013). Diese Effekte tragen zur Wiederherstellung der vom Hippocampus abhängigen Plastizität bei und korrelieren mit adaptivem Verhalten. So verbessern gealterte Tiere, die bei Aufgaben des räumlichen Lernens und der Mustertrennung schlecht abschneiden, ihre Leistung nach dem Training (van Praag et al., 2005; Marlatt et al., 2012; Wu et al., 2015; Duzel et al., 2016; Xu et al., 2017).
Das Ausmaß, in dem die Neurogenese zu den positiven Verhaltenseffekten des Trainings bei alternden Tieren beiträgt, wird noch untersucht. Es ist möglich, dass die durch körperliche Betätigung bewirkte Steigerung der Neurogenese zur Verhaltensverbesserung beiträgt. Es könnten aber auch andere Mechanismen eine Rolle spielen (Meshi et al., 2006). Die beschleunigte Integration neuer Neuronen im alternden Gyrus dentatus nach dem Training, die die Qualität der neuen GCs verändert, könnte ebenfalls zur Verhaltensverbesserung beitragen. Während sich Neuronen, die bei Mäusen mittleren Alters geboren werden, langsam entwickeln, fördert anhaltende freiwillige Bewegung das dendritische Wachstum, die Stachelbildung und die neuronale Integration (Trinchero et al., 2017). Ähnliche Wirkungen wurden bei kurzen Expositionen gegenüber Umweltanreicherungen (EE) beobachtet (Trinchero et al., 2019). Wenn sie sich über mehrere neuronale Kohorten akkumuliert, könnte die durch Bewegung ausgelöste beschleunigte neuronale Integration einen signifikanten Einfluss auf das vom Hippocampus abhängige Lernen und Verhalten ausüben. In dieser Arbeit zeigen wir, dass mehrere Kohorten neuer GCs schnell in die bereits bestehenden Schaltkreise von Mäusen integriert werden können, die weiterhin freiwillig laufen, und dass diese Effekte anhalten, wenn die Mäuse aufgehört haben zu laufen.
Materialien und Methoden
Mäuse und Chirurgie
C57BL/6J männliche Mäuse wurden mit 4-5 Tieren pro Käfig unter Standardbedingungen untergebracht. Acht Monate alte (8M) Mäuse wurden ausgewählt, da jenseits dieses Alters ein starker Rückgang der hippocampalen Neurogenese zu verzeichnen ist, der die Untersuchung von markierten Neuronen ausschließt (Morgenstern et al., 2008; Trinchero et al., 2017). Mäuse wurden betäubt (150 μg Ketamin/15 μg Xylazin in 10 μl Kochsalzlösung/g), und Retrovirus wurde in die septale Region des rechten Gyrus dentatus (1,5 μl bei 0,15 μl/min) unter Verwendung steriler kalibrierter Mikrokapillarpipetten durch stereotaktische Chirurgie infundiert; Koordinaten vom Bregma (in mm): -2 anteroposterior, -1,5 lateral und -1,9 ventral. Zu den angegebenen Zeitpunkten wurden die Gehirne fixiert und Schnitte für die konfokale Bildgebung vorbereitet (Trinchero et al., 2017). Nur GCs aus dem septalen Gyrus dentatus wurden in die Analyse einbezogen, entsprechend Schnitten, die gemäß dem Mausgehirnatlas (Paxinos und Franklin, 2001) zwischen -0,96 und -2,30 mm vom Bregma lokalisiert waren. Die Versuchsprotokolle wurden vom Institutional Animal Care and Use Committee der Fundación Instituto Leloir gemäß den Grundsätzen für biomedizinische Forschung mit Tieren des Council for International Organizations for Medical Sciences und den Bestimmungen des Leitfadens für die Pflege und Verwendung von Labortieren genehmigt.
Laufen
Die Laufdistanzen wurden für jedes Experiment mit kabellosen Laufrädern aufgezeichnet. Bei den Experimenten in Abbildung 1 wurden die Tiere 7 oder 21 Tage lang mit einem Laufrad untergebracht, wie angegeben. In diesem Zustand liefen die Mäuse ∼2 km/Tag. In den Abbildungen 2 und 3, in denen die Mäuse 1, 2 oder 3 Monate lang liefen, betrug die überwachte Strecke ∼10 km/Tag.
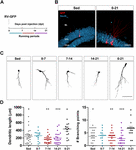
Abbildung 1. Lange, aber nicht kurze Laufperioden beschleunigen die morphologische Reifung von neuen GCs. (A) Versuchsaufbau. Auf die RV-GFP-Injektion folgte eine Woche freiwilligen Laufens in den angegebenen Zeitfenstern oder während des gesamten Experiments (0-21 dpi). (B) Repräsentative Bilder von 21-dpi-GCs, die GFP (rot) exprimieren, aufgenommen von sitzenden und 0-21 laufenden Gruppen. NeuN (blau) markiert die Körnerzellschicht (GCL) (ML, Molekularschicht). Maßstabsbalken, 50 μm. (C) Repräsentative konfokale Bilder von 21-dpi GFP-GCs für die verschiedenen Gruppen. Maßstabsbalken, 50 μm. (D) Dendritische Komplexität (Länge und Verzweigungspunkte) für die verschiedenen Lauffenster. ∗, ∗∗ und ∗∗∗ bezeichnen p < 0,05, p < 0,01 und p < 0,001 im Vergleich zur 0-21-Laufgruppe nach Kruskal-Wallis-Test, gefolgt von Dunns Post-Hoc-Test. Es wurden keine Unterschiede zwischen den Gruppen gefunden, die 7 Tage lang gelaufen waren. Stichprobengrößen (Neuronen/Mäuse): 27/3 (Sed), 14/3 (0-7), 27/3 (7-14), 22/3 (14-21) und 15/3 (0-21). Die horizontalen Balken geben den Mittelwert ± SEM an. Offene Kreise entsprechen Beispielneuronen.
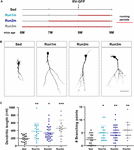
Abbildung 2. Auswirkungen des Laufens auf verschiedene Neuronen-Kohorten. (A) Experimenteller Aufbau. Auf die RV-GFP-Injektion folgten 3 Wochen Lauftraining, dem ein sitzender Zustand (Run1m), 1 (Run2m) oder 2 Monate Lauftraining (Run3m) vorausging. Alle Gruppen wurden mit sitzenden Mäusen (Sed) verglichen. Die Gesamtlänge der Dendriten wurde nach 21 dpi analysiert. (B) Repräsentative konfokale Bilder von GFP-GCs. Maßstabsbalken, 50 μm. (C) Dendritische Komplexität (Länge und Verzweigungspunkte) für die verschiedenen Fenster des Laufens. ∗, ∗∗ und ∗∗∗ bezeichnen p < 0,05, p < 0,01 und p < 0,001 im Vergleich zu Sed nach Kruskal-Wallis-Test, gefolgt von Dunns Post-Hoc-Test. Stichprobengrößen (Neuronen/Mäuse): 20/3 (Sed), 19/3 (Run1m), 31/3 (Run2m) und 15/3 (Run3m). Die horizontalen Balken geben den Mittelwert ± SEM an. Offene Kreise entsprechen Beispielneuronen.

Abbildung 3. Anhaltende Effekte von chronischem Training. (A) Experimenteller Aufbau. Nach der RV-GFP-Injektion wurde 3 Wochen lang gelaufen (Run1m) oder 1 Monat lang trainiert (Run-1m) oder 1 Monat lang trainiert und 1 Monat lang ohne das Laufrad (Run-2m). Alle Gruppen wurden mit sitzenden Mäusen (Sed) verglichen. Die Gesamtlänge der Dendriten wurde nach 21 dpi analysiert. (B) Repräsentative konfokale Bilder von markierten GCs. Maßstabsbalken, 50 μm. (C) Dendritische Komplexität (Länge und Verzweigungspunkte) für die verschiedenen Lauffenster. ∗∗∗ bedeutet p < 0,001 im Vergleich zu Sed nach Kruskal-Wallis-Test, gefolgt von Dunns Post-hoc-Test. Stichprobengrößen (Neuronen/Mäuse): 33/4 (Sed), 39/4 (Run1m), 15/4 (Run-1m) und 18/3 (Run-2m). (D) Die MFB-Morphologie in CA3 wurde für die Gruppen Run1m und Run-1m analysiert und mit Sed verglichen. Repräsentative konfokale Bilder. Maßstabsbalken, 5 μm. (E) ∗ und ∗∗ bezeichnen p < 0,05 und p < 0,01 nach Kruskal-Wallis-Test, gefolgt von Dunns Post-Hoc-Test. Stichprobenumfang: 27/4 (Sed), 32/4 (Run1m) und 18/4 (Run-1m). Die horizontalen Balken geben den Mittelwert ± SEM an. Offene Kreise entsprechen Beispielboutons.
Immunfluoreszenz
Die Immunfärbung wurde an 60-μm frei schwimmenden koronalen Schnitten durchgeführt. Die Antikörper wurden in trisgepufferter Kochsalzlösung (TBS) mit 3% Eselserum und 0,25% Triton X-100 aufgetragen. Die Immunfluoreszenz wurde mit Anti-GFP (Kaninchenpolyklonal; 1:500; Invitrogen), Anti-NeuN (Mausmonoklonal; 1:50; ein Geschenk von F.H. Gage, Salk Institute for Biological Studies, La Jolla, CA, USA), Esel-Anti-Kaninchen-Cy3 und Esel-Anti-Maus-Cy5-Antikörper (1:250; Jackson Immuno Research Laboratories) durchgeführt.
Konfokale Mikroskopie
Für die Messung der dendritischen Länge wurden Bilder (40×; NA 1,3; Öl-Immersion) von 60-μm dicken Schnitten aufgenommen, wobei Z-Stapel mit 35-50 optischen Schnitten, airy unit = 1 in 0,8-μm-Intervallen (Trinchero et al, 2017). Die dendritische Länge wurde dann mit der LSM Image Browser Software aus Projektionen dreidimensionaler Rekonstruktionen auf eine einzige Ebene in GFP-exprimierenden GCs gemessen. Bilder von GFP-markierten MFBs in der CA3-Region wurden in 0,4-μm-Intervallen (63×; NA 1,4; Ölimmersion) und einem digitalen Zoom von 6 aufgenommen. Fläche und Anzahl der Filopodien wurden anhand von Projektionen dreidimensionaler Rekonstruktionen auf eine einzige Ebene analysiert. Moosfaser-Boutons (MFB), die die folgenden Kriterien erfüllten, wurden für die Quantifizierung ausgewählt: (i) der Durchmesser des Boutons war >drei Mal größer als der Durchmesser der Faser, (ii) das Bouton war an mindestens einem Ende mit der Moosfaser verbunden (Toni et al., 2008). Filopodien wurden als Ausstülpungen identifiziert, die von großen moosartigen Endigungen (1 μm < Länge < 20 μm) ausgehen (Acsady et al., 1998). Filopodiale Erweiterungen wurden durch Zählen der Anzahl der Ausstülpungen pro Terminal gemessen. Für die Bildaufnahme und die Analyse der morphologischen Eigenschaften waren alle untersuchten Versuchsgruppen für den Untersucher blind.
Statistische Analyse
Wenn nicht anders angegeben, werden die Daten als Mittelwert ± SEM angegeben. Die Normalität wurde mit dem Shapiro-Wilks-Test, dem D’Agostino-Pearson Omnibus-Test und dem Kolmogorov-Smirnov-Test mit einem p-Wert von 0,05 bewertet. Wenn die Daten den Normalitätstests entsprachen (Gaußsche Verteilung und gleiche Varianz), wurde ein ungepaarter t-Test mit Welch-Korrektur oder eine ANOVA mit Bonferroni-Post-hoc-Test durchgeführt. In den Fällen, in denen die Normalität nicht erfüllt war, wurden die folgenden nichtparametrischen Tests verwendet: Mann-Whitney-Test für unabhängige Vergleiche und Kruskal-Wallis-Test für multiple Vergleiche.
Ergebnisse
Wir haben zuvor gezeigt, dass Laufen die Entwicklung und funktionelle Integration neuer GCs im alternden Hippocampus beschleunigt (Trinchero et al., 2017). Wir untersuchten nun, ob diese Art von Plastizität ein anhaltendes Aktivitätsniveau erfordert, das sich im Laufe der Zeit akkumuliert, oder ob auch kürzere Laufperioden eine schnellere Integration auslösen können, wie dies zuvor für die Exposition gegenüber EE beobachtet wurde (Trinchero et al., 2019). Um diese Frage zu beantworten, wurden neue neuronale Kohorten in Mäusen mittleren Alters (8 Monate; 8M) mit einem GFP-exprimierenden Retrovirus (RV-GFP) markiert. Den Mäusen wurde erlaubt, ein Laufrad für 1 Woche in verschiedenen Fenstern der neuronalen Entwicklung zu benutzen oder für das gesamte Intervall des neuronalen Wachstums (3 Wochen; Abbildungen 1A und B) zu laufen. Wie zuvor beschrieben, entwickelten sich neue GCs bei sitzenden Mäusen langsam, was zu kurzen Dendriten mit geringen Verzweigungen nach 3 Wochen führte. Eine Woche Laufen änderte das allgemeine Erscheinungsbild der neuen GCs in keinem der getesteten Intervalle (Abbildungen 1C und D). Im Gegensatz dazu führte das Laufen während des gesamten dreiwöchigen Intervalls zu einer erhöhten dendritischen Länge und Verzweigung, was mit einer beschleunigten neuronalen Integration übereinstimmt.
Die beobachteten Auswirkungen des Trainings wurden an einer einzigen neuronalen Kohorte getestet, derjenigen, die retroviral markiert wurde. Da jedoch ständig neue GCs gebildet werden, ist es denkbar, dass GCs, die zu unterschiedlichen Zeitpunkten innerhalb des Trainingszeitraums geboren werden, ebenfalls von der Aktivität beeinflusst werden könnten. Um diese Hypothese zu testen, verwendeten wir eine einfache Strategie, um neuronale Kohorten zu markieren, die zu unterschiedlichen Zeitpunkten in Bezug auf den Beginn der Übung geboren wurden, indem wir Mäuse für verschiedene Zeiträume Laufrädern aussetzten, aber immer die neuronale Struktur 3 Wochen nach der retroviralen Injektion analysierten (der Einfachheit halber als 1m bezeichnet). Auf diese Weise wurden drei Kohorten verglichen: eine, die 3 Wochen lang lief und direkt zu Beginn der Übung markiert wurde (Run1m), eine, die 2 Monate lang lief und 1 Monat nach Beginn der Übung markiert wurde (Run2m), und eine, die 3 Monate lang lief und 2 Monate nach Beginn der Übung markiert wurde (Run3m) (Abbildung 2A). Wir beobachteten unter allen Bedingungen ein ähnliches Ausmaß an neuronalem Wachstum im Vergleich zu sitzenden Mäusen, was darauf hindeutet, dass alle neuronalen Kohorten, die im Gehirn einer Maus mittleren Alters entstehen, die freiwillig läuft, ein schnelles Wachstum und eine schnelle Integration erfahren (Abbildungen 2B und C). Die Dendritenbäume von GCs in Run3m-Mäusen waren etwas länger als die von Run1m- oder Run2m-Mäusen, was darauf hindeutet, dass die Förderung der neuronalen Integration auf einen Mechanismus reagieren könnte, dessen Wirkung sich mit der Zeit akkumuliert. Dennoch führte 1 Monat Laufen zu einem nahezu maximalen Effekt auf die GC-Entwicklung.
Anschließend untersuchten wir die Auswirkungen von Bewegung im alternden Gehirn auf neuronale Kohorten, die nach Beendigung der Aktivität entstehen. Wir verglichen, wie das Laufen über 3-4 Wochen die Entwicklung neuer GCs beeinflusst, die direkt zu Beginn (Run1m), am Ende (Run-1m) oder 1 Monat nach dem Ende des Trainings (Run-2m; Abbildung 3A) geboren werden. Überraschenderweise reagierten neuronale Kohorten, die am Anfang oder am Ende der Laufperiode geboren wurden, ähnlich (Abbildungen 3B und C). Im Gegensatz dazu zeigten Kohorten, die 1 Monat nach dem Ende des Trainings (Run-2m) geboren wurden, nur einen subtilen Effekt.
Um sich vollständig in den Schaltkreis zu integrieren, stellen GCs glutamaterge exzitatorische Verbindungen zu CA3-Pyramidenzellen über große MFBs her und rekrutieren GABAerge Feedforward-Hemmung auf Pyramidenzellen über filopodiale Verlängerungen, die von diesen Terminals ausgehen (Acsady et al., 1998; Toni et al., 2008; Sun et al., 2013; Restivo et al., 2015). Während die konfokale Analyse keine Veränderungen in der Fläche der MFBs von Neuronen, die bei Run-1m oder Run1m geboren wurden, im Vergleich zu den Kontrollen aufzeigte, nahm die Anzahl der Filopodien/MFBs um ∼100% zu (Abbildungen 3D und E). Diese Ergebnisse deuten darauf hin, dass körperliche Bewegung spezifisch die Konnektivität von neuen GCs mit dem hemmenden lokalen Netzwerk erhöht (Trinchero et al., 2019).
Diskussion
Die Neurogenese im Erwachsenenalter umfasst eine Abfolge komplexer Entwicklungsschritte, die zur Integration neuer informationsverarbeitender Einheiten führt. Neurale Stammzellen der subgranulären Zone verlassen ihren Ruhezustand und werden zu proliferierenden neuralen Vorläuferzellen, die die Vorläuferpopulation erweitern (transit amplifying cells) (Bonaguidi et al., 2012). Aus den Vorläuferzellen entstehen Neuronen, die einwandern, sich entwickeln und in den Schaltkreis integriert werden. Während dieses verlängerten Zeitfensters kommt es aufgrund des apoptotischen Zelltods zu einer deutlichen Verringerung des Neuronenpools. Freiwillige Bewegung und EE sind starke Stimuli, die die Neurogenese im Hippocampus von Nagetieren während des gesamten Lebens ankurbeln (van Praag et al., 1999a, b; Kronenberg et al., 2003, 2006; Wu et al., 2008; Kannangara et al., 2011). Die Neurogenese nimmt im alternden Gehirn ab, hauptsächlich als Folge der Verringerung der Größe des Vorläuferzellenpools. Sowohl Laufen als auch EE können der bei alternden Tieren festgestellten verminderten Neuronenproduktion entgegenwirken, wobei sie über unterschiedliche Mechanismen wirken (Kempermann et al., 2010). Laufen wirkt auf zwei Ebenen, um die Neurogenese zu steigern: Es erhöht die Proliferationsrate neuraler Vorläuferzellen (van Praag et al., 1999b, 2005; Cooper et al., 2018) und beschleunigt die Reifung und funktionelle Integration der sich entwickelnden Neuronen (Trinchero et al., 2017). EE erhöht das Überleben und beschleunigt auch die Reifung neuer GCs, hat aber keinen Einfluss auf die Proliferation (Trinchero et al., 2017, 2019).
Laufen fördert auch die Neuverdrahtung der neuronalen Konnektivität und die Modulation der intrinsischen Eigenschaften in neuen GCs während der ersten Entwicklungswoche bei jungen erwachsenen Mäusen (Sah et al., 2017). Wir haben kürzlich über eine kritische Periode während der zweiten Woche der GC-Reifung bei alternden Tieren berichtet, in der EE das dendritische Wachstum und die schnellere Integration neuer Neuronen in den Schaltkreis induziert (Trinchero et al., 2019). Wir fragten uns, ob ein einwöchiger Lauf zu einem beliebigen Zeitpunkt der GC-Entwicklung deren Integration beeinflussen würde, fanden aber keinen Effekt (Abbildung 1). Die gesamte 3-wöchige Laufperiode war erforderlich, um die Neurogenese zu regulieren. Das Fehlen einer kurzfristigen Modulation deutet auf einen Mechanismus hin, der durch Faktoren vermittelt wird, die sich erst aufbauen müssen, um spürbare Veränderungen zu bewirken. Interessanterweise steigert freiwilliges Training die Produktion von BDNF, das sich über Wochen anreichert, bevor es ein Plateau erreicht, das eine maximale Wirkung entfaltet (Vecchio et al., 2018). Auch wenn Neurotrophine wichtige Vermittler sind, ist es plausibel, dass die hier beobachteten Effekte durch mehrere Mechanismen vermittelt werden. Bewegung steigert auch die elektrische Aktivität im Gyrus dentatus, erhöht den Blutfluss und moduliert die Neuroinflammation (Piatti et al., 2011; Speisman et al., 2013; Trinchero et al., 2017). Der Beitrag anderer Mechanismen erfordert weitere Studien.
Wir zeigen hier, dass ∼3 Wochen alte GCs von alternden Mäusen, die chronisch einem Laufrad ausgesetzt sind (bis zu 3 Monate), einen voll entwickelten Phänotyp mit langen und komplexen dendritischen Verzweigungen aufweisen, die denen von neuen GCs ähneln, die in jungen erwachsenen Mäusen erzeugt werden (Abbildung 2). Reife GCs in jungen erwachsenen Mäusen und Mäusen mittleren Alters erreichen am Ende der Entwicklung eine gleichwertige dendritische Länge und Komplexität, vergleichbar mit 3 Wochen alten GCs in alternden Mäusen, die EE oder Laufen ausgesetzt waren (Piatti et al., 2011; Trinchero et al., 2017, 2019). Diese gesammelten Beweise sprechen für eine deutliche Beschleunigung der Reifung durch Laufen.
Auf der Ebene der neuronalen Leistung förderte Laufen das schnelle Wachstum der Filopodienausläufer, veränderte aber nicht die Größe der MBFs (Abbildungen 3D, E). Dieses Ergebnis deutet darauf hin, dass sich neue GCs schnell integrieren, aber ihr Output könnte auf die Aktivierung von GABAergen Interneuronen in CA3 (die von Filopodien kontaktiert werden) ausgerichtet sein, anstatt auf Pyramidenzellen, die von MFBs kontaktiert werden (Acsady et al., 1998; Toni et al., 2008; Sun et al., 2013; Restivo et al., 2015). Es ist überraschend, dass EE bei alternden Mäusen eine deutliche Zunahme sowohl der Größe der MFBs als auch der Anzahl der Filopodienfortsätze hervorrief, was mit einer ausgewogeneren Modulation der neuronalen Leistung übereinstimmt (Trinchero et al., 2019). Wir spekulieren, dass die Veränderungen durch EE mit einem aktivitätsabhängigen Umbau spezifischer Synapsen zusammenhängen, die für die Kodierung räumlicher Hinweise verstärkt werden (Nicoll und Schmitz, 2005; Holtmaat und Svoboda, 2009). Im Gegensatz dazu könnte das Laufen ein allgemeiner Stimulus für neue GCs sein, um sich darauf vorzubereiten, sich mit spezifischen Zielen zu verbinden, wenn eine Kodierung notwendig wird, während der inhibitorische Tonus von GABAergen Interneuronen erhalten bleibt, der als Mechanismus zur Begrenzung der postsynaptischen Aktivität wirken könnte, bis der neue GC ordnungsgemäß in das umgebende Netzwerk eingegliedert ist.
Unsere Ergebnisse deuten darauf hin, dass das alternde Gehirn neurogene Signale erzeugt, wenn Mäuse über längere Zeiträume (Monate) weiterlaufen. In diesem Zusammenhang entwickeln und integrieren sich nachfolgende Neuronen-Kohorten, die in laufenden Mäusen geboren werden, schnell, so dass alternde Schaltkreise eine beträchtliche Anzahl neuer Neuronen ansammeln können (Abbildung 4). Die kontinuierliche Aufnahme neuer GCs mit ähnlichen Merkmalen wie bei jüngeren Mäusen führt zu einem verjüngten Hippocampus mit Neuronen, die auf zukünftige Erfahrungen reagieren könnten.
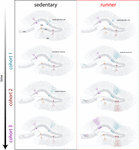
Abbildung 4. Durch Laufen induzierte Verjüngung des hippocampalen Netzwerks bei Mäusen mittleren Alters. Schematische Darstellung des Zeitverlaufs der neuronalen Integration bei sitzenden (links) und laufenden (rechts) Mäusen nach längeren Intervallen freiwilliger Bewegung. In der subgranulären Zone des Gyrus dentatus bleiben radial-gliaähnliche Zellen (RGL) in einem Ruhezustand (oben). Bei sitzenden, alternden Mäusen sind die Raten der Neurogenese niedrig, und neue Neuronen entwickeln sich nur langsam (repräsentative Kohorten sind durch unterschiedliche Farben gekennzeichnet). Bei laufenden Mäusen wird die Produktion neuer GCs angekurbelt, und diese neuen Einheiten entwickeln und integrieren sich schneller, wodurch das neuronale Netzwerk über einen längeren Zeitraum kumulativ erweitert wird. Letztendlich werden diese neuen Kohorten voll ausgereifter Neuronen aktiviert, um bei Bedarf Informationen zu verarbeiten.
Aus einer breiteren Perspektive betrachtet, geht die mit der modernen Gesellschaft verbundene Zunahme der Lebenserwartung mit einem höheren Risiko für kognitiven Verfall einher. Daher ist es wichtig, die Mechanismen zu verstehen, die den bekannten Vorteilen von Bewegung für die Gehirnfunktion zugrunde liegen. Darüber hinaus könnte es langfristige Unterschiede zwischen Personen geben, die in verschiedenen Lebensabschnitten Sport treiben, und solchen, die kontinuierlich Sport treiben, was die Verringerung des Risikos für die Entwicklung neurodegenerativer Erkrankungen angeht (Llorens-Martin, 2018). Unsere Ergebnisse zeigen, dass kontinuierliches Laufen die Integration vieler neuronaler Kohorten fördert und so die Komplexität des Netzwerks auf bemerkenswerte Weise erhöht. Die Entwicklung verschiedener Strategien zur Steigerung der Wirksamkeit der Integration neuer Neuronen im Hippocampus könnte ein vielversprechender Mechanismus der Plastizität sein, um den kognitiven Abbau im gesunden und kranken alternden Gehirn zu verbessern. Die Untersuchung der Mechanismen, die den verschiedenen Aspekten einer solchen beschleunigten neuronalen Integration und Entwicklung zugrunde liegen, wird uns viel über das Potenzial für die Plastizität neuronaler Netzwerke im alternden Gehirn lehren.
Datenverfügbarkeit
Die Daten, die die Ergebnisse dieser Studie untermauern, sind auf angemessene Anfrage beim entsprechenden Autor erhältlich.
Ethische Erklärung
Die Tierstudie wurde vom Komitee für die Verwendung und Pflege von Labortieren des Leloir-Instituts geprüft und genehmigt.
Beiträge der Autoren
MT und MH führten die Experimente durch und analysierten die Daten. MT, MH und AS planten die Experimente und schrieben das Manuskript. AS leistete finanzielle Unterstützung.
Finanzierung
Diese Arbeit wurde von der argentinischen Agentur für die Förderung von Wissenschaft und Technologie (Grant# PICT2015-3814), dem National Institute of Neurological Disorders and Stroke und dem Fogarty International Center (Grant# R01NS103758) an AS unterstützt, der Prüfer im Consejo Nacional de Investigaciones Científicas y Técnicas (CONICET) ist. MT wurde durch ein CONICET-Stipendium unterstützt.
Erklärung zu Interessenkonflikten
Die Autoren erklären, dass die Forschung in Abwesenheit jeglicher kommerzieller oder finanzieller Beziehungen durchgeführt wurde, die als potenzieller Interessenkonflikt ausgelegt werden könnten.
Danksagungen
Wir danken den Mitgliedern des Labors von AS für aufschlussreiche Diskussionen.
Acsady, L., Kamondi, A., Sik, A., Freund, T., und Buzsaki, G. (1998). GABAerge Zellen sind die wichtigsten postsynaptischen Ziele der Mossy-Fasern im Hippocampus der Ratte. J. Neurosci. 18, 3386-3403.
PubMed Abstract | Google Scholar
Altman, J., and Das, G. D. (1965). Autoradiographischer und histologischer Nachweis der postnatalen hippocampalen Neurogenese bei Ratten. J. Comp. Neurol. 124, 319-335.
Google Scholar
Bartsch, T., and Wulff, P. (2015). Der Hippocampus in Alterung und Krankheit: von Plastizität bis Vulnerabilität. Neuroscience 309, 1-16. doi: 10.1016/j.neuroscience.2015.07.084
PubMed Abstract | CrossRef Full Text | Google Scholar
Bonaguidi, M. A., Song, J., Ming, G. L., and Song, H. (2012). Eine vereinheitlichende Hypothese über die Eigenschaften neuraler Stammzellen von Säugetieren im erwachsenen Hippocampus. Curr. Opin. Neurobiol. 22, 754-761. doi: 10.1016/j.conb.2012.03.013
PubMed Abstract | CrossRef Full Text | Google Scholar
Burke, S. N., and Barnes, C. A. (2006). Neuronale Plastizität im alternden Gehirn. Nat. Rev. Neurosci. 7, 30-40.
PubMed Abstract | Google Scholar
Burke, S. N., and Barnes, C. A. (2010). Senescent synapses and hippocampal circuit dynamics. Trends Neurosci. 33, 153-161. doi: 10.1016/j.tins.2009.12.003
PubMed Abstract | CrossRef Full Text | Google Scholar
Buzsaki, G., and Moser, E. I. (2013). Gedächtnis, Navigation und Theta-Rhythmus im hippocampalen-entorhinalen System. Nat. Neurosci. 16, 130-138. doi: 10.1038/nn.3304
PubMed Abstract | CrossRef Full Text | Google Scholar
Cooper, C., Moon, H. Y., and van Praag, H. (2018). Auf der Jagd nach der hippocampalen Plastizität. Cold Spring Harb. Perspect. Med. 8:a029736. doi: 10.1101/cshperspect.a029736
PubMed Abstract | CrossRef Full Text | Google Scholar
Duzel, E., van Praag, H., and Sendtner, M. (2016). Kann körperliche Bewegung im Alter das Gedächtnis und die Funktion des Hippocampus verbessern? Brain 139, 662-673. doi: 10.1093/brain/awv407
PubMed Abstract | CrossRef Full Text | Google Scholar
Eriksson, P. S., Perfilieva, E., Bjork-Eriksson, T., Alborn, A. M., Nordborg, C., Peterson, D. A., et al. (1998). Neurogenese im erwachsenen menschlichen Hippocampus. Nat. Med. 4, 1313-1317.
PubMed Abstract | Google Scholar
Fan, X., Wheatley, E. G., and Villeda, S. A. (2017). Mechanismen der Alterung des Hippocampus und das Potenzial für Verjüngung. Annu. Rev. Neurosci. 40, 251-272. doi: 10.1146/annurev-neuro-072116-031357
PubMed Abstract | CrossRef Full Text | Google Scholar
Gebara, E., Sultan, S., Kocher-Braissant, J., and Toni, N. (2013). Adult hippocampal neurogenesis inversely correlates with microglia in conditions of voluntary running and aging. Front. Neurosci. 7:145. doi: 10.3389/fnins.2013.00145
PubMed Abstract | CrossRef Full Text | Google Scholar
Holtmaat, A., and Svoboda, K. (2009). Erfahrungsabhängige strukturelle synaptische Plastizität im Gehirn von Säugetieren. Nat. Rev. Neurosci. 10, 647-658. doi: 10.1038/nrn2699
PubMed Abstract | CrossRef Full Text | Google Scholar
Kannangara, T. S., Lucero, M. J., Gil-Mohapel, J., Drapala, R. J., Simpson, J. M., Christie, B. R., et al. (2011). Laufen reduziert Stress und fördert die Zellgenese bei gealterten Mäusen. Neurobiol. Aging 32, 2279-2286. doi: 10.1016/j.neurobiolaging.2009.12.025
PubMed Abstract | CrossRef Full Text | Google Scholar
Kempermann, G., Fabel, K., Ehninger, D., Babu, H., Leal-Galicia, P., Garthe, A., et al. (2010). Warum und wie körperliche Aktivität die erfahrungsinduzierte Plastizität des Gehirns fördert. Front. Neurosci. 4:189. doi: 10.3389/fnins.2010.00189
PubMed Abstract | CrossRef Full Text | Google Scholar
Kempermann, G., Kuhn, H. G., and Gage, F. H. (1998). Erfahrungsinduzierte Neurogenese im seneszenten Gyrus dentatus. J. Neurosci. 18, 3206-3212.
PubMed Abstract | Google Scholar
Kronenberg, G., Bick-Sander, A., Bunk, E., Wolf, C., Ehninger, D., and Kempermann, G. (2006). Körperliche Bewegung verhindert den altersbedingten Rückgang der Vorläuferzellenaktivität im Gyrus dentatus der Maus. Neurobiol. Aging 27, 1505-1513. doi: 10.1016/j.neurobiolaging.2005.09.016
PubMed Abstract | CrossRef Full Text | Google Scholar
Kronenberg, G., Reuter, K., Steiner, B., Brandt, M. D., Jessberger, S., Yamaguchi, M., et al. (2003). Subpopulationen von proliferierenden Zellen des adulten Hippocampus reagieren unterschiedlich auf physiologische neurogene Reize. J. Comp. Neurol. 467, 455-463. doi: 10.1002/cne.10945
PubMed Abstract | CrossRef Full Text | Google Scholar
Kuhn, H. G., Dickinson-Anson, H., und Gage, F. H. (1996). Neurogenese im Gyrus dentatus der erwachsenen Ratte: Altersbedingte Abnahme der Proliferation neuronaler Vorläufer. J. Neurosci. 16, 2027-2033.
PubMed Abstract | Google Scholar
Llorens-Martin, M. (2018). Neue Neuronen trainieren, um die Alzheimer-Krankheit zu besiegen. Brain Plast. 4, 111-126. doi: 10.3233/bpl-180065
PubMed Abstract | CrossRef Full Text | Google Scholar
Marlatt, M. W., Potter, M. C., Lucassen, P. J., and van Praag, H. (2012). Laufen im mittleren Alter verbessert die Gedächtnisfunktion, die hippocampale Neurogenese und die BDNF-Spiegel bei weiblichen C57BL/6J-Mäusen. Dev. Neurobiol. 72, 943-952. doi: 10.1002/dneu.22009
PubMed Abstract | CrossRef Full Text | Google Scholar
Meshi, D., Drew, M. R., Saxe, M., Ansorge, M. S., David, D., Santarelli, L., et al. (2006). Die Neurogenese im Hippocampus ist für die Verhaltenseffekte von Umweltanreicherung nicht erforderlich. Nat. Neurosci. 9, 729-731. doi: 10.1038/nn1696
PubMed Abstract | CrossRef Full Text | Google Scholar
Moreno-Jiménez, E. P., Flor-García, M., Terreros-Roncal, J., Rábano, A., Cafini, F., Pallas-Bazarra, N., et al. (2019). Adulte hippocampale Neurogenese ist bei neurologisch gesunden Probanden reichlich vorhanden und nimmt bei Patienten mit Alzheimer-Krankheit stark ab. Nat. Med. 25, 554-560.
Google Scholar
Morgenstern, N. A., Lombardi, G., and Schinder, A. F. (2008). Neugeborene Körnerzellen im alternden Gyrus dentatus. J. Physiol. 586, 3751-3757. doi: 10.1113/jphysiol.2008.154807
PubMed Abstract | CrossRef Full Text | Google Scholar
Nicoll, R. A., und Schmitz, D. (2005). Synaptische Plastizität an Synapsen der Moosfaser im Hippocampus. Nat. Rev. Neurosci. 6, 863-876.
PubMed Abstract | Google Scholar
O’Callaghan, R. M., Griffin, E. W., and Kelly, A. M. (2009). Langfristige Laufbandbelastung schützt vor altersbedingten neurodegenerativen Veränderungen im Hippocampus der Ratte. Hippocampus 19, 1019-1029. doi: 10.1002/hipo.20591
PubMed Abstract | CrossRef Full Text | Google Scholar
Paxinos, G., und Franklin, K. B. J. (2001). The Mouse Brain in Stereotaxic Coordinates. Amsterdam: Elsevier.
Google Scholar
Piatti, V. C., Davies-Sala, M. G., Esposito, M. S., Mongiat, L. A., Trinchero, M. F., and Schinder, A. F. (2011). Der Zeitpunkt der neuronalen Reifung im adulten Hippocampus wird durch lokale Netzwerkaktivität moduliert. J. Neurosci. 31, 7715-7728. doi: 10.1523/JNEUROSCI.1380-11.2011
PubMed Abstract | CrossRef Full Text | Google Scholar
Restivo, L., Niibori, Y., Mercaldo, V., Josselyn, S. A., and Frankland, P. W. (2015). Entwicklung der Konnektivität erwachsener Zellen mit erregenden und hemmenden Zellpopulationen im Hippocampus. J. Neurosci. 35, 10600-10612. doi: 10.1523/JNEUROSCI.3238-14.2015
PubMed Abstract | CrossRef Full Text | Google Scholar
Sah, N., Peterson, B. D., Lubejko, S. T., Vivar, C., and van Praag, H. (2017). Running reorganisiert die Schaltkreise von einwöchigen, erwachsenen Hippocampus-Neuronen. Sci. Rep. 7:10903. doi: 10.1038/s41598-017-11268-z
PubMed Abstract | CrossRef Full Text | Google Scholar
Speisman, R. B., Kumar, A., Rani, A., Foster, T. C., and Ormerod, B. K. (2013). Tägliche Bewegung verbessert das Gedächtnis, stimuliert die Neurogenese im Hippocampus und moduliert immunologische und neuroimmune Zytokine bei alternden Ratten. Brain Behav. Immun. 28, 25-43. doi: 10.1016/j.bbi.2012.09.013
PubMed Abstract | CrossRef Full Text | Google Scholar
Sun, G. J., Sailor, K. A., Mahmood, Q. A., Chavali, N., Christian, K. M., Song, H., et al. (2013). Nahtlose Rekonstruktion intakter, im Erwachsenenalter geborener Neuronen durch serielle Endblock-Bildgebung zeigt komplexe axonale Führung und Entwicklung im erwachsenen Hippocampus. J. Neurosci. 33, 11400-11411. doi: 10.1523/JNEUROSCI.1374-13.2013
PubMed Abstract | CrossRef Full Text | Google Scholar
Toni, N., Laplagne, D. A., Zhao, C., Lombardi, G., Ribak, C. E., Gage, F. H., et al. (2008). Neuronen, die im adulten Gyrus dentatus geboren werden, bilden funktionelle Synapsen mit Zielzellen. Nat. Neurosci. 11, 901-907. doi: 10.1038/nn.2156
PubMed Abstract | CrossRef Full Text | Google Scholar
Trinchero, M. F., Buttner, K. A., Sulkes Cuevas, J. N., Temprana, S. G., Fontanet, P., Monzon Salinas, M. C., et al. (2017). Hohe Plastizität der neuen Körnerzellen im alternden Hippocampus. Cell Rep. 21, 1129-1139. doi: 10.1016/j.celrep.2017.09.064
PubMed Abstract | CrossRef Full Text | Google Scholar
Trinchero, M. F., Herrero, M., Monzon-Salinas, M. C., and Schinder, A. F. (2019). Erfahrungsabhängige strukturelle Plastizität von adulten Neuronen im alternden Hippocampus. Front. Neurosci. 13:739. doi: 10.3389/fnins.2019.00739
PubMed Abstract | CrossRef Full Text | Google Scholar
van Praag, H., Christie, B. R., Sejnowski, T. J., and Gage, F. H. (1999a). Laufen steigert die Neurogenese, das Lernen und die Langzeitpotenzierung bei Mäusen. Proc. Natl. Acad. Sci. U.S.A. 96, 13427-13431.
Google Scholar
van Praag, H., Kempermann, G., and Gage, F. H. (1999b). Laufen erhöht die Zellproliferation und Neurogenese im Gyrus dentatus der erwachsenen Maus. Nat. Neurosci. 2, 266-270.
PubMed Abstract | Google Scholar
van Praag, H., Shubert, T., Zhao, C., and Gage, F. H. (2005). Bewegung fördert das Lernen und die Neurogenese im Hippocampus bei gealterten Mäusen. J. Neurosci. 25, 8680-8685.
PubMed Abstract | Google Scholar
Vecchio, L. M., Meng, Y., Xhima, K., Lipsman, N., Hamani, C., and Aubert, I. (2018). Die neuroprotektiven Wirkungen von Bewegung: Erhaltung eines gesunden Gehirns während des Alterns. Brain Plast. 4, 17-52. doi: 10.3233/bpl-180069
PubMed Abstract | CrossRef Full Text | Google Scholar
Wu, C. W., Chang, Y. T., Yu, L., Chen, H. I., Jen, C. J., Wu, S. Y., et al. (2008). Bewegung steigert die Proliferation neuraler Stammzellen sowie das Neuritenwachstum und das Überleben neuronaler Vorläuferzellen im Gyrus dentatus von Mäusen mittleren Alters. J. Appl. Physiol. 105, 1585-1594. doi: 10.1152/japplphysiol.90775.2008
PubMed Abstract | CrossRef Full Text | Google Scholar
Wu, M. V., Luna, V. M., and Hen, R. (2015). Running rescues a fear-based contextual discrimination deficit in aged mice. Front. Syst. Neurosci. 9:114. doi: 10.3389/fnsys.2015.00114
PubMed Abstract | CrossRef Full Text | Google Scholar
Xu, B., Sun, A., He, Y., Qian, F., Liu, L., Chen, Y., et al. (2017). Running-induced memory enhancement correlates with the preservation of thin spines in the hippocampal area CA1 of old C57BL/6 mice. Neurobiol. Aging 52, 106-116. doi: 10.1016/j.neurobiolaging.2017.01.002
PubMed Abstract | CrossRef Full Text | Google Scholar




