Frontiers in Pharmacology
Introduction
Olanzapin ist eines der am häufigsten verwendeten Antipsychotika der zweiten Generation (SGA) zur Behandlung von Schizophrenie, bipolarer Störung und psychotischen Symptomen. Neben der Verbesserung der Hauptsymptome der Psychose weist Olanzapin eine hohe Akzeptanz auf, verringert die Zahl der Therapieabbrüche und beugt künftigen Rückfällen vor (Leucht et al., 2009). Viele randomisierte klinische Studien (RCTs) und Metaanalysen haben gezeigt, dass Olanzapin eines der wirksamsten Antipsychotika bei Patienten mit Schizophrenie ist (Leucht et al., 2013; Huhn et al., 2019).
Die häufigste unerwünschte Wirkung von Olanzapin ist die Gewichtszunahme (Allison et al., 1999). Olanzapin führt unter den SGAs zu den meisten Gewichtszunahmen. Die CAFE-Studie (Comparison of Atypicals for First Episode) zeigte, dass 80 % der mit Olanzapin behandelten Patienten in Woche 52 mehr als 7 % ihres ursprünglichen Körpergewichts zunahmen (McEvoy et al., 2007). Die Abbruchrate von Olanzapin aufgrund von Gewichtszunahme oder begleitenden metabolischen Effekten war in der CATIE-Studie (Clinical Antipsychotic Trials in Intervention Effectiveness) 2-8 Mal höher als bei anderen Antipsychotika (Lieberman et al., 2005). Die Gewichtszunahme wird nicht nur mit einer geringeren Therapietreue in Verbindung gebracht, sondern auch mit einer erheblichen medizinischen Morbidität und Mortalität. In Anbetracht der hohen Adipositasrate bei Patienten mit Schizophrenie (42 %) sollte das potenzielle Risiko einer olanzapininduzierten Gewichtszunahme sorgfältig geprüft werden (Newcomer, 2006). Einige randomisierte kontrollierte Studien (RCT) haben ergeben, dass Patienten mit psychischen Erkrankungen bis zu 30 Jahre früher sterben als die Allgemeinbevölkerung (Das-Munshi et al., 2017). Die häufigste Todesursache in dieser Bevölkerungsgruppe sind Herzkrankheiten. Ein Hauptrisikofaktor für Herzerkrankungen und vorzeitigen Tod bei diesen Patienten ist die Gewichtszunahme (Fekadu et al., 2015).
Die Mechanismen, die der durch Antipsychotika induzierten Gewichtszunahme und den nachteiligen Stoffwechseleffekten zugrunde liegen, sind nicht gut verstanden (Correll et al., 2011). Olanzapin wird mit erhöhtem Appetit und erhöhter Nahrungsaufnahme sowie verminderter Aktivität oder Beeinträchtigung der Stoffwechselregulation in Verbindung gebracht (Roerig et al., 2005; Henderson et al., 2015). Fountaine et al. berichteten, dass Olanzapin bei gesunden Männern zu einer Erhöhung des Körpergewichts durch erhöhte Nahrungsaufnahme führte, ohne dass es Anzeichen für eine verringerte Aktivität oder einen geringeren Verbrauch gab (Fountaine et al., 2010). Diese Beobachtung steht im Einklang mit Beobachtungen an männlichen jugendlichen stationären Patienten mit Schizophrenie (Gothelf et al., 2002). Die Patienten hatten nach einer 4-wöchigen Olanzapin-Behandlung einen signifikant erhöhten Body-Mass-Index aufgrund einer erhöhten Kalorienaufnahme (Gothelf et al., 2002). Die derzeitigen Erkenntnisse über den Zusammenhang zwischen Appetit und Gewichtszunahme sind jedoch nicht schlüssig (Poyurovsky et al., 2007; Case et al., 2010). Case et al. berichteten, dass frühe Appetitveränderungen in vier verschiedenen Studien nicht konsistent mit der Gesamtgewichtsveränderung korreliert waren (Case et al., 2010). Darüber hinaus wurde in keiner Studie der genaue Zeitpunkt der Appetitsteigerung angegeben, die Geschwindigkeit der Gewichtszunahme im Verhältnis zum Zeitpunkt der Appetitsteigerung verglichen oder die Unterschiede in der Gewichtszunahme und den metabolischen Auswirkungen zwischen Patienten mit gesteigertem oder unverändertem Appetit bewertet. Daher haben wir den Zusammenhang zwischen Appetitsteigerung und Olanzapin-induzierten Gewichtsveränderungen und begleitenden metabolischen Effekten bei medikamenten-naiven Patienten mit Schizophrenie in der ersten Episode untersucht.
Materialien und Methoden
Teilnehmer
Diese Studie wurde zwischen Dezember 2016 und April 2019 im Mental Health Institute of the Second Xiangya Hospital, Central South University, China durchgeführt. Die Teilnehmer wurden auf Schizophrenie gemäß den Kriterien des Diagnostic and Statistical Manual of Mental Disorders-Fifth Edition (DSM-5) (A.P. Association, 2013) untersucht. Da Patienten, die keine Antipsychotika einnehmen, nach einer Olanzapin-Behandlung mehr an Gewicht zuzunehmen scheinen (Correll et al., 2011), schlossen wir Patienten mit Schizophrenie in der ersten Episode im Alter von 18-50 Jahren in diese Studie ein.
Zu den Ausschlusskriterien gehörten (i) klinisch auffällige Befunde bei körperlichen Untersuchungen, Labortests oder Elektrokardiogramm (EKG)-Ergebnissen; (ii) Störungen wie geistige Behinderung, Substanz- oder Alkoholkonsumstörung, eine Diagnose anderer spezifischer systemischer Erkrankungen gemäß den DSM-5-Kriterien; (iii) kardiovaskuläre und metabolische Erkrankungen wie Diabetes mellitus, Dyslipidämie und Hypertonie; (iv) eine Vorgeschichte von Essstörungen; (v) strenge Diät innerhalb des Monats vor dem Screening oder während der Studie; und (vi) Schwangerschaft oder Stillzeit.
Intervention
Vorangegangene Studien haben darauf hingewiesen, dass die Olanzapin-induzierte Gewichtszunahme in den ersten 12 Wochen der Behandlung am schnellsten war (Correll et al., 2009). Daher wurden die Teilnehmer 12 Wochen lang mit Olanzapin (15-20 mg/Tag um 20:00 Uhr) behandelt. Die anfängliche Dosis von Olanzapin betrug 5 mg/Tag und wurde dann in der ersten Woche auf 15-20 mg/Tag angepasst.
Assessment
Baseline-Assessments umfassten demografische Daten, eine gründliche Anamnese, anthropometrische Messungen (Gewicht und Größe), Appetit, körperliche Untersuchung und Laboranalysen. Der Appetit wurde täglich, 30 Minuten vor dem Mittagessen, mit vier standardisierten Fragen ermittelt: Hunger, Sättigungsgefühl, Gedanken an Essen und Überessen. Die Antworten wurden auf einer Skala von 0 bis 10 eingestuft, wobei 0 = „überhaupt nicht“ und 10 = „extrem“. Appetitzunahme wurde definiert als eine >10%ige Zunahme der Appetitwerte im Ausgangszustand. Appetitminderung wurde definiert als eine >10%ige Verringerung der Appetitwerte im Ausgangszustand. Zur Bewertung des Schweregrads der Schizophreniesymptome wurde die Positiv-Negativ-Syndrom-Skala (PANSS) verwendet. Unerwünschte Wirkungen wurden anhand der Treatment Emergent Symptom Scale (TESS) bewertet. Bei jeder Nachuntersuchung wurden alle Ausgangsdaten (einschließlich körperlicher Untersuchung, anthropometrischer Messungen, Appetit und TESS) mit Ausnahme der PANSS wiederholt. Die PANSS wurde in Woche 12 erneut ausgewertet.
Vor der Behandlung und im nüchternen Zustand wurden Gewicht und Größe gemessen, nachdem die Teilnehmer ihre Schuhe ausgezogen und leichte Innenkleidung angezogen hatten. Der Appetit wurde vor dem Mittagessen beurteilt und beruhte auf dem Urteil des beurteilenden Arztes am Untersuchungstag. Die Laborwerte, einschließlich des Plasmaglukosespiegels sowie der Leber- und Nierenfunktion, wurden mit Hilfe enzymatischer Verfahren mit dem automatisierten chemischen Analysegerät Boehringer Mannheim/Hitachi 714 ermittelt. Insulin wurde mit einem Festphasen-Enzymimmunoassay (ELISA) gemessen.
Die primären Ergebnisse waren der Prozentsatz der Patienten, die einen gesteigerten Appetit hatten, und die Zeitspanne zwischen der Olanzapin-Behandlung und dem gesteigerten Appetit. Zu den sekundären Ergebnissen gehörten Veränderungen des Gewichts, des Body-Mass-Index (BMI), des Nüchternblutzuckers, des Nüchterninsulins und des Insulinresistenzindexes, der Lipidprofile (Triglyceride, Cholesterin, High-Density-Lipoprotein (HDL-C) und Low-Density-Lipoprotein (LDL-C)) sowie der PANSS-Score. Der BMI wurde nach den Kriterien der Working Group on Obesity in China berechnet: gesundes Gewicht (18,5 ≤ BMI <25 kg/m2), Übergewicht (25 ≤ BMI ≤ 28 kg/m2) und Fettleibigkeit (BMI > 28 kg/m2). Dyslipidämie wurde definiert als Cholesterin ≥ 5,18 mmolċl-1, Triglyzeride ≥ 1,70 mmolċl-1, HDL-C < 1,04 mmolċl-1 oder LDL-C ≥ 3,37 mmolċl-1, basierend auf den chinesischen Richtlinien für Dyslipidämie (Hu, 2017). Eine Analyse des Anteils der Patienten, die nach 12 Wochen mehr als 7 % ihres Ausgangskörpergewichts zugenommen hatten, was der Grenzwert für eine klinisch signifikante Gewichtszunahme ist, wurde ebenfalls einbezogen (Kanders et al., 1991).
Statistische Analyse
Das Statistical Package for Social Sciences, Version 25.0 (SPSS v25.0) wurde für die statistische Analyse verwendet. Kontinuierliche Variablen und kategoriale Variablen werden durch zusammenfassende Statistiken (Mittelwerte und Standardabweichungen) bzw. Häufigkeiten und Prozentsätze beschrieben. Student’s t-Test und Chi-Quadrat-Analysen wurden verwendet, um die Unterschiede zwischen den Gruppen bei den Veränderungen von Körpergewicht, BMI, Nüchternglukose und Insulin, Insulinresistenz-Index, Triglyceriden, Cholesterin, HDL-C und LDL-C von der Basislinie bis zu jedem Zeitpunkt zu analysieren. Wir untersuchten den Zusammenhang zwischen Gewicht, BMI, Insulinresistenzindex, LDL-C und Appetit mithilfe einer linearen Regressionsanalyse. Ein P-Wert (p) < 0,05 wurde als statistisch signifikant angesehen.
Ergebnisse
Insgesamt wurden 33 stationäre Schizophrenie-Patienten (Durchschnittsalter 23,5 Jahre; Bereich 18-36 Jahre) in die Studie aufgenommen. Der Anteil der weiblichen Patienten war höher (63,6 %, 21/33). Alle Patienten befanden sich im normalen BMI-Bereich (mittlerer BMI, 21,3 ± 1,7 kg/m2). Die mittlere Dauer der Schizophrenie betrug 11,2 ± 3,7 (Spanne 5-18) Monate. Zwei Patientinnen brachen die Studie nach 4 Wochen wegen gesteigerten Appetits ab; die übrigen 31 (93,9 %) Teilnehmer schlossen die Studie ab (Tabelle 1).
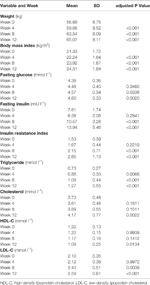
Tabelle 1 Zusammenfassung der Gewichts- und Stoffwechselwerte nach Studie.
Appetitsteigerung nach Olanzapin-Behandlung
Nach der 12-wöchigen Olanzapin-Behandlung hatten 77,4 % (24/31) der Patienten einen gesteigerten Appetit und 22,6 % (7/31) der Patienten hatten einen unveränderten Appetit. Wie in Abbildung 1 dargestellt, begann die Appetitsteigerung bei den 24 Patienten mit gesteigertem Appetit innerhalb der ersten 8 Wochen der Olanzapin-Behandlung und hielt bis zum Ende der Behandlung an. Die mittlere Zeitspanne vom Beginn der Olanzapin-Behandlung bis zur Appetitsteigerung betrug 20,3 Tage (SD = 14,4), und 25,0 % (6/24) und 70,8 % (17/24) steigerten ihren Appetit innerhalb von 1 Woche bzw. 4 Wochen. Bei zwei Patienten stieg der Appetit am 3. Tag nach der Olanzapin-Behandlung. Es wurde kein signifikanter Unterschied im olanzapininduzierten Appetit zwischen den verschiedenen Geschlechtern gefunden, wenn man die Zwei-Wege-Analyse ANOVA verwendet.
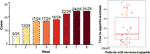
Abbildung 1 Anzahl der Patienten mit erhöhtem Appetit während der 8-wöchigen Olanzapin-Behandlung.
Veränderungen des Körpergewichts und des BMI nach Olanzapin-Behandlung
Nach der Olanzapin-Behandlung wurden signifikante Zunahmen von Gewicht und BMI beobachtet (Tabelle 1). Die mittlere Gewichtszunahme während der 12-wöchigen Olanzapin-Behandlung betrug 7,9 kg, wobei die Patienten in der ersten, zweiten und dritten 4-Wochen-Periode jeweils 2,4, 4,0 und 1,5 kg zunahmen. Weibliche Patienten nahmen häufiger zu (P < 0,001), mit einer durchschnittlichen Gewichtszunahme von 9,19 kg während des Studienzeitraums, verglichen mit einer Gewichtszunahme von 5,90 kg bei männlichen Patienten. Von allen Patienten nahmen 80,6 % (25/31) und 61,3 % (19/31) während der 12-wöchigen Olanzapin-Behandlung ihr ursprüngliches Körpergewicht um mehr als 7 % bzw. 10 % zu (ergänzende Tabelle 1). Nach 12 Wochen waren 51,6 % (16/31) der Patienten übergewichtig (BMI>25 kg/m2).
Veränderungen von Stoffwechselstörungen nach Olanzapin-Behandlung
Nach 12 Wochen wurden signifikante Anstiege von Nüchternglukose, Nüchterninsulin, Insulinresistenzindex, Triglyceriden, Cholesterin und LDL-C und Abnahmen von HDL-C beobachtet (Tabelle 1). Keiner der in die Studie einbezogenen Patienten hatte zu Beginn der Behandlung eine Dyslipidämie. Basierend auf den chinesischen Richtlinien für Dyslipidämie wiesen 38,7 % (12/31) der Patienten nach 12 Wochen Olanzapin-Behandlung eine Dyslipidämie auf.
Appetitsteigerung und Olanzapin-induzierte Gewichtszunahme
Um die Wirkung von gesteigertem Appetit auf die Olanzapin-induzierte Gewichtszunahme zu ermitteln, teilten wir die Patienten in zwei Gruppen ein (Gruppe mit gesteigertem Appetit und Gruppe mit unverändertem Appetit), je nachdem, ob der Appetit nach 12 Wochen Olanzapin-Behandlung zunahm oder nicht.
Im Vergleich zur Gruppe mit unverändertem Appetit kam es in der Gruppe mit gesteigertem Appetit nach 12-wöchiger Olanzapin-Behandlung zu einer signifikanten Gewichts- und BMI-Zunahme (Tabelle 2). Abbildung 2 zeigt den Vergleich der Gewichtszunahme und der stoffwechselbezogenen Ergebnisse zwischen den Gruppen mit erhöhtem und unverändertem Appetit. Detaillierte Analysen wurden in der ergänzenden Tabelle 2 dargestellt. Die Gewichtszunahme zwischen den beiden Gruppen war signifikant (P = 0,01) unter Verwendung der Zwei-Wege-Analyse ANOVA. Das durchschnittliche Gewicht stieg in der Gruppe mit gesteigertem Appetit um 9,1 kg (SD = 4,1) und in der Gruppe mit unverändertem Appetit um 3,9 kg (SD = 2,0), wobei ein signifikanter Unterschied zwischen den beiden Gruppen während der 12-wöchigen Olanzapin-Behandlung bestand. Ein größerer Prozentsatz der Patienten (91,7 %) in der Gruppe mit gesteigertem Appetit nahm nach 12 Wochen mehr als 7 % des ursprünglichen Körpergewichts zu, verglichen mit den Patienten in der Gruppe mit unverändertem Appetit (42,9 %; χ2 = 8,27, df = 1, p = 0,004). Ebenso nahmen mehr Patienten in der Gruppe mit gesteigertem Appetit (19/24, 79,2 %) nach 12 Wochen mehr als 10 % des ursprünglichen Körpergewichts zu, verglichen mit Patienten in der Gruppe mit unverändertem Appetit (0,0 %; χ2 = 14,32, df = 1, p < 0,001) (ergänzende Tabellen 3-5). Nach einer 12-wöchigen Olanzapin-Behandlung wurden 58,3% der Patienten in der Gruppe mit gesteigertem Appetit übergewichtig, verglichen mit 28,6% der Patienten in der Gruppe mit unverändertem Appetit. Die Appetitsteigerung vermittelte stark die Olanzapin-induzierte Gewichtszunahme mit einem Vermittlungseffekt von 66,2 %.

Tabelle 2 Deskriptive Statistik der Ergebnismaße zwischen den Gruppen mit gesteigertem und unverändertem Appetit zu Studienbeginn und in den Wochen 4, 8 und 12.
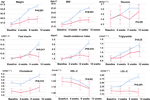
Abbildung 2 Vergleich von Körpergewicht, BMI, Glukose- und Lipidwerten zwischen den Gruppen mit erhöhtem und unverändertem Appetit. Die blaue Linie kennzeichnet Patienten mit gesteigertem Appetit; die rote Linie kennzeichnet Patienten mit unverändertem Appetit.
Appetitsteigerung und Olanzapin-induzierte Stoffwechselstörungen
Es gab signifikante Unterschiede bei Insulin (p = 0,017), Insulinresistenzindex (p = 0,015) und LDL-C (p = 0,001) zwischen den Gruppen mit gesteigertem und unverändertem Appetit nach 12 Wochen (Abbildung 2 und Tabelle 2). Vier Patienten in der Gruppe mit gesteigertem Appetit hatten in Woche 12 Cholesterinwerte ≥ 5,18 mmolċl-1, neun hatten Triglyceride ≥ 1,70 mmolċl-1, sechs hatten HDL-C < 1,04ċmmol l-1 und drei hatten LDL-C ≥ 3,37 mmolċl-1. Insgesamt hatten 13/24 Patienten in der Gruppe mit gesteigertem Appetit nach 12 Wochen eine Dyslipidämie, während keiner der Patienten in der Gruppe mit unverändertem Appetit während des Studienzeitraums eine Dyslipidämie entwickelte (Tabelle 3).

Tabelle 3 Dyslipidämie definiert durch jede einzelne Ergebnismessung in den Gruppen mit gesteigertem und unverändertem Appetit.
Die höchste Gewichtszunahme wurde 1 Monat nach dem Monat der Appetitsteigerung erreicht
In der Gruppe mit gesteigertem Appetit analysierten wir die mittlere Gewichtszunahme für jeden Patienten zu vier Zeitpunkten: vor dem Monat der Appetitsteigerung (-1M), im Monat der Appetitsteigerung (0M), einen Monat nach der Appetitsteigerung (+1M) und zwei Monate nach der Appetitsteigerung (+2M). Im Vergleich zu -1M nahm die Gewichtszunahme bei 0M zu, diese Veränderung war jedoch nicht signifikant (-1M vs. 0M, 1,4 ± 1,2 kg vs. 3,1 ± 1,4 kg). Die Gewichtszunahme erreichte ihren Höhepunkt bei +1M, mit 4,3 ± 2.4 kg Zunahme. Die Gewichtszunahme verlangsamte sich bei +2M (p < 0,001) um 1,6 ± 1,5 kg. Die Gewichtszunahme bei +2M verlangsamte und stabilisierte sich, und es wurden keine signifikanten Unterschiede im Vergleich zu -1M beobachtet (Abbildung 3 und ergänzende Tabelle 6).
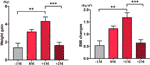
Abbildung 3 Mittlere Geschwindigkeit der Gewichtszunahme in der Gruppe mit erhöhtem Appetit. Die mittlere Gewichtszunahme für jeden Patienten pro Monat während des Studienzeitraums wurde zu vier Zeitpunkten analysiert: vor dem Monat der Zeit bis zum gesteigerten Appetit (-1M), dem Monat der Zeit bis zum gesteigerten Appetit (0M), 1 Monat nach dem Monat der Zeit bis zum gesteigerten Appetit (+1M) und 2 Monate nach dem Monat der Zeit bis zum gesteigerten Appetit (+2M). ** bedeutet P < 0,01, *** bedeutet P < 0,001.
Früherer gesteigerter Appetit sagt mehr Gewichtszunahme in 1 Monat nach dem Monat der Appetitsteigerung voraus
Wir verglichen ferner die Geschwindigkeit der Gewichtszunahme von Teilnehmern mit gesteigertem Appetit innerhalb von 4 Wochen (A) und Teilnehmern mit gesteigertem Appetit zwischen 4 und 8 Wochen (B). Bei 0M waren die Geschwindigkeiten der Gewichtszunahme zwischen Teilnehmern mit erhöhtem Appetit innerhalb von 4 Wochen und Teilnehmern mit erhöhtem Appetit zwischen 4 und 8 Wochen nicht signifikant unterschiedlich. Teilnehmer mit früherem gesteigertem Appetit zeigten jedoch eine signifikant höhere Geschwindigkeit der Gewichtszunahme bei +1M. Diese Ergebnisse zeigen, dass eine frühere Appetitsteigerung zu einer stärkeren Gewichtszunahme während der Nachbeobachtungszeit führen könnte (Abbildung 4). Ähnliche Veränderungen des BMI wurden während der vier Zeitpunkte beobachtet (Abbildungen 3 und 4).
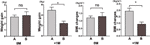
Abbildung 4 Vergleich der Geschwindigkeit der Gewichtszunahme von Teilnehmern mit erhöhtem Appetit in verschiedenen Monaten. Wir verglichen die Geschwindigkeit der Gewichtszunahme von Teilnehmern mit gesteigertem Appetit innerhalb von 4 Wochen (A) und Teilnehmern mit gesteigertem Appetit zwischen 4 und 8 Wochen (B) im Monat der Zeit bis zum gesteigerten Appetit (0M) und 1 Monat nach dem Monat der Zeit bis zum gesteigerten Appetit (+1M). ns, bedeutet nicht signifikant, * bedeutet P < 0,05.
Änderungen von Appetit und Geschwindigkeit der Stoffwechselstörung
Detaillierte beschreibende Daten für Veränderungen von Gewicht, BMI, Nüchternglukose, Insulin, Insulinresistenzindex, Triglycerid, Cholesterin, HDL-C und LDL-C sind in Tabelle 2 zusammengefasst. Um den Zusammenhang zwischen gesteigertem Appetit und Glukose- und Fettstoffwechsel zu untersuchen, analysierten wir die Veränderungen dieser Indikatoren zu vier Zeitpunkten in der Gruppe mit gesteigertem Appetit. Für Glukose, Triglyceride, HDL-C und LDL-C wurden zu keinem Zeitpunkt signifikante Geschwindigkeitsänderungen beobachtet. Signifikante Anstiege der Geschwindigkeiten von Insulin und des Insulinresistenzindex wurden nur bei +2M beobachtet (ergänzende Abbildung 1 und ergänzende Tabelle 6). Weitere Vergleiche ergaben, dass Teilnehmer mit erhöhtem Appetit innerhalb von 4 Wochen keine signifikant erhöhte Geschwindigkeit von Insulin und Insulinresistenzindex bei 0M und +1M aufwiesen, verglichen mit Teilnehmern mit erhöhtem Appetit zwischen 4 und 8 Wochen (ergänzende Abbildung 2).
Die Vorhersage des Appetits auf Olanzapin-induzierte Gewichtszunahme und Stoffwechselstörungen
Wir führten eine lineare Regressionsanalyse durch, um die Auswirkung der Appetitsteigerung auf die Gewichtszunahme, den Blutzuckerspiegel und die Lipidwerte zu bewerten. Nach Kontrolle statistisch signifikanter Variablen wie Geschlecht, Alter, Größe und Dauer wurden Gewichtszunahme, BMI, Nüchternglukose, Insulin, Insulinresistenzindex, Triglyzeride, Cholesterin, HDL-C und LDL-C als abhängige Variablen und Appetit als unabhängige Variable in die Regressionsanalyse einbezogen. Die Appetitzunahme war mit Veränderungen von Gewicht (β = 0,67, p = 0,0003), BMI (β = 0,63, p = 0,0004), Insulin (β = 0,49, p = 0,019), Insulinresistenzindex (β = 0,51, p = 0,0149) und LDL-C (β = 0.61, p = 0,0035) (ergänzende Tabelle 7).
Signifikante Verbesserungen der klinischen Symptome von der Basislinie bis zum Endpunkt (bewertet durch PANSS, p < 0,001) wurden nach der Behandlung mit Olanzapin beobachtet. Es wurde kein signifikanter Unterschied in der PANSS zwischen den Gruppen mit gesteigertem Appetit und unverändertem Appetit beobachtet (p > 0,05).
Nebenwirkungen
Unter den 31 Patienten, die die Studie abschlossen, berichteten neun (29.0%) Patienten berichteten über Hypoaktivität, acht (25,8%) Patienten über Somnolenz, vier (12,9%) Patienten hatten abnorme Lebertests, zwei (6,5%) Patienten berichteten über Akathisie, vier (12,9%) Patienten hatten Verstopfung, ein (3.Zwei (6,5 %) Patienten berichteten über Akathisie, vier (12,9 %) Patienten über Verstopfung, einer (3,5 %) über Durchfall und zwei (6,5 %) über Schwindel. 80,6 % (25/31) der Patienten nahmen während des Studienzeitraums um mehr als 7 % an Körpergewicht zu.
Diskussion
In dieser prospektiven Studie zeigten die wichtigsten Ergebnisse, dass 77,4 % der Patienten nach der Olanzapin-Behandlung ihren Appetit steigerten, und diese Patienten, die ihren Appetit steigerten, nahmen mehr Gewicht zu als die Patienten mit unverändertem Appetit (9,1 kg vs. 3,9 kg). Ebenso steigerten mehr Patienten in der Gruppe mit gesteigertem Appetit ihr ursprüngliches Körpergewicht um mehr als 7 oder 10 %, was darauf hindeutet, dass gesteigerter Appetit mit einer erheblichen Gewichtszunahme bei medikamentös nicht vorbehandelten Patienten mit Schizophrenie in der ersten Episode, die mit Olanzapin behandelt werden, verbunden ist. Darüber hinaus bestätigte die lineare Regressionsanalyse, dass die Appetitsteigerung eng mit der olanzapininduzierten Gewichtszunahme zusammenhing. Diese Ergebnisse standen im Einklang mit früheren Berichten (Gothelf et al., 2002; Cope et al., 2005). Murashita et al. (2005) beobachteten bei Schizophreniepatienten, die mit Olanzapin behandelt wurden, erhöhte appetitanregende Ghrelinspiegel und einen erhöhten Körperfettanteil. Die Ergebnisse einer randomisierten Doppelblindstudie deuten darauf hin, dass Olanzapin in stärkerem Maße als Clozapin das Verlangen nach Essen und Essanfälle auslöst (Murashita et al., 2005; Kluge et al., 2007). Ähnliche Ergebnisse wurden auch bei mit Olanzapin behandelten Mäusen berichtet (Cope et al., 2005). Die Wirkung von Olanzapin auf mehrere Rezeptorstellen, insbesondere die D2 und 5H3-Rezeptoren, die den Appetit modulieren, wurde auch bei der Behandlung von Anorexia nervosa und Chemotherapie-induzierter Übelkeit und Erbrechen eingesetzt (Kluge et al., 2007; Tan et al., 2009; Kafantaris et al., 2011).
Wir fanden auch heraus, dass 70,8 % der Patienten ihren Appetit innerhalb der ersten vier Wochen der anfänglichen Olanzapin-Behandlung steigerten, wobei der durchschnittliche Zeitraum bis zur Steigerung 20,3 Tage betrug. Einige Patienten steigerten ihren Appetit sogar schon am dritten Tag nach der Olanzapin-Behandlung. Interessant ist, dass Patienten, deren Appetit zu einem früheren Zeitpunkt zunahm, wahrscheinlich mehr Gewicht zulegten als Patienten, deren Appetit zu einem späteren Zeitpunkt zunahm, und dass die Gewichtszunahme einen Monat nach Auftreten des gesteigerten Appetits ihren Höhepunkt erreichte. Obwohl kein signifikanter Unterschied zwischen männlichen und weiblichen Patienten in Bezug auf den Olanzapin-induzierten Appetit festgestellt wurde, nahmen weibliche Patienten eher zu (P < 0,001). Daher sollte der Appetit als Indikator für die Vorhersage einer olanzapininduzierten Gewichtszunahme betrachtet werden, insbesondere bei weiblichen Patienten. In der klinischen Praxis sollten Ärzte Patienten, deren Appetit früh nach der Olanzapin-Behandlung zunimmt, mehr Aufmerksamkeit schenken und einen Plan zur Gewichtsvermeidung aufstellen.
Olanzapin-behandelte Patienten wiesen eine Zunahme von mehr als 7 % des ursprünglichen Körpergewichts auf, was mit früheren Ergebnissen übereinstimmt (Gothelf et al., 2002; Wu et al., 2008). Zusätzlich zur signifikanten Gewichtszunahme wiesen die mit Olanzapin behandelten Patienten nach 12 Wochen einen signifikant gestörten Glukose- und Lipidstoffwechsel auf, was mit zuvor veröffentlichten Beobachtungen bei Patienten mit Schizophrenie übereinstimmt (Correll et al., 2011). Im Vergleich zu Patienten in der Gruppe mit unverändertem Appetit wies die Gruppe mit gesteigertem Appetit signifikante Lipidanomalien auf. Der Nüchternblutzucker unterschied sich nicht signifikant zwischen den beiden Gruppen. Teilnehmer mit frühem gesteigertem Appetit wiesen in den folgenden Monaten nach dem gesteigerten Appetit keine erhöhte Insulin-Geschwindigkeit und keinen erhöhten Insulinresistenzindex auf. Es ist möglich, dass die Glukosewerte unabhängig von der Gewichtszunahme sind, da der Appetit die Glukosewerte nicht beeinflusste.
Nachteilige körperliche Gesundheitsfolgen im Zusammenhang mit Antipsychotika, wie Gewichtszunahme, Stoffwechselstörungen und damit verbundene Morbidität, sind seit langem bekannt (Wu et al., 2016). Frühere Studien legten nahe, dass der Appetit eine Vorhersage für eine Olanzapin-induzierte Gewichtszunahme und nachteilige Stoffwechseleffekte sein kann (Gothelf et al., 2002; Poyurovsky et al., 2007; Fountaine et al., 2010). Unseres Wissens ist dies die erste Studie, die den Zusammenhang zwischen Appetit, Gewichtszunahme und Stoffwechselstörungen nach einer Olanzapin-Behandlung bei medikamentös nicht vorbehandelten Patienten mit Schizophrenie in der ersten Episode untersucht. Einige Ergebnisse geben uns mehr Anhaltspunkte für eine vernünftige Auswahl der Medikation in der klinischen Arbeit und mehr Nutzen für die Verhinderung von Olanzapin-induzierter Gewichtszunahme und Stoffwechselstörungen.
Unsere Studie weist mehrere Einschränkungen auf. Erstens wurde in dieser Studie die Nahrungsaufnahme wie Mahlzeiten und Zwischenmahlzeiten nicht gemessen, obwohl alle eingeschlossenen Patienten denselben standardisierten Speiseplan erhielten. Eine hohe Fett- und Fruktosezufuhr kann die Appetitkontrolle durch Beeinträchtigung der zentralen Appetitregulation verringern. In der Tat haben Diäten mit hohem Fruktosegehalt negative Auswirkungen auf die zentrale Appetitsignalisierung und die kognitive Funktion (Lowette et al., 2015; Dalvi et al., 2017). Zweitens haben wir die Leptin- und Ghrelinspiegel während des Studienzeitraums nicht untersucht. Leptin und Ghrelin, die aus dem Fettgewebe bzw. dem Magen sezerniert werden, spielen eine entscheidende Rolle bei der Regulierung der Nahrungsaufnahme und des Energiestoffwechsels (Cui et al., 2017). In mehreren Studien wurde in den ersten Wochen nach Beginn einer Olanzapin-Therapie ein Anstieg des Leptinspiegels und ein Rückgang des Ghrelinspiegels festgestellt (Basoglu et al., 2010; Stip et al., 2012; Lu et al., 2015). Der Anstieg des Leptinspiegels bleibt über mehrere Wochen stabil, der Ghrelinspiegel steigt jedoch über einen längeren Zeitraum an (Sentissi et al., 2008). Weitere Forschungen sollten die Reaktionen von Leptin und Ghrelin auf den Appetitanstieg sowie ihre Beziehungen zu Stoffwechselparametern und klinischen Auswirkungen überwachen. Darüber hinaus haben wir das Aktivitätsniveau während des Studienzeitraums nicht überwacht. In einigen Studien wurde zwar berichtet, dass Olanzapin das Körpergewicht ausschließlich durch eine Steigerung des Appetits und der Nahrungsaufnahme erhöht, ohne dass es zu signifikanten Unterschieden im Ruheenergieverbrauch kommt (Gothelf et al., 2002; Fountaine et al., 2010). In einer Reihe von Studien wurde über reduzierte körperliche Aktivitäten unter Olanzapin-Medikation berichtet (Perez-Cruzado et al., 2018). In unserer Studie berichteten 29,0 % der Patienten über Hypoaktivität und 25,8 % der Patienten über Somnolenz während des 12-wöchigen Olanzapin-Behandlungszeitraums. Hillebrand et al. (2005) fanden heraus, dass eine Olanzapin-Behandlung die körperliche Aktivität bei Ratten, die einer aktivitätsbasierten Anorexie ausgesetzt waren, reduzierte. Die Behandlung mit Olanzapin verringerte auch das Aktivitätsniveau von Patientinnen mit Anorexia nervosa, ohne dass es zu signifikanten Unterschieden beim Körpergewicht und den Leptinwerten im Plasma im Vergleich zu unbehandelten Patientinnen kam. Unsere frühere Studie hat gezeigt, dass Lebensstilinterventionen, die psychoedukative, diätetische und sportliche Programme umfassen, die durch Antipsychotika verursachte Gewichtszunahme reduzieren können (Wu et al., 2008). Darüber hinaus wäre es besser, mehr Patienten mit gesunden Kontrollpersonen ähnlichen Alters zu vergleichen, um zu klären, ob die durch Olanzapin induzierte Appetitsteigerung und die metabolischen Veränderungen spezifisch mit seinen pharmakologischen Eigenschaften zusammenhängen. Weitere Studien sollten sich auf die Mechanismen der Appetitsteigerung nach einer Olanzapinbehandlung konzentrieren (Koopmann et al., 2012; Sweeney et al., 2017; Mancuso et al., 2019). Das Belohnungssystem in striatalen Regionen kann mit der antipsychotisch bedingten Gewichtszunahme in Verbindung gebracht werden (Nielsen et al., 2016). Eine veränderte Aktivität im subgenualen anterioren cingulären Kortex könnte ebenfalls teilweise für den erhöhten Appetit nach einer Olanzapin-Behandlung verantwortlich sein (Pawlowski et al., 2018). Bildgebende Studien sollten durchgeführt werden, um die Modulation der mit dem Appetit zusammenhängenden tiefen Hirnaktivität durch Olanzapin zu untersuchen.
Schlussfolgerungen
Zusammenfassend hat unsere Studie gezeigt, dass der Appetit mit der Olanzapin-induzierten Gewichtszunahme und der Dyslipidämie bei medikamentös nicht vorbehandelten Patienten mit Schizophrenie in der ersten Episode zusammenhängt. Die Bewertung von Appetitveränderungen ist eine einfache und praktische Methode zur Vorhersage der Gewichtszunahme, die den Ärzten mehr Zeit und Optionen für Interventionsstrategien bietet. Frühzeitige Ernährungserfindungen, die darauf abzielen, den Appetit zu verringern und die Nahrungsaufnahme zu reduzieren, können für die Gewichtskontrolle bei Schizophreniepatienten, die mit Olanzapin behandelt werden, hilfreich sein.
Data Availability Statement
Die für diese Studie generierten Datensätze sind auf Anfrage beim entsprechenden Autor erhältlich.
Ethikerklärung
Diese Studie wurde in Übereinstimmung mit der Deklaration von Helsinki (G.A.o.t.W.M. Association, 2013) durchgeführt und von der Ethikkommission des zweiten Xiangya-Krankenhauses der Central South University genehmigt. Nach einer vollständigen Beschreibung der Studie für die Teilnehmer wurde vor der Studienteilnahme eine informierte Zustimmung eingeholt.
Beiträge der Autoren
JH analysierte und interpretierte die Patientendaten und war maßgeblich an der Erstellung des Manuskripts beteiligt. G-RH konzipierte und führte die Studie hauptsächlich durch. YeY, C-CL, J-MX, Y-JL und X-JP halfen bei der Patientenrekrutierung, der Überwachung der Datenqualität und der Dokumentation von unerwünschten Ereignissen bei der Behandlung. YiY half bei der Überarbeitung des Manuskripts. J-PZ leitete das Studiendesign. RR-W war für den Gesamtinhalt verantwortlich. Alle Autoren lasen und genehmigten das endgültige Manuskript.
Finanzierung
Diese Arbeit wurde von den Key R&D Program Projects, National Science Foundation of China (Grant No.2016YFC1306900) und der National Nature Science Foundation of China (Grant No.81622018 und Nr. 81901401).
Interessenkonflikt
Die Autoren erklären, dass die Forschung in Abwesenheit jeglicher kommerzieller oder finanzieller Beziehungen durchgeführt wurde, die als potenzieller Interessenkonflikt ausgelegt werden könnten.
Danksagungen
Wir möchten uns für den wertvollen Beitrag der Teilnehmer und die Unterstützung durch ihre Hausärzte bedanken. Wir möchten auch mehreren anonymen Gutachtern für ihre wertvollen Kommentare und Vorschläge zur Verbesserung der Qualität der Arbeit danken.
Ergänzendes Material
Das ergänzende Material zu diesem Artikel finden Sie online unter: https://www.frontiersin.org/articles/10.3389/fphar.2020.00739/full#supplementary-material
Ergänzendes Material Abbildung 1 | Geschwindigkeit der Blutzucker- und Lipidveränderungen in der Gruppe mit erhöhtem Appetit. Die mittleren Veränderungswerte für jeden Patienten pro Monat während des Studienzeitraums wurden zu vier Zeitpunkten analysiert: vor dem Monat der Zeit des gesteigerten Appetits (-1M), dem Monat der Zeit des gesteigerten Appetits (0M), 1 Monat nach dem Monat der Zeit des gesteigerten Appetits (+1M) und 2 Monate nach dem Monat der Zeit des gesteigerten Appetits (+2M).
Ergänzende Abbildung 2 | Vergleich der Veränderungsgeschwindigkeiten des Insulin- und Insulinresistenzindexes von Teilnehmern mit gesteigertem Appetit in verschiedenen Monaten. Wir verglichen die Geschwindigkeit der Teilnehmer mit erhöhtem Appetit innerhalb von 4 Wochen (A) und der Teilnehmer mit erhöhtem Appetit zwischen 4-8 Wochen (B) im Monat der Zeit bis zum erhöhten Appetit (0M) und 1 Monat nach dem Monat der Zeit bis zum erhöhten Appetit (+1M).
Ergänzungstabelle 1 | Anzahl der Patienten, die in den Wochen 4, 8 und 12 ihr ursprüngliches Körpergewicht um mehr als 7 % oder 10 % erhöht hatten.
Ergänzungstabelle 2 | Anzahl der Patienten, die in den Wochen 4, 8 und 12 bei Patienten mit gesteigertem Appetit ihr ursprüngliches Körpergewicht um mehr als 7 % oder 10 % erhöht hatten.
Ergänzungstabelle 3 | Anzahl der Patienten, die in den Wochen 4, 8 und 12 bei Patienten mit unverändertem Appetit ihr ursprüngliches Körpergewicht um mehr als 7 % oder 10 % erhöht hatten.
Ergänzungstabelle 4 | Vergleich der Anzahl der Gewichtszunahmen von 7 % oder 10 % zwischen Patienten mit gesteigertem Appetit und Patienten mit unverändertem Appetit in den Wochen 4, 8 und 12.
Ergänzungstabelle 5 | Die Analyse der Geschwindigkeit der mittleren Gewichtszunahme, des Blutzuckers und der Lipidveränderungen in der Gruppe mit gesteigertem Appetit zu vier Zeitpunkten: vor dem Monat der Zeit bis zur Appetitsteigerung (-1M), dem Monat der Zeit bis zur Appetitsteigerung (0M), 1 Monat nach dem Monat der Zeit bis zur Appetitsteigerung (+1M) und 2 Monate nach dem Monat der Zeit bis zur Appetitsteigerung (+2M). ns bedeutet nicht signifikant, * bedeutet p-Wert < 0,05, ** bedeutet p-Wert < 0,01, *** bedeutet p-Wert < 0,001.
Ergänzung Tabelle 6 | Schätzungen der Auswirkungen des Appetits auf die Gewichtszunahme und stoffwechselbedingte Ergebnismaße aus dem allgemeinen linearen gemischten Modell unter Kontrolle für Alter, Krankheitsdauer und Geschlecht.
Ergänzungstabelle 7-1 | Die Veränderungen von Gewicht, BMI, Insulin, IRI und LDL-C pro Patient während des Behandlungszeitraums in den verschiedenen Gruppen.
Ergänzungstabelle 7-2 | Schätzungen der Appetit-Effekte auf die Gewichtszunahme und stoffwechselbezogene Ergebnismessungen.
Abkürzungen
SGAs, Antipsychotika der zweiten Generation; RCT, Randomisierte klinische Studie; CAFÉ, The Comparison of Atypicals for First Episode; CATIE, The Clinical Antipsychotic Trials in Intervention Effectiveness; DSM-5, The Diagnostic and Statistical Manual of Mental Disorders-Fifth Edition; EKG, Elektrokardiogramm; PANSS, The Positive and Negative Syndrome Scale; TESS, Treatment Emergent Symptom Scale; ELISA, Enzyme-linked Immunosorbent Assays; BMI, Body Mass Index; HDL-C, High-density Lipoprotein; LDL-C, Low-density Lipoprotein.
Allison, D. B., Mentore, J. L., Heo, M., Chandler, L. P., Cappelleri, J. C., Infante, M. C., et al. (1999). Antipsychotika-induzierte Gewichtszunahme: eine umfassende Forschungssynthese. Am. J. Psychiatry 156, 1686-1696. doi: 10.1176/ajp.156.11.1686
PubMed Abstract | CrossRef Full Text | Google Scholar
Association, A.P. (2013). Diagnostic and statistical manual of mental disorders (DSM-5®) (Arlington, VA: American Psychiatric Pub).
Google Scholar
Basoglu, C., Oner, O., Gunes, C., Semiz, U. B., Ates, A. M., Algul, A., et al. (2010). ghrelin, cholecystokinin, visfatin, leptin and agouti-related protein levels during 6-week olanzapine treatment in first-episode male patients with psychosis. Int. Clin. Psychopharmacol. 25, 165-171. doi: 10.1097/YIC.0b013e3283377850
PubMed Abstract | CrossRef Full Text | Google Scholar
Case, M., Treuer, T., Karagianis, J., Hoffmann, V. P. (2010). Die mögliche Rolle des Appetits bei der Vorhersage von Gewichtsveränderungen während der Behandlung mit Olanzapin. BMC Psychiatry 10, 72. doi: 10.1186/1471-244X-10-72
PubMed Abstract | CrossRef Full Text | Google Scholar
Cope, M., Nagy, T., Fernandez, J., Geary, N., Casey, D., Allison, D. (2005). Antipsychotika-induzierte Gewichtszunahme: Entwicklung eines Tiermodells. Int. J. Obes. 29, 607. doi: 10.1038/sj.ijo.0802928
CrossRef Full Text | Google Scholar
Correll, C. U., Manu, P., Olshanskiy, V., Napolitano, B., Kane, J. M., Malhotra, A. K. (2009). Kardiometabolisches Risiko von antipsychotischen Medikamenten der zweiten Generation bei der erstmaligen Anwendung bei Kindern und Jugendlichen. Jama 302, 1765-1773. doi: 10.1001/jama.2009.1549
PubMed Abstract | CrossRef Full Text | Google Scholar
Correll, C. U., Lencz, T., Malhotra, A. K. (2011). Antipsychotische Medikamente und Fettleibigkeit. Trends Mol. Med. 17, 97-107. doi: 10.1016/j.molmed.2010.10.010
PubMed Abstract | CrossRef Full Text | Google Scholar
Cui, H., Lopez, M., Rahmouni, K. (2017). Die zellulären und molekularen Grundlagen der Leptin- und Ghrelinresistenz bei Adipositas. Nat. Rev. Endocrinol. 13, 338-351. doi: 10.1038/nrendo.2016.222
PubMed Abstract | CrossRef Full Text | Google Scholar
Dalvi, P. S., Chalmers, J. A., Luo, V., Han, D. Y., Wellhauser, L., Liu, Y., et al. (2017). Hohes Fett induziert akute und chronische Entzündungen im Hypothalamus: Wirkung von fettreicher Ernährung, Palmitat und TNF-alpha auf appetitregulierende NPY-Neuronen. Int. J. Obes. (Lond) 41, 149-158. doi: 10.1038/ijo.2016.183
PubMed Abstract |Ref Full Text | Google Scholar
Das-Munshi, J., Chang, C.-K., Dutta, R., Morgan, C., Nazroo, J., Stewart, R., et al. (2017). Ethnizität und Übersterblichkeit bei schweren psychischen Erkrankungen: eine Kohortenstudie. Lancet Psychiatry 4, 389-399. doi: 10.1016/S2215-0366(17)30097-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Fekadu, A., Medhin, G., Kebede, D., Alem, A., Cleare, A. J., Prince, M., et al. (2015). Übermäßige Sterblichkeit bei schweren psychischen Erkrankungen: 10-jährige bevölkerungsbasierte Kohortenstudie im ländlichen Äthiopien. Br. J. Psychiatry 206, 289-296. doi: 10.1192/bjp.bp.114.149112
PubMed Abstract | CrossRef Full Text | Google Scholar
Fountaine, R. J., Taylor, A. E., Mancuso, J. P., Greenway, F. L., Byerley, L. O., Smith, S. R., et al. (2010). Erhöhte Nahrungsaufnahme und Energieverbrauch nach Verabreichung von Olanzapin an gesunde Männer. Obesity 18, 1646-1651. doi: 10.1038/oby.2010.6
PubMed Abstract | CrossRef Full Text | Google Scholar
G.A.o.t.W.M. Association (2013). Deklaration von Helsinki des Weltärztebundes: Ethische Grundsätze für die medizinische Forschung am Menschen. JAMA 10 (20) 2191-2194. doi: 10.1001/jama.2013.281053
CrossRef Full Text | Google Scholar
Gothelf, D., Falk, B., Singer, P., Kairi, M., Phillip, M., Zigel, L., et al. (2002). Gewichtszunahme in Verbindung mit erhöhter Nahrungsaufnahme und geringem gewohnheitsmäßigen Aktivitätsniveau bei männlichen jugendlichen schizophrenen Patienten, die mit Olanzapin behandelt werden. Am. J. Psychiatry 159, 1055-1057. doi: 10.1176/appi.ajp.159.6.1055
PubMed Abstract | CrossRef Full Text | Google Scholar
Henderson, D. C., Vincenzi, B., Andrea, N. V., Ulloa, M., Copeland, P. M. (2015). Pathophysiologische Mechanismen des erhöhten kardiometabolischen Risikos bei Menschen mit Schizophrenie und anderen schweren psychischen Erkrankungen. Lancet Psychiatry 2, 452-464. doi: 10.1016/S2215-0366(15)00115-7
PubMed Abstract | CrossRef Full Text | Google Scholar
Hillebrand, J. J., van Elburg, A. A., Kas, M. J., van Engeland, H., Adan, R. A. (2005). Olanzapin reduziert die körperliche Aktivität bei Ratten, die einer aktivitätsbasierten Anorexie ausgesetzt sind: mögliche Auswirkungen auf die Behandlung von Anorexia nervosa? Biol. Psychiatry 58, 651-657.
PubMed Abstract | Google Scholar
Hu, D.-Y. (2017). Neue Leitlinien und Evidenz zur Prävention und Behandlung von Dyslipidämie und atherosklerotischen Herz-Kreislauf-Erkrankungen in China. Chronic Dis. Trans. Med. 3, 73. doi: 10.1016/j.cdtm.2016.11.001
CrossRef Full Text | Google Scholar
Huhn, M., Nikolakopoulou, A., Schneider-Thoma, J., Krause, M., Samara, M., Peter, N., et al. (2019). Vergleichende Wirksamkeit und Verträglichkeit von 32 oralen Antipsychotika für die Akutbehandlung von Erwachsenen mit Schizophrenie in mehreren Episoden: eine systematische Übersichtsarbeit und Netzwerk-Meta-Analyse. Lancet 394 (10202), 939-951. doi: 10.1016/S0140-6736(19)31135-3
PubMed Abstract | CrossRef Full Text | Google Scholar
Kafantaris, V., Leigh, E., Hertz, S., Berest, A., Schebendach, J., Sterling, W. M., et al. (2011). Eine placebokontrollierte Pilotstudie mit Olanzapin als Zusatztherapie für Jugendliche mit Anorexia nervosa. J. Child Adolesc. Psychopharmacol. 21, 207-212. doi: 10.1089/cap.2010.0139
PubMed Abstract | CrossRef Full Text | Google Scholar
Kanders, B., Forse, R., Blackburn, G. (1991). Methods in obesity. Conn „s Current Therapy. Ed. Rakel, R. E. (Philadelphia: WB Saunders), 524-532.
Google Scholar
Kluge, M., Schuld, A., Himmerich, H., Dalal, M., Schacht, A., Wehmeier, P. M., et al. (2007). Clozapin und Olanzapin werden mit Esssucht und Essanfällen in Verbindung gebracht: Ergebnisse einer randomisierten Doppelblindstudie. J. Clin. Psychopharmacol. 27, 662-666. doi: 10.1097/jcp.0b013e31815a8872
PubMed Abstract | CrossRef Full Text | Google Scholar
Koopmann, A., von der Goltz, C., Grosshans, M., Dinter, C., Vitale, M., Wiedemann, K., et al. (2012). Der Zusammenhang zwischen dem appetitanregenden Peptid acetyliertes Ghrelin und dem Verlangen nach Alkohol bei früh abstinenten Alkoholabhängigen. Psychoneuroendocrinology 37, 980-986. doi: 10.1016/j.psyneuen.2011.11.005
PubMed Abstract | CrossRef Full Text | Google Scholar
Leucht, S., Corves, C., Arbter, D., Engel, R. R., Li, C., Davis, J. M. (2009). Antipsychotika der zweiten Generation im Vergleich zur ersten Generation bei Schizophrenie: eine Meta-Analyse. Lancet 373, 31-41. doi: 10.1016/S0140-6736(08)61764-X
PubMed Abstract | CrossRef Full Text | Google Scholar
Leucht, S., Cipriani, A., Spineli, L., Mavridis, D., Orey, D., Richter, F., et al. (2013). Vergleichende Wirksamkeit und Verträglichkeit von 15 Antipsychotika bei Schizophrenie: eine Meta-Analyse mit mehreren Behandlungen. Lancet 382, 951-962. doi: 10.1016/S0140-6736(13)60733-3
PubMed Abstract | CrossRef Full Text | Google Scholar
Lieberman, J. A., Stroup, T. S., McEvoy, J. P., Swartz, M. S., Rosenheck, R. A., Perkins, D. O., et al. (2005). Wirksamkeit von Antipsychotika bei Patienten mit chronischer Schizophrenie. New Engl. J. Med. 353, 1209-1223. doi: 10.1056/NEJMoa051688
CrossRef Full Text | Google Scholar
Lowette, K., Roosen, L., Tack, J., Vanden Berghe, P. (2015). Auswirkungen einer fruktosereichen Ernährung auf die zentrale Appetitsignalisierung und die kognitive Funktion. Front. Nutr. 2, 5. doi: 10.3389/fnut.2015.00005
PubMed Abstract | CrossRef Full Text | Google Scholar
Lu, M. L., Wang, T. N., Lin, T. Y., Shao, W. C., Chang, S. H., Chou, J. Y., et al. (2015). Unterschiedliche Auswirkungen von Olanzapin und Clozapin auf die Plasmaspiegel von Adipozytokinen und Gesamtghrelin. Prog. Neuropsychopharmacol. Biol. Psychiatry 58, 47-50.
PubMed Abstract | Google Scholar
Mancuso, C., Izquierdo, A., Slattery, M., Becker, K. R., Plessow, F., Thomas, J. J., et al. (2019). Veränderungen in appetitregulierenden Hormonen nach der Nahrungsaufnahme sind mit Veränderungen des berichteten Appetits und einem Maß für hedonistisches Essen bei Mädchen und jungen Frauen mit Anorexia nervosa verbunden. Psychoneuroendocrinology 113, 104556. doi: 10.1016/j.psyneuen.2019.104556
PubMed Abstract | CrossRef Full Text | Google Scholar
McEvoy, J. P., Lieberman, J. A., Perkins, D. O., Hamer, R. M., Gu, H., Lazarus, A., et al. (2007). Wirksamkeit und Verträglichkeit von Olanzapin, Quetiapin und Risperidon bei der Behandlung der frühen Psychose: ein randomisierter, doppelblinder Vergleich über 52 Wochen. Am. J. Psychiatry 164, 1050-1060. doi: 10.1176/ajp.2007.164.7.1050
PubMed Abstract | CrossRef Full Text | Google Scholar
Murashita, M., Kusumi, I., Inoue, T., Takahashi, Y., Hosoda, H., Kangawa, K., et al. (2005). Olanzapin erhöht den Ghrelin-Plasmaspiegel bei Patienten mit Schizophrenie. Psychoneuroendocrinology 30, 106-110. doi: 10.1016/j.psyneuen.2004.05.008
PubMed Abstract | CrossRef Full Text | Google Scholar
Newcomer, J. W. (2006). Medizinisches Risiko bei Patienten mit bipolarer Störung und Schizophrenie. J. Clin. Psychiatry 67, e16. doi: 10.4088/JCP.1106e16
PubMed Abstract | CrossRef Full Text | Google Scholar
Nielsen, M. Ø., Rostrup, E., Wulff, S., Glenthøj, B., Ebdrup, B. H. (2016). Striatale Belohnungsaktivität und Antipsychotika-assoziierte Gewichtsveränderung bei Patienten mit Schizophrenie in der Erstbehandlung. JAMA Psychiatry 73, 121-128. doi: 10.1001/jamapsychiatry.2015.2582
PubMed Abstract | CrossRef Full Text | Google Scholar
Pawlowski, M., Abshir-Ahmed, Y., Beitinger, P., Steiger, A. (2018). S241. Untersuchung des Mechanismus des gesteigerten Appetits nach Olanzapin durch sLORETA während des Schlafs. Biol. Psychiatry 83, S441-S442.
Google Scholar
Perez-Cruzado, D., Cuesta-Vargas, A., Vera-Garcia, E., Mayoral-Cleries, F. (2018). Medikation und körperliche Aktivität und körperliche Fitness bei schweren psychischen Erkrankungen. Psychiatry Res. 267, 19-24. doi: 10.1016/j.psychres.2018.05.055
PubMed Abstract | CrossRef Full Text | Google Scholar
Poyurovsky, M., Fuchs, C., Pashinian, A., Levi, A., Faragian, S., Maayan, R., et al. (2007). Abschwächende Wirkung von Reboxetin auf Appetit und Gewichtszunahme bei mit Olanzapin behandelten Schizophrenie-Patienten: eine doppelblinde placebokontrollierte Studie. Psychopharmacology 192, 441-448. doi: 10.1007/s00213-007-0731-1
PubMed Abstract | CrossRef Full Text | Google Scholar
Roerig, J. L., Mitchell, J. E., de Zwaan, M., Crosby, R. D., Gosnell, B. A., Steffen, K. J., et al. (2005). Ein Vergleich der Auswirkungen von Olanzapin und Risperidon gegenüber Placebo auf das Essverhalten. J. Clin. Psychopharmacol. 25, 413-418. doi: 10.1097/01.jcp.0000177549.36585.29
PubMed Abstract | CrossRef Full Text | Google Scholar
Sentissi, O., Epelbaum, J., Olie, J. P., Poirier, M. F. (2008). Leptin- und Ghrelinspiegel bei Patienten mit Schizophrenie während der Behandlung mit verschiedenen Antipsychotika: eine Übersicht. Schizophr. Bull. 34, 1189-1199. doi: 10.1093/schbul/sbm141
PubMed Abstract | CrossRef Full Text | Google Scholar
Stip, E., Lungu, O. V., Anselmo, K., Letourneau, G., Mendrek, A., Stip, B., et al. (2012). Neuronale Veränderungen im Zusammenhang mit der Verarbeitung von Appetitinformationen bei schizophrenen Patienten nach 16 Wochen Olanzapin-Behandlung. Transl. Psychiatry 2, e128. doi: 10.1038/tp.2012.53
PubMed Abstract | CrossRef Full Text | Google Scholar
Sweeney, P., Li, C., Yang, Y. (2017). Appetitunterdrückende Rolle von medialen septalen glutamatergen Neuronen. Proc. Natl. Acad. Sci. 114, 13816-13821. doi: 10.1073/pnas.1707228114
CrossRef Full Text | Google Scholar
Tan, L., Liu, J., Liu, X., Chen, J., Yan, Z., Yang, H., et al. (2009). Klinische Forschung zu Olanzapin zur Vorbeugung von Chemotherapie-induzierter Übelkeit und Erbrechen. J. Exp. Clin. Cancer Res. 28, 131. doi: 10.1186/1756-9966-28-131
PubMed Abstract | CrossRef Full Text | Google Scholar
Wu, R.-R., Zhao, J.-P., Jin, H., Shao, P., Fang, M.-S., Guo, X.-F., et al. (2008). Lebensstilintervention und Metformin zur Behandlung der durch Antipsychotika verursachten Gewichtszunahme: eine randomisierte kontrollierte Studie. Jama 299, 185-193. doi: 10.1001/jama.2007.56-b
PubMed Abstract | CrossRef Full Text | Google Scholar
Wu, R., Zhang, F., Gao, K., Ou, J., Shao, P., Jin, H., et al. (2016). Metformin-Behandlung von Antipsychotika-induzierter Dyslipidämie: eine Analyse von zwei randomisierten, placebokontrollierten Studien. Mol. Psychiatry 21, 1537. doi: 10.1038/mp.2015.221
PubMed Abstract | CrossRef Full Text | Google Scholar




