Polyester
Die Synthese von Polyestern wird im Allgemeinen durch eine Polykondensationsreaktion erreicht. Die allgemeine Gleichung für die Reaktion eines Diols mit einer Disäure lautet:
(n+1) R(OH)2 + n R'(COOH)2 → HOnROH + 2n H2O.
Polyester können durch eine Vielzahl von Reaktionen erhalten werden, von denen die wichtigsten die Reaktion von Säuren und Alkoholen, die Alkoholyse und/oder die Acidolyse von niedermolekularen Estern oder die Alkoholyse von Acylchloriden sind. Die folgende Abbildung gibt einen Überblick über solche typischen Polykondensationsreaktionen für die Polyesterherstellung. Darüber hinaus sind Polyester über die Ringöffnungspolymerisation zugänglich.

Azeotrope VeresterungBearbeiten
Bei diesem klassischen Verfahren reagieren ein Alkohol und eine Carbonsäure zu einem Carbonsäureester.Zum Aufbau eines Polymers muss das bei der Reaktion gebildete Wasser kontinuierlich durch Azeotropdestillation entfernt werden.
SchmelzveresterungBearbeiten
Wenn die Schmelzpunkte der Monomere ausreichend niedrig sind, kann ein Polyester durch direkte Veresterung gebildet werden, wobei das Reaktionswasser durch Vakuum entfernt wird.
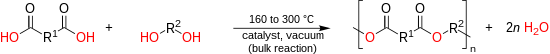
Die direkte Massenpolyesterifikation bei hohen Temperaturen (150 – 290 °C) ist gut geeignet und wird im industriellen Maßstab zur Herstellung von aliphatischen Polyestern, ungesättigten Polyestern und aromatisch-aliphatischen Polyestern verwendet. Monomere, die phenolische oder tertiäre Hydroxylgruppen enthalten, weisen eine geringe Reaktivität mit Carbonsäuren auf und können nicht über die direkte saure alkoholische Polyesterifizierung polymerisiert werden. Im Falle der PET-Herstellung hat das direkte Verfahren jedoch mehrere Vorteile, insbesondere eine höhere Reaktionsgeschwindigkeit, ein höheres erreichbares Molekulargewicht, die Freisetzung von Wasser anstelle von Methanol und geringere Lagerkosten der Säure im Vergleich zum Ester aufgrund des geringeren Gewichts.
Alkoholische UmesterungEdit

Umesterung: Ein alkoholterminiertes Oligomer und ein esterterminiertes Oligomer kondensieren zu einer Esterbindung, wobei ein Alkohol verloren geht. R und R‘ sind die beiden Oligomerketten, R“ ist eine Opfereinheit wie z. B. eine Methylgruppe (Methanol ist das Nebenprodukt der Veresterungsreaktion).
Der Begriff Umesterung wird in der Regel zur Beschreibung von Hydroxy-Ester-, Carboxy-Ester- und Ester-Ester-Austauschreaktionen verwendet. Die Hydroxy-Ester-Austauschreaktion weist die höchste Reaktionsgeschwindigkeit auf und wird für die Herstellung zahlreicher aromatisch-aliphatischer und vollaromatischer Polyester verwendet. Die auf Umesterung basierende Synthese ist besonders nützlich, wenn hochschmelzende und schwer lösliche Dicarbonsäuren verwendet werden. Außerdem sind Alkohole als Kondensationsprodukt flüchtiger und damit leichter zu entfernen als Wasser.
Die Hochtemperatur-Schmelzsynthese zwischen Bisphenoldiacetaten und aromatischen Dicarbonsäuren oder umgekehrt zwischen Bisphenolen und aromatischen Dicarbonsäurediphenylestern (durchgeführt bei 220 bis 320 °C unter Freisetzung von Essigsäure) ist neben der Synthese auf Acylchloridbasis der bevorzugte Weg zu vollaromatischen Polyestern.
AcylierungBearbeiten
Bei der Acylierung beginnt die Säure als Säurechlorid, so dass die Polykondensation unter Abgabe von Salzsäure (HCl) anstelle von Wasser abläuft.
Die Reaktion zwischen Diacylchloriden und Alkoholen oder phenolischen Verbindungen ist in der Polyestersynthese weit verbreitet und war Gegenstand zahlreicher Übersichtsarbeiten und Buchkapitel. Die Reaktion wird bei niedrigeren Temperaturen als bei den Gleichgewichtsmethoden durchgeführt; mögliche Varianten sind die Hochtemperatur-Lösungskondensation, aminkatalysierte und Grenzflächenreaktionen. Außerdem wird die Verwendung von Aktivierungsmitteln zu den Nicht-Gleichgewichtsmethoden gezählt. Die Gleichgewichtskonstanten für die Kondensation auf Acylchloridbasis, bei der Arylate und Polyarylate entstehen, sind in der Tat sehr hoch und werden mit 4,3 × 103 bzw. 4,7 × 103 angegeben. Diese Reaktion wird daher oft als „Nicht-Gleichgewichts“-Polyesterisierung bezeichnet. Obwohl die auf Acylchlorid basierende Synthese auch Gegenstand von Berichten in der Patentliteratur ist, ist es unwahrscheinlich, dass die Reaktion im Produktionsmaßstab eingesetzt wird. Die Methode wird durch die hohen Kosten der Säuredichloride, ihre Empfindlichkeit gegenüber Hydrolyse und das Auftreten von Nebenreaktionen eingeschränkt.
Die Hochtemperaturreaktion (100 bis > 300 °C) eines Diacylchlorids mit einem Dialkohol ergibt den Polyester und Chlorwasserstoff. Bei diesen relativ hohen Temperaturen läuft die Reaktion ohne Katalysator schnell ab:

Die Umsetzung der Reaktion kann durch Titration des entstandenen Chlorwasserstoffs verfolgt werden. Es wurde eine Vielzahl von Lösungsmitteln beschrieben, darunter chlorierte Benzole (z. B. Dichlorbenzol), chlorierte Naphthaline oder Diphenyle, sowie nicht chlorierte Aromaten wie Terphenyle, Benzophenone oder Dibenzylbenzole. Die Reaktion wurde auch erfolgreich zur Herstellung von hochkristallinen und schwerlöslichen Polymeren eingesetzt, die hohe Temperaturen erfordern, um in Lösung gehalten zu werden (zumindest bis ein ausreichend hohes Molekulargewicht erreicht wurde).
Bei der Grenzflächenreaktion auf Acylchloridbasis wird der Alkohol (in der Regel ein Phenol) in Form eines Alkoxids in einer wässrigen Natriumhydroxidlösung gelöst, das Acylchlorid in einem mit Wasser nicht mischbaren organischen Lösungsmittel wie Dichlormethan, Chlorbenzol oder Hexan, die Reaktion erfolgt an der Grenzfläche unter schneller Bewegung bei Raumtemperatur.

Das Verfahren wird zur Herstellung von Polyarylaten (Polyester auf Basis von Bisphenolen), Polyamiden, Polycarbonaten, Poly(thiocarbonaten) und anderen verwendet. Da das Molekulargewicht des durch eine Hochtemperatursynthese erhaltenen Produkts durch Nebenreaktionen stark eingeschränkt werden kann, wird dieses Problem durch die milden Temperaturen der Grenzflächenpolykondensation umgangen. Das Verfahren wird bei der kommerziellen Herstellung von Polyarylaten auf Bisphenol-A-Basis wie dem U-Polymer von Unitika angewendet. Wasser kann in einigen Fällen durch ein nicht mischbares organisches Lösungsmittel ersetzt werden (z. B. im System Adiponitril/Tetrachlorkohlenstoff). Das Verfahren ist für die Herstellung von Polyestern auf der Basis aliphatischer Diole, die höhere pKa-Werte als Phenole haben und daher in wässrigen Lösungen keine Alkoholat-Ionen bilden, von geringem Nutzen. Die basenkatalysierte Reaktion eines Acylchlorids mit einem Alkohol kann auch in einer Phase unter Verwendung von tertiären Aminen (z. B. Triethylamin, Et3N) oder Pyridin als Säureakzeptoren durchgeführt werden:
Während auf Acylchlorid basierende Veresterungen bei Raumtemperatur ohne Katalysator nur sehr langsam ablaufen, beschleunigt das Amin die Reaktion auf verschiedene Weise, wobei der Mechanismus nicht vollständig verstanden ist. Es ist jedoch bekannt, dass tertiäre Amine Nebenreaktionen wie die Bildung von Ketenen und Ketendimeren verursachen können.
Silyl-Methode Bei dieser Variante der HCl-Methode, wird das Carbonsäurechlorid mit dem Trimethylsilylether der Alkoholkomponente umgesetzt und man erhält Trimethylsilylchlorid
Acetatmethode (Veresterung)Bearbeiten

Silylacetatmethode
RingöffnungspolymerisationBearbeiten

Aliphatische Polyester können unter sehr milden Bedingungen aus Lactonen aufgebaut werden, Anionisch, kationisch, metallorganisch oder enzymbasiert katalysiert Eine Reihe von katalytischen Methoden für die Copolymerisation von Epoxiden mit zyklischen Anhydriden hat kürzlich ebenfalls gezeigt, dass sie eine breite Palette von funktionalisierten Polyestern, sowohl gesättigte als auch ungesättigte, liefern. Die Ringöffnungspolymerisation von Lactonen und Lactiden wird ebenfalls im industriellen Maßstab angewandt.
Andere MethodenBearbeiten
Zahlreiche andere Reaktionen sind für die Synthese ausgewählter Polyester berichtet worden, beschränken sich jedoch auf Synthesen im Labormaßstab unter spezifischen Bedingungen, beispielsweise unter Verwendung von Dicarbonsäuresalzen und Dialkylhalogeniden oder Reaktionen zwischen Bisketenen und Diolen.
Anstelle von Acylchloriden können auch sogenannte Aktivierungsmittel verwendet werden, wie 1,1′-Carbonyldiimidazol, Dicyclohexylcarbodiimid oder Trifluoressigsäureanhydrid. Die Polykondensation erfolgt durch die in situ Umwandlung der Carbonsäure in ein reaktiveres Zwischenprodukt, während die Aktivierungsmittel verbraucht werden. Die Reaktion verläuft beispielsweise über ein N-Acylimidazol-Zwischenprodukt, das mit katalytisch wirkendem Natriumalkoxid reagiert:

Die Verwendung von Aktivierungsmitteln für die Herstellung hochschmelzender aromatischer Polyester und Polyamide unter milden Bedingungen ist seit den 1980er Jahren Gegenstand intensiver akademischer Forschung, aber die Reaktionen haben sich kommerziell nicht durchgesetzt, da ähnliche Ergebnisse mit billigeren Reaktanten erzielt werden können.
Thermodynamik von PolykondensationsreaktionenEdit
Polyesterifizierungen werden von einigen Autoren in zwei Hauptkategorien eingeteilt: a) Gleichgewichts-Polyesterifizierungen (hauptsächlich Alkohol-Säure-Reaktion, Alkohol-Ester- und Säure-Ester-Austauschreaktionen, die in Masse bei hohen Temperaturen durchgeführt werden) und b) Nicht-Gleichgewichts-Polyesterifizierungen, bei denen hochreaktive Monomere verwendet werden (z. B. Säurechloride oder aktivierte Carbonsäuren, die meist bei niedrigeren Temperaturen in Lösung durchgeführt werden).
Ein Beispiel für eine Gleichgewichtsreaktion ist die Säure-Alkohol-Polyesterisierung. Das Verhältnis zwischen der polymerbildenden Estergruppe (-C(O)O-) und dem Kondensationsprodukt Wasser (H2O) gegenüber den säurebasierten (-C(O)OH) und alkoholbasierten (-OH) Monomeren wird durch die Gleichgewichtskonstante KC beschrieben.
K C = {\displaystyle K_{C}={\frac {}{}}}

Die Gleichgewichtskonstante der säure-alkoholischen Veresterung ist typischerweise KC ≤ 10, was nicht hoch genug ist, um hochmolekulare Polymere (DPn ≥ 100) zu erhalten, da der zahlenmittlere Polymerisationsgrad (DPn) aus der Gleichgewichtskonstante KC berechnet werden kann.
D P n = K C 2 + 1 {\displaystyle DP_{n}~=~{\sqrt{K_{C}}}+1}

Bei Gleichgewichtsreaktionen ist es daher notwendig, das Kondensationsprodukt kontinuierlich und effizient aus dem Reaktionsmedium zu entfernen, um das Gleichgewicht in Richtung Polymer zu treiben. Das Kondensationsprodukt wird daher bei vermindertem Druck und hohen Temperaturen (150-320 °C, je nach Monomeren) entfernt, um die Rückreaktion zu verhindern. Mit dem Fortschreiten der Reaktion nimmt die Konzentration der aktiven Kettenenden ab und die Viskosität der Schmelze oder Lösung zu. Zur Erhöhung der Reaktionsgeschwindigkeit wird die Reaktion bei hoher Endgruppenkonzentration (vorzugsweise in der Masse) durchgeführt, was durch die erhöhten Temperaturen begünstigt wird.
Gleichgewichtskonstanten der Größenordnung KC ≥ 104 werden erreicht, wenn reaktive Reaktanten (Säurechloride oder Säureanhydride) oder Aktivierungsmittel wie 1,1′-Carbonyldiimidazol verwendet werden. Mit diesen Reaktanten können die für technische Anwendungen erforderlichen Molekulargewichte auch ohne aktive Abtrennung des Kondensationsprodukts erreicht werden.




