Definitie van golffunctie
Fundamentele deeltjes, zoals elektronen, kunnen worden beschreven als deeltjes of golven.
Elektronen kunnen worden beschreven met behulp van een golffunctie.Het symbool van de golffunctie is de Griekse letter psi, Ψ of ψ.

De golffunctie Ψ is een wiskundige uitdrukking.Zij bevat cruciale informatie over het elektron waarmee zij is geassocieerd: uit de golffunctie verkrijgen wij de energie, het impulsmoment en de baanoriëntatie van het elektron in de vorm van de kwantumgetallen n, l en ml.
De golffunctie kan een positief of negatief teken hebben.Het teken is belangrijk bij berekeningen.Het is ook belangrijk wanneer de golffuncties van twee of meer atomen zich combineren tot een molecuul.
Golffuncties met gelijke tekens (golven in fase) zullen constructief interfereren, wat leidt tot de mogelijkheid van binding.Golffuncties met ongelijke tekens (golven uit fase) zullen destructief interfereren.
In 1926 leidde Erwin Schrödinger de golffunctie af voor het eenvoudigste van alle atomen, waterstof.Het oplossen van de Schrödingervergelijking stelt wetenschappers in staat om golffuncties voor elektronen in atomen en moleculen te bepalen.
De Schrödingervergelijking is een vergelijking van de kwantummechanica: de berekende golffuncties hebben discrete, toegestane waarden voor elektronen die in atomen en moleculen gebonden zijn; alle andere waarden zijn verboden.
Naast het belang van Ψ heeft ook zijn kwadraat Ψ2 een enorme betekenis in de chemie.
Ψ2 is de waarschijnlijkheidsdichtheid. Het vertelt ons waar het elektron de meeste kans heeft om in de ruimte rond de kern te worden gevonden.
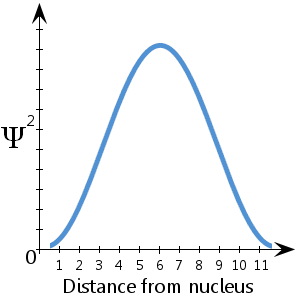
In de hier uitgezette (fictieve) schematische voorstelling van Ψ2 tegen de afstand tot de kern zien we bijvoorbeeld dat de kans het grootst is dat het elektron zich tussen ongeveer 5-7 eenheden van de kern bevindt. We zien ook dat de kans zeer klein is dat het elektron zich in de kern of op meer dan ongeveer 11½ eenheid afstand van de kern bevindt.
Er is een kans van 100 procent dat het elektron zich ergens bevindt – met andere woorden een kans van 1.
Ψ kan alleen exact berekend worden voor atomen met één elektron, d.w.z. H, He+, Li2+, Be3+, B4+, C5+, enz.In wiskundige taal zeggen we dat analytische oplossingen voor Ψ alleen mogelijk zijn voor systemen met één elektron.Systemen met één elektron worden vaak beschreven als hydrogeen – wat betekent “als waterstof.”
Voor alle andere atomen, ionen en moleculen zijn geen analytische oplossingen voor Ψ mogelijk;benaderingsmethoden zijn nodig om het te berekenen.
Ψ2 and Hydrogenic Orbitals
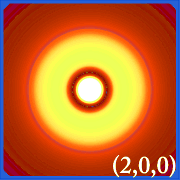
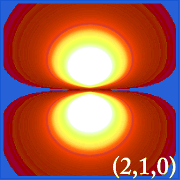
Plotten van de waarschijnlijkheidsdichtheid van waterstof (i.d.w.z. Ψ2) voor verschillende kwantumgetallen stelt ons in staat de ruimte, gecentreerd rond de kern, te visualiseren die elektronen innemen. De verschillende Ψ2 verdelingen zijn de elektronenbanen van waterstof.Welke baan daadwerkelijk wordt ingenomen, wordt bepaald door de hoeveelheid energie die het elektron heeft.
Voorbeelden van de banen van waterstof