Frontiers in Neuroscience
Introduction
De generatie van nieuwe neuronen in de volwassen hippocampus, een hersengebied dat betrokken is bij ruimtelijke navigatie en geheugenvorming (Buzsaki en Moser, 2013), is een opvallende vorm van plasticiteit die het hele leven blijft bestaan bij verschillende diersoorten, waaronder de mens (Altman en Das, 1965; Eriksson et al, 1998; Moreno-Jiménez et al., 2019). Onder de vele omstandigheden die de volwassen hippocampale neurogenese reguleren, is een van de meest betrouwbare processen die op grote schaal is beschreven de leeftijdsgemedieerde afname van de neuronale productie, terwijl reeds bestaande neuronale populaties constant blijven bij normale veroudering (Kuhn et al., 1996; Kempermann et al., 1998; Burke en Barnes, 2010). Veroudering beïnvloedt vele functies in de hersenen, waaronder synaptische transmissie en plasticiteit, waarvan wordt gedacht dat ze bijdragen aan geheugenverlies (Burke en Barnes, 2006; Fan et al., 2017). Gezien het feit dat de hippocampus bijzonder kwetsbaar is voor leeftijdsgerelateerde veranderingen en neurodegeneratie, wordt het vinden van strategieën om de plasticiteit in deze structuur te versterken relevant om de effecten van veroudering te voorkomen of te verlichten (Bartsch en Wulff, 2015). Lichamelijke oefening en cognitieve stimuli verbeteren de gezondheid van de hersenen en hebben de neiging om de effecten van veroudering te verlichten. Een van de directe voordelen kan voortkomen uit de activiteitsafhankelijke verhoging van de niveaus van de brain-derived neurotrophic factor (BDNF), waarvan is aangetoond dat het de synaptische plasticiteit herstelt, de neurogenese versterkt en het leren verbetert bij muizen van middelbare leeftijd (Marlatt et al., 2012; Trinchero et al., 2017). Lichaamsbeweging vermindert ook microglia-activatie, verhoogt activiteitsafhankelijke synaptische plasticiteit, proliferatie van neurale progenitorcellen en versnelt de ontwikkeling en integratie van volwassen geboren granulecellen (GC’s) in de verouderende hippocampus (van Praag et al., 2005; Kronenberg et al., 2006; O’Callaghan et al., 2009; Marlatt et al., 2012; Gebara et al., 2013). Deze effecten dragen bij aan het herstel van hippocampus-afhankelijke plasticiteit en correleren met adaptief gedrag. Zo verbeteren bejaarde dieren die slecht presteren in ruimtelijk leren en patroonscheidingstaken, hun prestaties na oefening (van Praag et al., 2005; Marlatt et al., 2012; Wu et al., 2015; Duzel et al., 2016; Xu et al., 2017).
In hoeverre neurogenese bijdraagt aan de positieve gedragseffecten van oefening bij bejaarde dieren is nog onderwerp van onderzoek. Het is mogelijk dat de toename van de snelheid van neurogenese uitgeoefend door lichaamsbeweging bijdraagt aan gedragsverbetering. Maar ook andere mechanismen kunnen een rol spelen (Meshi et al., 2006). De versnelde integratie van nieuwe neuronen in de ouder wordende dentate gyrus na inspanning, die de kwaliteit van nieuwe GC’s wijzigt, kan ook bijdragen aan gedragsverbetering. Terwijl neuronen geboren in muizen van middelbare leeftijd zich langzaam ontwikkelen, bevordert aanhoudende vrijwillige lichaamsbeweging dendritische groei, wervelkolomvorming en neuronale integratie (Trinchero et al., 2017). Vergelijkbare effecten werden waargenomen door korte blootstellingen aan omgevingsverrijking (EE) (Trinchero et al., 2019). Indien geaccumuleerd over meerdere neuronale cohorten, zou de versnelde neuronale integratie getriggerd door oefening een aanzienlijke invloed kunnen uitoefenen op hippocampus-afhankelijk leren en gedrag. In dit werk tonen we aan dat verschillende cohorten van nieuwe GC’s snel kunnen worden geïntegreerd in de reeds bestaande circuits van muizen die zich blijven bezighouden met vrijwillig hardlopen, en dat deze effecten aanhouden zodra muizen zijn gestopt met hardlopen.
Materialen en Methoden
Muizen en Chirurgie
C57BL/6J mannelijke muizen werden gehuisvest op 4-5 dieren per kooi onder standaardomstandigheden. Acht maanden oude (8M) muizen werden geselecteerd omdat, voorbij deze leeftijd, er een sterke afname is in hippocampale neurogenese die de studie van gelabelde neuronen uitsluit (Morgenstern et al., 2008; Trinchero et al., 2017). Muizen werden verdoofd (150 ug ketamine/15 ug xylazine in 10 ul zoutoplossing / g), en retrovirus werd toegediend in het septale gebied van de rechter dentate gyrus (1,5 ul bij 0,15 ul / min) met behulp van steriele gekalibreerde microcapillaire pipetten door stereotaxische chirurgie; coördinaten van bregma (in mm): -2 anteroposterior, -1,5 laterale, en -1,9 ventrale. Op de aangegeven tijdstippen, hersenen werden gefixeerd en secties werden bereid voor confocale beeldvorming (Trinchero et al., 2017). Alleen GC’s van de septale dentate gyrus werden opgenomen in de analyse, die overeenkomt met secties gelokaliseerd van -0,96 tot -2,30 mm van de bregma, volgens de muis hersenen atlas (Paxinos en Franklin, 2001). Experimentele protocollen werden goedgekeurd door de Institutional Animal Care and Use Committee van Fundación Instituto Leloir, volgens de beginselen voor biomedisch onderzoek met dieren van de Raad voor Internationale Organisaties voor Medische Wetenschappen en bepalingen vermeld in de Guide for the Care and Use of Laboratory Animals.
Running
Loop afstanden werden opgenomen voor elk experiment met behulp van draadloze loopwielen. In de experimenten van figuur 1 dieren werden gehuisvest met een loopwiel voor 7 of 21 dagen, zoals aangegeven. In deze conditie liepen de muizen ∼2 km/dag. In Figuren 2, 3 waarin muizen gedurende 1, 2, of 3 maanden liepen, was de gecontroleerde afstand ∼10 km/dag.
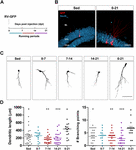
Figuur 1. Lange, maar niet korte perioden van hardlopen versnellen de morfologische rijping van nieuwe GC’s. (A) Experimentele opzet. RV-GFP injectie werd gevolgd door blootstelling aan 1 week van vrijwillige hardlopen op de aangegeven vensters of voor het hele experiment (0-21 dpi). (B) Representatieve beelden van 21-dpi GCs uitdrukken GFP (rood) genomen van sedentaire en 0-21 lopende groepen. NeuN (blauw) labels de korrel cellaag (GCL) (ML, moleculaire laag). Schaal bar, 50 pm. (C) Representatieve confocale beelden van 21-dpi GFP-GCs voor de verschillende groepen. Schaal bar, 50 pm. (D) Dendritische complexiteit (lengte en vertakkingspunten) voor de verschillende loopvensters. ∗, ∗∗, en ∗∗ staan voor p < 0,05, p < 0,01, en p < 0,001 in vergelijking met de 0-21 loopgroep na Kruskal-Wallis test gevolgd door Dunn’s post hoc test. Er werden geen verschillen gevonden tussen de groepen die gedurende 7 dagen liepen. Steekproefgroottes (neuronen/muizen): 27/3 (Sed), 14/3 (0-7), 27/3 (7-14), 22/3 (14-21), en 15/3 (0-21). Horizontale balken geven gemiddelde ± SEM aan. Open cirkels komen overeen met voorbeeld neuronen.
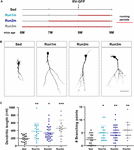
Figuur 2. Effecten van het lopen op verschillende neuronale cohorten. (A) Experimentele opzet. RV-GFP injectie werd gevolgd door 3 weken van hardlopen en voorafgegaan door sedentaire omstandigheden (Run1m), 1 (Run2m), of 2 maanden van hardlopen (Run3m). Alle groepen werden vergeleken met sedentaire muizen (Sed). Totale dendritische lengte werd geanalyseerd op 21 dpi. (B) Representatieve confocale beelden GFP-GCs. Schaal bar, 50 pm. (C) Dendritische complexiteit (lengte en vertakkingspunten) voor de verschillende vensters van het lopen. ∗, ∗∗, en ∗∗ betekenen p < 0,05, p < 0,01, en p < 0,001 in vergelijking met Sed na Kruskal-Wallis test gevolgd door Dunn’s post hoc test. Steekproefgroottes (neuronen/muizen): 20/3 (Sed), 19/3 (Run1m), 31/3 (Run2m), en 15/3 (Run3m). Horizontale balken geven gemiddelde ± SEM aan. Open cirkels komen overeen met voorbeeld neuronen.

Figuur 3. Blijvende effecten van chronische lichaamsbeweging. (A) Experimentele opzet. RV-GFP injectie werd gevolgd door 3 weken hardlopen (Run1m) of voorafgegaan door 1 maand lichaamsbeweging (Run-1m) of 1 maand lichaamsbeweging en 1 maand zonder het loopwiel (Run-2m). Alle groepen werden vergeleken met sedentaire muizen (Sed). Totale dendritische lengte werd geanalyseerd op 21 dpi. (B) Representatieve confocale beelden van gelabelde GCs. Schaal bar, 50 pm. (C) Dendritische complexiteit (lengte en vertakkingspunten) voor de verschillende loopvensters. ∗∗ staat voor p < 0,001 in vergelijking met Sed na Kruskal-Wallis test gevolgd door Dunn’s post hoc test. Sample sizes (neuronen/muizen): 33/4 (Sed), 39/4 (Run1m), 15/4 (Run-1m), en 18/3 (Run-2m). (D) MFB morfologie in CA3 werd geanalyseerd voor Run1m en Run-1m groepen en vergeleken met Sed. Representatieve confocale beelden. Schaal bar, 5 pm. (E) ∗ en ∗∗ duiden op p < 0,05 en p < 0,01 na Kruskal-Wallis test gevolgd door Dunn’s post hoc test. Steekproefgroottes: 27/4 (Sed), 32/4 (Run1m), en 18/4 (Run-1m). Horizontale staven geven gemiddelde ± SEM aan. Open cirkels komen overeen met voorbeeld boutons.
Immunofluorescentie
Immunokleuring werd uitgevoerd op 60-μm vrij zwevende coronale secties. Antilichamen werden aangebracht in tris-gebufferde zoutoplossing (TBS) met 3% ezelserum en 0,25% Triton X-100. Immunofluorescentie werd uitgevoerd met anti GFP (konijn polyklonaal; 1:500; Invitrogen), anti NeuN (muis monoklonaal; 1:50; een gift van F.H. Gage, Salk Institute for Biological Studies, La Jolla, CA, Verenigde Staten), donkey anti-rabbit Cy3 en donkey anti-muis Cy5 antilichamen (1:250; Jackson Immuno Research Laboratories).
Confocale Microscopie
Voor dendritische lengte metingen, werden beelden verkregen (40×; NA 1,3; olie-immersie) van 60-μm dikke secties nemen Z stacks met inbegrip van 35-50 optische plakjes, airy eenheid = 1 op 0,8-μm intervallen (Trinchero et al, 2017). Dendritische lengte werd vervolgens gemeten met behulp van de LSM Image Browser software van projecties van drie-dimensionale reconstructies op een enkel vlak in GCs uitdrukken GFP. Beelden van GFP gelabelde MFBs in de CA3 regio werden verkregen bij 0,4μm intervallen (63×; NA 1,4; olie-immersie) en een digitale zoom van 6. Gebied en het aantal filopodia werd geanalyseerd uit projecties van drie-dimensionale reconstructies op een enkel vlak. Mossy fiber boutons (MFB) die aan de volgende criteria voldoen werden geselecteerd voor kwantificering: (i) de diameter van de bouton was >drie keer groter dan de diameter van de vezel, (ii) de bouton was verbonden met de mosvezel aan ten minste één uiteinde (Toni et al., 2008). Filopodia werden geïdentificeerd als uitsteeksels die voortvloeien uit grote mossy terminals (1 pm < lengte < 20 pm) (Acsady et al., 1998). Filopodiale uitbreidingen werden gemeten door het tellen van het aantal uitsteeksels per terminal. Voor de beeldregistratie en analyse van morfologische eigenschappen, alle experimentele groepen te bestuderen waren blind voor de operator.
Statistische analyse
Niet anders vermeld, worden de gegevens gepresenteerd als gemiddelde ± SEM. De normaliteit werd beoordeeld met de Shapiro-Wilks test, D’Agostino-Pearson omnibus test, en Kolmogorov-Smirnov test, met een p-waarde van 0,05. Wanneer de gegevens voldeden aan de normaliteitstests (Gaussische verdeling en gelijke variantie), werden ongepaarde t-toetsen met Welch’s correctie of ANOVA met Bonferroni’s post hoc test gebruikt, zoals aangegeven. In gevallen waarin niet aan de normaliteit werd voldaan, werden de volgende niet-parametrische tests gebruikt: Mann-Whitney’s test voor onafhankelijke vergelijkingen, en Kruskal-Wallis test voor meervoudige vergelijkingen.
Resultaten
We hebben eerder aangetoond dat hardlopen de ontwikkeling en functionele integratie van nieuwe GC’s in de verouderende hippocampus versnelt (Trinchero et al., 2017). We hebben nu onderzocht of dit type plasticiteit een aanhoudend niveau van activiteit vereist dat zich in de tijd opstapelt, of dat kortere perioden van hardlopen ook een snellere integratie kunnen triggeren, zoals eerder waargenomen voor de blootstelling aan EE (Trinchero et al., 2019). Om deze vraag te beantwoorden, werden nieuwe neuronale cohorten gelabeld in muizen van middelbare leeftijd (8 maanden oud; 8M) met behulp van een retrovirus dat GFP (RV-GFP) tot expressie brengt. Muizen mochten een loopwiel voor 1 week binnen verschillende vensters van neuronale ontwikkeling, of om te rennen voor het gehele interval van neuronale groei (3 weken; Figuren 1A,B). Zoals eerder beschreven, vertoonden nieuwe GC’s een trage ontwikkeling bij sedentaire muizen, wat resulteerde in korte dendrieten met weinig vertakkingen bij 3 weken. Een week hardlopen veranderde niets aan het algemene uiterlijk van nieuwe GCs in een van de geteste intervallen (Figuren 1C,D). Daarentegen resulteerde hardlopen gedurende het gehele interval van 3 weken in verhoogde dendritische lengte en vertakking, consistent met een versnelde neuronale integratie.
De waargenomen effecten van oefening werden getest op een enkele neuronale cohort, degene die retroviraal gelabeld was. Echter, omdat nieuwe GC voortdurend worden gegenereerd, is het denkbaar dat GC geboren op verschillende momenten binnen de inspanning periode kan ook worden beïnvloed door de activiteit. Om deze hypothese te testen, gebruikten we een eenvoudige strategie om neuronale cohorten geboren op verschillende tijdstippen met betrekking tot inspanningsinitiatie te labelen door muizen bloot te stellen aan loopwielen voor verschillende intervallen, maar altijd het analyseren van neuronale structuur 3 weken na retrovirale injectie (aangeduid als 1m voor de eenvoud). Drie cohorten werden dus vergeleken; een loopt voor 3 weken, gelabeld direct bij het begin van de oefening (Run1m), een loopt voor 2 maanden, gelabeld 1 maand na het begin van de oefening (Run2m), en een loopt 3 maanden, gelabeld 2 maanden na het begin van de oefening (Run3m) (Figuur 2A). We zagen een vergelijkbare mate van neuronale groei in alle omstandigheden in vergelijking met sedentaire muizen, wat aangeeft dat alle neuronale cohorten geboren in de hersenen van een muis van middelbare leeftijd het uitvoeren van vrijwillige hardlopen zal een snelle groei en integratie (Figuren 2B,C) te ondergaan. Dendritische bomen van GC’s in Run3m muizen waren iets langer dan die van Run1m of Run2m muizen, wat suggereert dat de bevordering van neuronale integratie zou kunnen reageren op een mechanisme waarvan het effect zich opstapelt in de tijd. Toch resulteerde 1 maand hardlopen in een bijna maximaal effect op GC-ontwikkeling.
We onderzochten vervolgens de effecten van lichaamsbeweging in de ouder wordende hersenen op neuronale cohorten die ontstonden zodra de activiteit werd beëindigd. We vergeleken hoe het uitvoeren van 3-4 weken beïnvloedt de ontwikkeling van nieuwe GC’s geboren direct bij het begin (Run1m), aan het einde (Run-1m), of 1 maand na het einde van de oefening (Run-2m; figuur 3A). Verrassend, neuronale cohorten geboren aan het begin of aan het einde van de loop periode reageerde op dezelfde manier (Figuren 3B,C). In tegenstelling, cohorten geboren 1 maand na het einde van de oefening (Run-2m) toonde slechts een subtiel effect.
Om volledig te integreren in het circuit, GC’s vestigen glutamaterge excitatoire verbindingen op CA3 piramidale cellen door middel van grote MFBs, en werven GABA-erge feedforward remming op piramidale cellen via filopodiale uitbreidingen die voortvloeien uit deze terminals (Acsady et al., 1998; Toni et al., 2008; Sun et al., 2013; Restivo et al., 2015). Terwijl confocale analyse geen veranderingen onthulde in het gebied van MFBs van neuronen geboren op Run-1m of Run1m in vergelijking met controles, nam het aantal filopodia/MFBs toe met ∼100% (Figuren 3D,E). Deze resultaten wijzen erop dat fysieke inspanning specifiek de connectiviteit van nieuwe GC’s op het remmende lokale netwerk verhoogt (Trinchero et al., 2019).
Discussie
Adulte neurogenese omvat een opeenvolging van complexe ontwikkelingsstappen die resulteert in de integratie van nieuwe informatie-verwerkende eenheden. Neurale stamcellen van de subgranulaire zone verlaten hun rusttoestand om prolifererende neurale progenitorcellen te worden die de precursorpopulatie uitbreiden (transit amplifying cells) (Bonaguidi et al., 2012). Progenitorcellen genereren neuronen die migreren, zich ontwikkelen en integreren in het circuit. Tijdens dit lange tijdsinterval is er een duidelijke vermindering van de neuronale populatie als gevolg van apoptotische celdood. Vrijwillige lichaamsbeweging en EE zijn sterke stimuli voor het stimuleren van volwassen hippocampale neurogenese bij knaagdieren gedurende het hele leven (van Praag et al., 1999a, b; Kronenberg et al., 2003, 2006; Wu et al., 2008; Kannangara et al., 2011). Neurogenese neemt af in de ouder wordende hersenen, voornamelijk als gevolg van de afname van de omvang van de progenitorcelpool. Zowel hardlopen als EE kunnen de verminderde neuronale productie tegengaan die bij ouder wordende dieren wordt vastgesteld, en wel via verschillende mechanismen (Kempermann et al., 2010). Hardlopen werkt op twee niveaus om neurogenese te verbeteren: het verhogen van de snelheid van proliferatie van neurale progenitorcellen (van Praag et al., 1999b, 2005; Cooper et al., 2018), en het versnellen van de rijping en functionele integratie van zich ontwikkelende neuronen (Trinchero et al., 2017). EE verhoogt de overleving en versnelt ook de rijping van nieuwe GC’s, maar beïnvloedt de proliferatie niet (Trinchero et al., 2017, 2019).
Running bevordert ook de herbedrading van neuronale connectiviteit en modulatie van intrinsieke eigenschappen in nieuwe GC’s tijdens de eerste week van ontwikkeling in jong-volwassen muizen (Sah et al., 2017). We hebben onlangs een kritieke periode gemeld tijdens de tweede week van de rijping van GC’s in ouder wordende dieren, waarin EE dendritische groei en snellere integratie van nieuwe neuronen in het circuit induceert (Trinchero et al., 2019). We vroegen hier of hardlopen gedurende 1 week op elk moment van de ontwikkeling van GC’s hun integratie zou beïnvloeden, maar vonden geen effect (figuur 1). De gehele hardloopperiode van 3 weken was nodig om neurogenese te reguleren. Het gebrek aan modulatie op korte termijn suggereert een mechanisme gemedieerd door factoren die moeten worden opgebouwd om merkbare veranderingen uit te oefenen. Interessant is dat vrijwillige lichaamsbeweging de productie van BDNF verergert, die zich gedurende weken opstapelt voordat een plateauniveau wordt bereikt dat maximale acties uitoefent (Vecchio et al., 2018). Hoewel neurotrofines belangrijke mediatoren zijn, is het aannemelijk dat de hier waargenomen effecten door meerdere mechanismen worden gemedieerd. Oefening verhoogt ook de elektrische activiteit in de dentate gyrus, verhoogt de bloedstroom, en moduleert neuro-inflammatie (Piatti et al., 2011; Speisman et al., 2013; Trinchero et al., 2017). De bijdrage van andere mechanismen vereist verdere studies.
We laten hier zien dat ∼3 weken oude GC’s van ouder wordende muizen die chronisch zijn blootgesteld aan een loopwiel (tot 3 maanden) een volledig ontwikkeld fenotype presenteren met lange en complexe dendritische arborizaties, vergelijkbaar met die van nieuwe GC’s gegenereerd in jongvolwassen muizen (figuur 2). Volwassen GCs in jong-volwassen muizen en muizen van middelbare leeftijd bereiken gelijkwaardige dendritische lengte en complexiteit tegen het einde van de ontwikkeling, vergelijkbaar met 3 weken oude GCs in ouder wordende muizen blootgesteld aan EE of hardlopen (Piatti et al., 2011; Trinchero et al., 2017, 2019). Dit geaccumuleerde bewijs spreekt voor een duidelijke versnelling van de snelheid van rijping opgeroepen door running.
Op het niveau van neuronale output, bevorderde running de snelle groei van filopodiale extensies, maar wijzigde de grootte van MBFs niet (Figuren 3D,E). Dit resultaat suggereert dat nieuwe GC’s snel integreren, maar hun output zou kunnen worden bevooroordeeld in de richting van de activering van GABA-erge interneuronen in CA3 (gecontacteerd door filopodia), in plaats van piramidale cellen gecontacteerd door MFB’s (Acsady et al., 1998; Toni et al., 2008; Sun et al., 2013; Restivo et al., 2015). Het is verrassend dat EE een duidelijke toename van zowel de grootte van MFBs als het aantal filopodiale extensies in ouder wordende muizen uitlokte, consistent met een meer gebalanceerde modulatie van neuronale output (Trinchero et al., 2019). Wij speculeren dat veranderingen als gevolg van EE activiteit-afhankelijke hermodellering van specifieke synapsen inhouden die versterkt worden voor het coderen van ruimtelijke signalen (Nicoll en Schmitz, 2005; Holtmaat en Svoboda, 2009). Daarentegen kan hardlopen een algemene stimulans zijn voor nieuwe GC’s om zich voor te bereiden om verbinding te maken met specifieke doelen wanneer coderen noodzakelijk wordt, met behoud van de remmende toon van GABA-erge interneuronen die zou kunnen fungeren als een mechanisme dat postsynaptische activiteit beperkt totdat de nieuwe GC goed is geassembleerd binnen het omringende netwerk.
Onze resultaten geven aan dat de ouder wordende hersenen neurogene signalen genereren wanneer muizen gedurende langere perioden (maanden) blijven hardlopen. In deze context zal de daaropvolgende neuronale cohorten geboren in lopende muizen te ontwikkelen en te integreren snel, waardoor veroudering circuits accumuleren aanzienlijke aantallen nieuwe neuronen (figuur 4). De voortdurende opname van nieuwe GC met kenmerken die lijken op wat er gebeurt in jongere muizen resulteert in een verjongde hippocampus met neuronen die kunnen worden klaargestoomd om te reageren op toekomstige ervaringen.
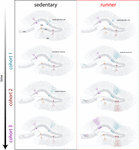
Figuur 4. Door hardlopen geïnduceerde verjonging van het hippocampale netwerk bij muizen van middelbare leeftijd. Schematische weergave van het tijdsverloop van neuronale integratie in sedentaire (links) en rennende (rechts) muizen na langdurige intervallen van vrijwillige lichaamsbeweging. In de subgranulaire zone van de dentate gyrus, blijven radiale-glia-achtige cellen (RGL) in een rusttoestand (boven). Sedentaire muizen vertonen een lage neurogenese en nieuwe neuronen ontwikkelen zich traag (representatieve cohorten zijn aangegeven met verschillende kleuren). In lopende muizen, is de productie van nieuwe GC gestimuleerd, en deze nieuwe eenheden te ontwikkelen en te integreren sneller, het uitbreiden van het neurale netwerk in een cumulatieve manier over een langere tijdspanne. Uiteindelijk worden deze nieuwe cohorten van volledig rijpe neuronen ingeschakeld om informatie op verzoek te verwerken.
In een breder perspectief gaat de toename van de levensduur die met de moderne samenleving gepaard gaat, gepaard met een hoger risico op cognitieve achteruitgang. Het wordt dus relevant om de mechanismen te begrijpen die ten grondslag liggen aan de welbekende voordelen van lichaamsbeweging voor de hersenfunctie. Bovendien zouden er op de lange termijn verschillen kunnen zijn tussen individuen die gedurende verschillende intervallen in het leven aan lichaamsbeweging doen en degenen die continu aan lichaamsbeweging hebben gedaan, wat betreft het verminderen van het risico op het ontwikkelen van neurodegeneratieve ziekten (Llorens-Martin, 2018). Onze resultaten tonen aan dat continu hardlopen de integratie van vele neuronale cohorten bevordert, waardoor de complexiteit van het netwerk op een opmerkelijke manier wordt verhoogd. Het ontwerpen van verschillende strategieën voor het verhogen van de effectiviteit van nieuwe neuron integratie in de hippocampus zou kunnen dienen als een veelbelovend mechanisme van plasticiteit om uiteindelijk de cognitieve achteruitgang die optreedt in de gezonde en zieke verouderende hersenen te verbeteren. Ten slotte zal het ontleden van de mechanismen die ten grondslag liggen aan de verschillende aspecten van dergelijke versnelde neuronale integratie en ontwikkeling ons veel leren over het potentieel voor plasticiteit van neurale netwerken in het ouder wordende brein.
Data Availability
De gegevens die de bevindingen van deze studie ondersteunen, zijn op redelijk verzoek beschikbaar bij de corresponderende auteur.
Ethics Statement
De dierstudie werd beoordeeld en goedgekeurd door commissie voor het gebruik en de verzorging van proefdieren van het Leloir Instituut.
Author Contributions
MT en MH voerden de experimenten uit en analyseerden de gegevens. MT, MH, en AS ontwierpen de experimenten en schreven het manuscript. AS zorgde voor financiële ondersteuning.
Funding
Dit werk werd ondersteund door het Argentijnse Agentschap voor de bevordering van wetenschap en technologie (Grant# PICT2015-3814), het National Institute of Neurological Disorders and Stroke, en het Fogarty International Center (Grant# R01NS103758) aan AS, die onderzoeker is in de Consejo Nacional de Investigaciones Científicas y Técnicas (CONICET). MT werd ondersteund door een CONICET fellowship.
Conflict of Interest Statement
De auteurs verklaren dat het onderzoek werd uitgevoerd in de afwezigheid van enige commerciële of financiële relaties die kunnen worden opgevat als een potentieel belangenconflict.
Acknowledgments
Wij danken de leden van het AS lab voor inzichtelijke discussies.
Acsady, L., Kamondi, A., Sik, A., Freund, T., and Buzsaki, G. (1998). GABAergic cells are the major postsynaptic targets of mossy fibers in the rat hippocampus. J. Neurosci. 18, 3386-3403.
PubMed Abstract | Google Scholar
Altman, J., and Das, G. D. (1965). Autoradiographic and histological evidence of postnatale hippocampal neurogenesis in rats. J. Comp. Neurol. 124, 319-335.
Google Scholar
Bartsch, T., and Wulff, P. (2015). De hippocampus bij veroudering en ziekte: van plasticiteit naar kwetsbaarheid. Neuroscience 309, 1-16. doi: 10.1016/j.neuroscience.2015.07.084
PubMed Abstract | CrossRef Full Text | Google Scholar
Bonaguidi, M. A., Song, J., Ming, G. L., and Song, H. (2012). A unifying hypothesis on mammalian neural stem cell properties in the adult hippocampus. Curr. Opin. Neurobiol. 22, 754-761. doi: 10.1016/j.conb.2012.03.013
PubMed Abstract | CrossRef Full Text | Google Scholar
Burke, S. N., and Barnes, C. A. (2006). Neurale plasticiteit in de verouderende hersenen. Nat. Rev. Neurosci. 7, 30-40.
PubMed Abstract | Google Scholar
Burke, S. N., and Barnes, C. A. (2010). Senescent synapses and hippocampal circuit dynamics. Trends Neurosci. 33, 153-161. doi: 10.1016/j.tins.2009.12.003
PubMed Abstract | CrossRef Full Text | Google Scholar
Buzsaki, G., and Moser, E. I. (2013). Geheugen, navigatie en theta ritme in de hippocampus-entorhinal systeem. Nat. Neurosci. 16, 130-138. doi: 10.1038/nn.3304
PubMed Abstract | CrossRef Full Text | Google Scholar
Cooper, C., Moon, H. Y., and van Praag, H. (2018). Op de vlucht voor hippocampale plasticiteit. Cold Spring Harb. Perspect. Med. 8:a029736. doi: 10.1101/cshperspect.a029736
PubMed Abstract | CrossRef Full Text | Google Scholar
Duzel, E., van Praag, H., and Sendtner, M. (2016). Kan lichaamsbeweging op oudere leeftijd het geheugen en de hippocampale functie verbeteren? Brain 139, 662-673. doi: 10.1093/brain/awv407
PubMed Abstract | CrossRef Full Text | Google Scholar
Eriksson, P. S., Perfilieva, E., Bjork-Eriksson, T., Alborn, A. M., Nordborg, C., Peterson, D. A., et al. (1998). Neurogenese in de volwassen menselijke hippocampus. Nat. Med. 4, 1313-1317.
PubMed Abstract | Google Scholar
Fan, X., Wheatley, E. G., and Villeda, S. A. (2017). Mechanismen van hippocampale veroudering en het potentieel voor verjonging. Annu. Rev. Neurosci. 40, 251-272. doi: 10.1146/annurev-neuro-072116-031357
PubMed Abstract | CrossRef Full Text | Google Scholar
Gebara, E., Sultan, S., Kocher-Braissant, J., and Toni, N. (2013). Adult hippocampal neurogenesis invers correlates with microglia in conditions of voluntary running and aging. Front. Neurosci. 7:145. doi: 10.3389/fnins.2013.00145
PubMed Abstract | CrossRef Full Text | Google Scholar
Holtmaat, A., and Svoboda, K. (2009). Experience-dependent structural synaptic plasticity in the mammalian brain. Nat. Rev. Neurosci. 10, 647-658. doi: 10.1038/nrn2699
PubMed Abstract | CrossRef Full Text | Google Scholar
Kannangara, T. S., Lucero, M. J., Gil-Mohapel, J., Drapala, R. J., Simpson, J. M., Christie, B. R., et al. (2011). Hardlopen vermindert stress en verbetert celgenese in oudere muizen. Neurobiol. Aging 32, 2279-2286. doi: 10.1016/j.neurobiolaging.2009.12.025
PubMed Abstract | CrossRef Full Text | Google Scholar
Kempermann, G., Fabel, K., Ehninger, D., Babu, H., Leal-Galicia, P., Garthe, A., et al. (2010). Waarom en hoe fysieke activiteit ervaring-geïnduceerde hersenplasticiteit bevordert. Front. Neurosci. 4:189. doi: 10.3389/fnins.2010.00189
PubMed Abstract | CrossRef Full Text | Google Scholar
Kempermann, G., Kuhn, H. G., and Gage, F. H. (1998). Ervaring-geïnduceerde neurogenese in de senescente dentate gyrus. J. Neurosci. 18, 3206-3212.
PubMed Abstract | Google Scholar
Kronenberg, G., Bick-Sander, A., Bunk, E., Wolf, C., Ehninger, D., and Kempermann, G. (2006). Lichamelijke oefening voorkomt leeftijdsgebonden achteruitgang in precursor cel activiteit in de muis dentate gyrus. Neurobiol. Aging 27, 1505-1513. doi: 10.1016/j.neurobiolaging.2005.09.016
PubMed Abstract | CrossRef Full Text | Google Scholar
Kronenberg, G., Reuter, K., Steiner, B., Brandt, M. D., Jessberger, S., Yamaguchi, M., et al. (2003). Subpopulaties van prolifererende cellen van de volwassen hippocampus reageren verschillend op fysiologische neurogene stimuli. J. Comp. Neurol. 467, 455-463. doi: 10.1002/cne.10945
PubMed Abstract | CrossRef Full Text | Google Scholar
Kuhn, H. G., Dickinson-Anson, H., and Gage, F. H. (1996). Neurogenese in de dentate gyrus van de volwassen rat: leeftijdsgebonden afname van neuronale progenitor proliferatie. J. Neurosci. 16, 2027-2033.
PubMed Abstract | Google Scholar
Llorens-Martin, M. (2018). Oefenen van nieuwe neuronen om de ziekte van Alzheimer te overwinnen. Brain Plast. 4, 111-126. doi: 10.3233/bpl-180065
PubMed Abstract | CrossRef Full Text | Google Scholar
Marlatt, M. W., Potter, M. C., Lucassen, P. J., and van Praag, H. (2012). Hardlopen gedurende de middelbare leeftijd verbetert de geheugenfunctie, hippocampale neurogenese, en BDNF niveaus in vrouwelijke C57BL/6J muizen. Dev. Neurobiol. 72, 943-952. doi: 10.1002/dneu.22009
PubMed Abstract | CrossRef Full Text | Google Scholar
Meshi, D., Drew, M. R., Saxe, M., Ansorge, M. S., David, D., Santarelli, L., et al. (2006). Hippocampale neurogenese is niet vereist voor gedragseffecten van omgevingsverrijking. Nat. Neurosci. 9, 729-731. doi: 10.1038/nn1696
PubMed Abstract | CrossRef Full Text | Google Scholar
Moreno-Jiménez, E. P., Flor-García, M., Terreros-Roncal, J., Rábano, A., Cafini, F., Pallas-Bazarra, N., et al. (2019). Volwassen hippocampale neurogenese is overvloedig in neurologisch gezonde personen en daalt sterk in patiënten met de ziekte van Alzheimer. Nat. Med. 25, 554-560.
Google Scholar
Morgenstern, N. A., Lombardi, G., and Schinder, A. F. (2008). Newborn granule cells in the ageing dentate gyrus. J. Physiol. 586, 3751-3757. doi: 10.1113/jphysiol.2008.154807
PubMed Abstract | CrossRef Full Text | Google Scholar
Nicoll, R. A., and Schmitz, D. (2005). Synaptic plasticity at hippocampal mossy fibre synapses. Nat. Rev. Neurosci. 6, 863-876.
PubMed Abstract | Google Scholar
O’Callaghan, R. M., Griffin, E. W., and Kelly, A. M. (2009). Long-term treadmill exposure protects against age-related neurodegenerative change in the rat hippocampus. Hippocampus 19, 1019-1029. doi: 10.1002/hipo.20591
PubMed Abstract | Ref Full Text | Google Scholar
Paxinos, G., and Franklin, K. B. J. (2001). De hersenen van de muis in stereotaxische coördinaten. Amsterdam: Elsevier.
Google Scholar
Piatti, V. C., Davies-Sala, M. G., Esposito, M. S., Mongiat, L. A., Trinchero, M. F., and Schinder, A. F. (2011). De timing voor neuronale maturatie in de volwassen hippocampus wordt gemoduleerd door lokale netwerkactiviteit. J. Neurosci. 31, 7715-7728. doi: 10.1523/JNEUROSCI.1380-11.2011
PubMed Abstract | CrossRef Full Text | Google Scholar
Restivo, L., Niibori, Y., Mercaldo, V., Josselyn, S. A., and Frankland, P. W. (2015). Development of adult-generated cell connectivity with excitatory and inhibitory cell populations in the hippocampus. J. Neurosci. 35, 10600-10612. doi: 10.1523/JNEUROSCI.3238-14.2015
PubMed Abstract | CrossRef Full Text | Google Scholar
Sah, N., Peterson, B. D., Lubejko, S. T., Vivar, C., and van Praag, H. (2017). Hardlopen reorganiseert het circuit van een week oude volwassen hippocampale neuronen. Sci. Rep. 7:10903. doi: 10.1038/s41598-017-11268-z
PubMed Abstract | CrossRef Full Text | Google Scholar
Speisman, R. B., Kumar, A., Rani, A., Foster, T. C., and Ormerod, B. K. (2013). Dagelijkse lichaamsbeweging verbetert het geheugen, stimuleert hippocampale neurogenese en moduleert immuun- en neuro-immuun cytokines bij ouder wordende ratten. Brain Behav. Immun. 28, 25-43. doi: 10.1016/j.bbi.2012.09.013
PubMed Abstract | CrossRef Full Text | Google Scholar
Sun, G. J., Sailor, K. A., Mahmood, Q. A., Chavali, N., Christian, K. M., Song, H., et al. (2013). Seamless reconstruction of intact adult-born neurons by serial end-block imaging reveals complex axonal guidance and development in the adult hippocampus. J. Neurosci. 33, 11400-11411. doi: 10.1523/JNEUROSCI.1374-13.2013
PubMed Abstract | CrossRef Full Text | Google Scholar
Toni, N., Laplagne, D. A., Zhao, C., Lombardi, G., Ribak, C. E., Gage, F. H., et al. (2008). Neuronen geboren in de volwassen dentate gyrus vormen functionele synapsen met doelcellen. Nat. Neurosci. 11, 901-907. doi: 10.1038/nn.2156
PubMed Abstract | CrossRef Full Text | Google Scholar
Trinchero, M. F., Buttner, K. A., Sulkes Cuevas, J. N., Temprana, S. G., Fontanet, P., Monzon Salinas, M. C., et al. (2017). Hoge plasticiteit van nieuwe granule cel in de verouderende hippocampus. Cell Rep. 21, 1129-1139. doi: 10.1016/j.celrep.2017.09.064
PubMed Abstract | CrossRef Full Text | Google Scholar
Trinchero, M. F., Herrero, M., Monzon-Salinas, M. C., and Schinder, A. F. (2019). Ervaringsafhankelijke structurele plasticiteit van volwassen geboren neuronen in de verouderende hippocampus. Front. Neurosci. 13:739. doi: 10.3389/fnins.2019.00739
PubMed Abstract | CrossRef Full Text | Google Scholar
van Praag, H., Christie, B. R., Sejnowski, T. J., and Gage, F. H. (1999a). Running verbetert neurogenese, leren, en lange-termijn potentiatie in muizen. Proc. Natl. Acad. Sci. U.S.A. 96, 13427-13431.
Google Scholar
van Praag, H., Kempermann, G., and Gage, F. H. (1999b). Running increases cell proliferation and neurogenesis in the adult mouse dentate gyrus. Nat. Neurosci. 2, 266-270.
PubMed Abstract | Google Scholar
van Praag, H., Shubert, T., Zhao, C., and Gage, F. H. (2005). Oefening bevordert leren en hippocampale neurogenese bij oude muizen. J. Neurosci. 25, 8680-8685.
PubMed Abstract | Google Scholar
Vecchio, L. M., Meng, Y., Xhima, K., Lipsman, N., Hamani, C., and Aubert, I. (2018). De neuroprotectieve effecten van lichaamsbeweging: het behouden van een gezond brein gedurende veroudering. Brain Plast. 4, 17-52. doi: 10.3233/bpl-180069
PubMed Abstract | CrossRef Full Text | Google Scholar
Wu, C. W., Chang, Y. T., Yu, L., Chen, H. I., Jen, C. J., Wu, S. Y., et al. (2008). Exercise enhances the proliferation of neural stem cells and neurite growth and survival of neuronal progenitor cells in dentate gyrus of middle-aged mice. J. Appl. Physiol. 105, 1585-1594. doi: 10.1152/japplphysiol.90775.2008
PubMed Abstract | CrossRef Full Text | Google Scholar
Wu, M. V., Luna, V. M., and Hen, R. (2015). Hardlopen redt een angst-gebaseerde contextuele discriminatie tekort in oude muizen. Front. Syst. Neurosci. 9:114. doi: 10.3389/fnsys.2015.00114
PubMed Abstract | CrossRef Full Text | Google Scholar
Xu, B., Sun, A., He, Y., Qian, F., Liu, L., Chen, Y., et al. (2017). Running-geïnduceerde geheugenverbetering correleert met het behoud van dunne stekels in het hippocampale gebied CA1 van oude C57BL/6 muizen. Neurobiol. Aging 52, 106-116. doi: 10.1016/j.neurobiolaging.2017.01.002
PubMed Abstract | CrossRef Full Text | Google Scholar




