Frontiers in Oncology
Introduction
Glioblastoma en anaplastisch astrocytoma (ANA) zijn twee van de meest voorkomende primaire hersentumoren bij volwassenen (1). Er is een ware stijging van de incidentiecijfers, vooral bij ouderen (1-3). In de klinische praktijk is het moeilijk om patiënten met glioblastoma te onderscheiden van die met ANA vóór chirurgie of biopsie, omdat de symptomen en tekenen van de twee tumoren relatief uniform en niet-specifiek zijn (4, 5). De behandeling voor hen is echter verschillend, zoals het chemotherapie protocol, de dosering en de wijze van toediening (6). Bijvoorbeeld, voor patiënten met ANA (WHO graad III), wordt radiotherapie of TMZ aanbevolen na resectie of biopsie; terwijl voor patiënten met de nieuwe diagnose glioblastoma (WHO graad IV), radiotherapie plus gelijktijdige TMZ wordt aanbevolen, gevolgd door adjuvante TMZ. Volgens eerdere studies groeien glioblastomen en ANA door invasie in normaal hersenweefsel, verspreiden ze zich via de cerebrospinale vloeistof (CSF), en breiden ze zich uit tot voorbij een enkele halsslagader of vertebrale slagader, waardoor ze beide slecht reageren op medisch beheer en de belangrijkste doodsoorzaak door kanker bij volwassenen worden (7, 8). Bovendien is de prognose van glioblastoom en ANA verschillend. Bij de oudere bevolking is er geen significant verschil in prognose tussen glioblastoma en ANA, maar bij de jongere bevolking kan dit verschil wel bestaan (9). Daarom is het moeilijk maar cruciaal om glioblastoom van ANA te onderscheiden.
Magnetic Resonance Imaging (MRI) is de optimale neuroimaging bij de preoperatieve diagnose van glioblastoom en ANA vanwege het multiplanaire vermogen en het superieure weke delen contrast. Hoewel sommige studies aantoonden dat de aanwezigheid van ringvormige versterking en necrose suggestief was voor glioblastoom, verschijnen in de meeste gevallen zowel glioblastoom als ANA als onregelmatige vormen op MR-beelden (hyperdense op T2-gewogen sequentie en hypodense op T1-gewogen sequentie) met verschillende mate van contrastversterking op basis van Gd en oedeem, waarvan de verschillen gewoonlijk niet waarneembaar waren voor het menselijk oog (10-12).
Recently, texture analyse (TA), ook bekend als radiomics, is op grote schaal toegepast in verschillende gebieden. Onderzoekers ontdekten dat TA een haalbare en veelbelovende methode was om differentiële diagnose te vergemakkelijken, aangezien het de verwerving van extra kwantitatieve informatie uit MR-beelden mogelijk maakte die onzichtbaar was voor menselijke beoordeling (13-15). TA beschrijft de frequentieverdeling en de ruimtelijke organisatie van de voxelwaarde om de mogelijke verschillen in tumorweefsel te onthullen (16). Eerdere studies hebben de haalbaarheid onderzocht van de toepassing van TA bij differentiële diagnose, subtype-indeling van tumoren en detectie van heterogeniteit van tumorweefsel (17-19). Voor zover wij weten, is de toepassing van TA in de differentiële diagnose tussen glioblastoma en ANA nog niet gerapporteerd. Het doel van deze studie was het evalueren van het discriminerend vermogen van MRI-textuuranalyse met behulp van machine learning-algoritmen om glioblastoom en ANA te differentiëren.
Materialen en methoden
Patiëntenselectie
We doorzochten retrospectief onze instellingsdatabase en screenden alle patiënten die histopathologisch gediagnosticeerd waren als glioblastoom of ANA, van januari 2015 tot december 2018. Geschiktheidscriteria voor gekwalificeerde patiënten waren: (1) sluitende histopathologische diagnose glioblastoom of ANA; (2) uitgebreid elektronisch medisch dossier, met name pathologisch materiaal; (3) diagnostische MR-scan in onze instelling vóór chirurgische resectie. Exclusiecriteria waren: (1) voorgeschiedenis van intracraniële ziekte (bijv. hersentrauma, intracraniële infectie of andere soorten hersentumor), gezien de interferentie van littekenweefsel op de intensiteit van de beelden; (2) aanwezigheid van bewegingsartefacten op MRI; (3) voorgeschiedenis van behandelingen vóór MR-scan (bijv. chirurgie, chemotherapie of radiotherapie); (4) patiënten die niet voldeden aan de criteria voor diagnose van glioblastoom of ANA volgens het 2016 WHO-classificatiesysteem. Een senior neuropatholoog met 10 jaar ervaring beoordeelde of de patiënt voldeed aan de criteria (het 2016 WHO-classificatiesysteem) voor glioblastoom of ANA. De institutionele beoordelingsraad keurde deze retrospectieve studie goed. De schriftelijke geïnformeerde toestemming werd verkregen van de deelnemers die zich inschreven voor deze studie. De ethische commissie van Sichuan University en de afdeling radiologie van onze instelling hebben het gebruik van de statistieken voor deze studie goedgekeurd.
MR beeldacquisitie
Voor alle patiënten die in deze studie werden geïncludeerd, waren contrast-verrijkte T1-gewogen sequenties beschikbaar en werden verkregen op 3.0T Siemens Trio Scanner met de volgende parameters: TR/TE/TI = 1900/2.26/900 ms, Flip hoek = 9 °, 20 axiale plakken met dikte = 5 mm, axiale FOV = 25.6 × 25.6 cm2 en data matrix = 256 × 256. Contrast-verrijkte T1-gewogen beeldvorming gebruikt gadopentetate dimeglumine (0,1 mmol / kg) was het contrastmiddel voor contrast-verrijkt beeld, en multi-directionele gegevens van contrast-verrijkte MRI werden verzameld tijdens de continue interval tijd van 90-250 s.
Texture Extraction
In onze studie, LifeX pakket (http://www.lifexsoft.org) werd gebruikt om textuurkenmerken te extraheren. Post-contrast T1-gewogen (T1C) beelden werden geselecteerd voor verdere analyse als gevolg van de duidelijke weergave van tumor locatie en grens (20). Regio van belang (ROI) werd handmatig slice-voor-slice getrokken in het axiale vlak langs de laesies op contrast-verrijkte beelden om textuur kenmerken te verkrijgen. Twee ervaren neurochirurgen, blind voor de medische dossiers van de patiënten en histopathologische diagnose, trok de ROI, gevolgd door bewerking door een senior radioloog en een senior neurochirurg. De meningsverschillen werden aangepakt door het bespreken van en overleg met de senior radioloog en de senior neurochirurg. In totaal werden 40 textuurkenmerken uit de MRI-beelden geëxtraheerd, waaronder minValue, meanValue, maxValue, stdValue, en parameters afgeleid van zes matrices: Histogram-gebaseerde matrix (HISTO), Shape, Gray-level co-occurrence matrix (GLCM), Gray-level run length matrix (GLRLM), Gray-level zone lengte matrix (GLZLM), en Neighborhood gray-level dependence matrix (NGLDM).
Features Selection
Er waren 40 textuurkenmerken in totaal afgeleid van zes geselecteerde matrices. De uitleg van de 40 textuurkenmerken werd weergegeven in aanvullende tabel 1. De statistieken van deze textuurkenmerken werden getoond in aanvullende tabel 2. De selectie van de kenmerken werd uitgevoerd om relevante kenmerken te bepalen en zo overfitting te vermijden. Bovendien kon het in deze studie toegepaste algoritme voor machinaal leren niet alle 40 textuurkenmerken in de analyse betrekken. Drie onafhankelijke feature-selectiemethoden werden gebruikt om optimale textuurkenmerken te selecteren, waaronder Distance Correlation, least absolute shrinkage and selection operator (LASSO), en gradient correlation decision tree (GBDT). Drie subsets van textuurkenmerken werden aldus gevormd en vormden drie verschillende datasets.
Classificatie
Lineaire discriminantanalyse (LDA) is een robuuste classificatiemethode om twee klassen te scheiden door te zoeken naar de lineaire combinatie van voorspellers die de scheiding tussen groepen maximaliseert. In deze studie werden drie classificatiemodellen vastgesteld op basis van het LDA-algoritme: Afstandscorrelatie + LDA, LASSO + LDA, en GBDT + LDA. Datasets werden respectievelijk en onafhankelijk ingevoerd in het LDA-algoritme. Elke dataset werd willekeurig verdeeld in een trainings- en een validatiegroep in een verhouding van 4:1. Het model getraind door de training groep werd vervolgens toegepast op de onafhankelijke validatie groep om de prestaties te evalueren. Om de robuustheid van het LDA-algoritme te beoordelen, werd de procedure herhaald voor 100 cycli met verschillende, willekeurige en onafhankelijke casustoewijzing. Er werd een verwarringsmatrix bepaald met de ware toewijzing op basis van de histopathologie en de voorspellingen van het LDA-algoritme. De standaardgevoeligheid, specificiteit, de gebieden onder de receiver operating characteristic curve (AUC) en de nauwkeurigheid werden berekend voor zowel de training- als de validatiegroep om het discriminerend vermogen van de modellen aan het licht te brengen. De vergelijking van drie modellen (Afstandscorrelatie + LDA, LASSO + LDA, en GBDT + LDA) werd uitgevoerd om het optimale discriminatieve model voor glioblastoom en ANA te bepalen. Het stroomdiagram van MRI-classificatie door textuurkenmerken wordt getoond in Figuur 1.
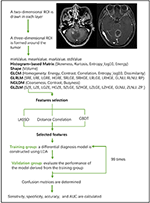
Figuur 1. Stroomdiagram van MRI-classificatie op basis van textuurkenmerken. ANA, anaplastisch astrocytoom; LDA, lineaire discriminantanalyse; MRI, Magnetic Resonance Imaging; LASSO, minst absolute krimp- en selectieoperator; GBDT, gradiëntcorrelatiebeslisboom; HISTO, histogram-gebaseerde matrix; GLCM, Gray-level co-occurrence matrix; GLRLM, Gray-level run length matrix; GLZLM, Gray-level zone length matrix; NGLDM, Neighborhood gray-level dependence matrix; AUC, gebied onder de receiver operating characteristic curve.
Resultaten
Patiëntenkenmerken
In totaal voldeden 133 patiënten met glioblastoom (n = 76) of ANA (n = 57) aan de inclusiecriteria. Alle patiënten met glioblastoma werden in deze studie opgenomen, terwijl 10 patiënten met ANA volgens de exclusiecriteria werden uitgesloten. Uiteindelijk werden 76 patiënten met glioblastoma en 46 patiënten met ANA geïncludeerd in deze studie. De gemiddelde leeftijd van de patiënten was respectievelijk 46,9 (15-67) en 40,0 (7-69). Alle patiënten ondergingen van 2015 tot 2018 een chirurgische tumorresectie op onze afdeling neurochirurgie. Figuur 2 toont twee gevallen van het axiale vlak van contrastversterkte beelden bij patiënten met glioblastoom en ANA.
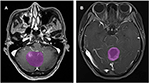
Figuur 2. Voorbeelden van twee gevallen van de contrast-verrijkte MR-beelden bij patiënten met glioblastoom en ANA. (A) Contrast-versterkte beelden met ANA, (B) contrast-versterkte beelden met glioblastoom. ANA, Anaplastisch astrocytoom.
Glioblastoma vs. ANA
Er waren drie modellen geanalyseerd in deze studie, waaronder Afstandscorrelatie + LDA, LASSO + LDA, GBDT + LDA. De textuurkenmerken die werden gebruikt voor de classificatie in deze modellen werden getoond in aanvullende tabel 3. De prestaties van elk model werden gepresenteerd in Tabel 1 (inclusief gevoeligheid, specificiteit, nauwkeurigheid, en AUC van de training en de validatie groep). LASSO + LDA behaalde de beste prestaties met de hoogste AUC’s in zowel de training- als de validatiegroep. De gevoeligheid, specificiteit, nauwkeurigheid en AUC voor de trainingsgroep waren respectievelijk 0,989, 0,993, 0,996, en 0,997; en voor de validatiegroep waren ze respectievelijk 0,927, 0,989, 0,968, en 0,974. Bovendien vertoonden Afstandscorrelatie + LDA en GBDT + LDA ook veelbelovend vermogen om glioblastoom van ANA te discrimineren, met AUC ≥0,95 voor zowel de trainingsgroepen als de validatiegroepen.

Tabel 1. Discriminatie tussen glioblastoma en ANA.
Figuur 3 toont de relatie tussen de canonieke discriminatiefuncties van LASSO + LDA modellen voor de glioblastoma en ANA groepen (driehoeken en cirkels) en voor de groep centroids (vierkanten). Minimale overlapping werd waargenomen in deze figuur. Kwalitatief kon de analyse van de door LASSO geselecteerde gegevens glioblastoma van ANA scheiden. Figuur 4 toont de verdeling van de directe LDA-functie bepaald voor het glioblastoom en ANA voor een van de 100 onafhankelijke training cycli in de data-analyse ter illustratie van de prestaties van de LASSO + LDA-model. Er waren duidelijke verschuivingen van de LDA-functiewaarden, met een verschuiving naar links voor ANA en naar rechts voor glioblastoma.
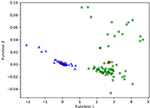
Figuur 3. Verband tussen de canonieke discriminatiefuncties van LASSO + LDA-modellen voor de glioblastoom- en ANA-groepen (driehoeken en cirkels) en voor de centroïden van de groepen (vierkanten). Minimale overlapping werd waargenomen in deze figuur. Kwalitatief kon de analyse van de door LASSO geselecteerde gegevens glioblastoma van ANA scheiden. LASSO, minst absolute krimp- en selectieoperator; LDA, lineaire discriminantanalyse; ANA, anaplastisch astrocytoom.
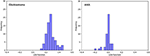
Figuur 4. Verdeling van de directe LDA-functie bepaald voor het glioblastoom en ANA voor één van de 100 onafhankelijke trainingscycli in de gegevensanalyse ter illustratie van de prestaties van het LASSO + LDA-model. Er waren duidelijke verschuivingen van de LDA-functiewaarden, met een verschuiving naar links voor ANA en naar rechts voor glioblastoma. Er is een minimale overlapping tussen de twee groepen en een sterke kwalitatieve gelijkenis tussen de plots voor cycli en driehoeken. LDA, lineaire discriminantanalyse; ANA, anaplastisch astrocytoom; LASSO, minst absolute krimp en selectie operator.
Discussie
De differentiële diagnose vóór de behandeling tussen glioblastoom en ANA is belangrijk gezien het aanzienlijke verschil in behandelingsstrategie en prognose van de patiënt. MR scan, het belangrijkste radiologische preoperatieve onderzoek voor hersentumoren, wordt sterk aanbevolen vanwege de goede gevoeligheid in laesie detectie. Echter, de nauwkeurige diagnose voor de operatie is nog steeds een uitdaging te wijten aan de reden dat beide tumoren presenteren vergelijkbare kenmerken op conventionele MR beelden die voorbij het menselijk blote oog beoordeling (4, 5). In deze studie hebben we textuurkenmerken geëxtraheerd die de beelden kwantitatief beschrijven om het gebruik van MR-onderzoek te maximaliseren, waarmee drie op LDA gebaseerde modellen werden vastgesteld. De resultaten toonden aan dat MRI-gebaseerde textuuranalyse in combinatie met het LDA-algoritme de haalbare differentiatie tussen glioblastoma en ANA mogelijk kon maken.
TA is een wiskundige benadering om de heterogeniteit van de voxelwaarde op beelden te karakteriseren. Het zou kunnen visualiseren ruimtelijke histologische heterogeniteit die onzichtbaar is voor het menselijk oog beoordeling (21). Theoretisch kunnen de kenmerken van laesiebeelden kwantitatief worden geanalyseerd als textuurkenmerken vanwege hun verschillende versterkte patronen op MR-beelden (22). Bovendien suggereerden eerdere studies dat de textuurkenmerken een reeks abnormale pathologieprocessen van tumor, zoals oedeem, effusie en necrose, zouden kunnen weerspiegelen, waardoor een potentieel mechanisme voor textuurkenmerken in het discrimineren van glioblastoma van ANA (23, 24).
Artificiële intelligentie is op grote schaal verkend in recente onderzoeken. In combinatie met textuurkenmerken uit beelden, werd gemeld dat het kan helpen bij tumorgradering, klinische diagnose en voorspelling van het resultaat. Een studie gericht op het evalueren van de diagnostische prestaties van TA-gebaseerde machine-learning algoritmen bij het differentiëren van PCNSL van glioblastoma presenteerde optimale prestaties met de gemiddelde AUC van 0,921, terwijl de AUC van drie lezers allemaal <0,8 waren. Aldus concludeerden de onderzoekers dat de diagnostische prestaties van TA-gebaseerde machine-learning algoritmen superieur waren aan die van menselijke lezers (25). Andere studies met een soortgelijk doel toonden ook soortgelijke resultaten aan met AUC’s hoger dan 0,85 (18, 26). Bovendien rapporteerden onderzoekers die machinaal leren wilden toepassen bij de indeling van astrocytomen ook veelbelovende mogelijkheden voor discriminatie (27). In onze studie werden de classificatiemodellen opgesteld op basis van LDA-algoritmen. LDA is een statistische classificator die ingevoerde parameters combineert tot een discriminerende functie om gevallen in verschillende groepen in te delen (28). Onze resultaten toonden aan dat LDA-gebaseerd model veelbelovende prestaties vertegenwoordigde in nauwkeurige diagnose tussen glioblastoma en ANA.
De vaststelling van optimale kenmerken voor machine learning algoritmen was een uitdaging, maar was noodzakelijk ten opzichte van diagnostische prestaties. Eerdere studies voeren feature selectie met verschillende methoden: Mann-Whitney U test met AUC van ROC, Student’s t-test met recursieve feature eliminatie, random forest, en entropie-gebaseerde discretisatie, respectievelijk (18, 25, 29, 30). Op basis van de resultaten van deze studies kunnen we concluderen dat de geschikte selectiemethode een sleutelrol speelt in de prestaties van de classificator. In onze studie werden een relatief groot aantal parameters uit verschillende matrices geëxtraheerd, wat de kans op selectie van de optimale kenmerken verhoogt, maar ook de moeilijkheidsgraad van de selectie verhoogt. Daarom werden drie methoden voor het selecteren van kenmerken (Afstandscorrelatie, LASSO en GBDT) geëvalueerd om de methode met de beste prestaties te selecteren. De resultaten van deze studie toonden aan dat LASSO+LDA het geschikte discriminatieve model was voor glioblastoma van ANA met de hoogste AUC in de testgroep van 0,997. LASSO werd voorgesteld als een niet-lineaire variabelenselectiemethode voor neurale netwerken in eerdere studie met het voordeel van het minimaliseren van de gemeenschappelijke som van gekwadrateerde fouten. Het kan interpreteerbare modellen produceren (vergelijkbaar met de subselectie) en tegelijkertijd de stabiliteit van ridge regressie vertonen. Eerdere studies toonden aan dat deze methode beter presteerde dan andere state-of-the-art variabele selectiemethoden (31). We moeten de resultaten echter voorzichtig interpreteren: de extra informatiewinst uit de vergelijking van verschillende technieken voor machinaal leren is vrij beperkt, vooral omdat alle onderzochte classificatie-/feature-selectiemethoden vrij vergelijkbaar lijken te presteren en de variantie in AUC misschien gedeeltelijk wordt toegeschreven aan de statistische groep. Daarom kan onze studie alleen worden beschouwd als het genereren van hypothesen voor toekomstige, grotere studies.
Er waren enkele beperkingen van onze studie. Ten eerste, als een retrospectieve single-center studie, de bias in de selectie van patiënten was onvermijdelijk. Ten tweede, het aantal geïncludeerde patiënten was relatief klein, en een groter aantal patiënten was nodig in verdere studies om de resultaten te valideren. Ten derde wordt ANA nu onderverdeeld in drie categorieën volgens de 2016 World Health Organization Classification of Central Nervous System Tumors: IDH-mutant, IDH- wildtype, en NOS (32). Het vermogen van machine learning in het discrimineren van subtypes van ANA moesten worden onderzocht in toekomstige studies. Ten vierde, de machine learning modellen in onze studie waren niet daadwerkelijk gevalideerd in andere datasets. We hebben geen andere datasets van instellingen overgenomen omdat textuurkenmerken anders kunnen zijn wanneer ze worden geëxtraheerd uit beelden die zijn verkregen met verschillende scanners of protocollen. Dit kan worden beschouwd als een tweesnijdend zwaard. Enerzijds zou een reeks gecontroleerde variabelen kunnen worden verstrekt, anderzijds zou niet kunnen worden gegarandeerd dat de resultaten op grote schaal kunnen worden toegepast. Het analyseprotocol en de beeldverwerkingsprocedure waren open-source pakketten en studie met een grote populatie zijn nodig om onze resultaten te valideren en te reproduceren.
Conclusie
In dit werk hebben we kwantitatieve parameters geëxtraheerd uit contrast-verrijkte MR-beelden en drie feature-selectiemethoden gebruikt om de meest discriminerende parameters te selecteren. Vervolgens hebben we LDA algoritme toegepast om de geselecteerde parameters te analyseren. Onze studie toont aan dat textuurkenmerken een veelbelovend vermogen hebben om glioblastoma van ANA te onderscheiden. Multi-center studies met een groter aantal patiënten zijn gerechtvaardigd om dit voorlopige resultaat te bevestigen.
Data Availability
Wij zijn blij om onze gegevens te delen met alle gekwalificeerde onderzoekers zonder onnodig voorbehoud. Neem contact op met corresponderende auteur als er iets is dat ze nodig hebben.
Ethics Statement
De studies met menselijke deelnemers werden beoordeeld en goedgekeurd door de Ethische Commissie van Sichuan University. Schriftelijke geïnformeerde toestemming voor deelname aan deze studie werd verleend door de wettelijke voogd/naaste verwanten van de deelnemers. Schriftelijke geïnformeerde toestemming werd verkregen van de individu(en), en de wettelijke voogd/naaste verwanten van de minderjarige(n), voor de publicatie van mogelijk identificeerbare beelden of gegevens die in dit artikel zijn opgenomen.
Bijdragen van auteurs
ZT, CC, JX, en XM droegen bij aan de conceptie en het ontwerp van de studie. CC en XO registreerden in aanmerking komende patiënten en verkregen medische dossiers en MRI-beelden van elke patiënt. YF en ZT deden de analyse van de textuur. JW stelde de modellen op en voerde andere statistische analyses uit. ZT schreef de eerste versie van het manuscript. CC schreef delen van het manuscript. Alle auteurs droegen bij aan de revisie van het manuscript, lazen en keurden de ingediende versie goed.
Conflict of Interest Statement
De auteurs verklaren dat het onderzoek werd uitgevoerd in afwezigheid van commerciële of financiële relaties die zouden kunnen worden opgevat als een potentieel belangenconflict.
Supplementary Material
Het Supplementary Material voor dit artikel is online te vinden op: https://www.frontiersin.org/articles/10.3389/fonc.2019.00876/full#supplementary-material
Afkortingen
ANA, Anaplastisch astrocytoom; LDA, lineaire discriminantanalyse; MRI, Magnetic Resonance Imaging; MR, Magnetische Resonantie; LASSO, Least absolute shrinkage and selection operator; GBDT, Gradient correlation decision tree; CSF, Cerebrospinale vloeistof; TA, Textuuranalyse; ROI, Regio’s van belang; HISTO, Histogram-gebaseerde matrix; GLCM, Grey-level co-occurrence matrix; GLRLM, Grey-level run length matrix; GLZLM, Grey-level zone length matrix; NGLDM, Neighborhood grey-level dependence matrix; AUC, Area under the receiver operating characteristic curve; PCNSL, Primary central nervous system lymphoma; MLP, Multilayer perceptron; IDH, Isocitrate dehydrogenase.
1. Torre LA, Bray F, Siegel RL, Ferlay J, Lortet-Tieulent J, Jemal A. Global cancer statistics, 2012. CA Cancer J Clin. (2015) 65:87-108. doi: 10.3322/caac.21262
PubMed Abstract | CrossRef Full Text | Google Scholar
2. Chen W, Zheng R, Baade PD, Zhang S, Zeng H, Bray F, et al. Cancer statistics in China, 2015. CA Cancer J Clin. (2016) 66:115-32. doi: 10.3322/caac.21338
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Wen PY, Kesari S. Maligne gliomen bij volwassenen. N Engl J Med. (2008) 359:492-507. doi: 10.1056/NEJMra0708126
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Grimm SA, Chamberlain CM. Anaplastisch astrocytoom. CNS Oncol. (2016) 5:145-57. doi: 10.2217/cns-2016-0002
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Batash R, Asna N, Schaffer P, Francis N, Schaffer M. Glioblastoma multiforme, diagnose en behandeling; recent literatuuroverzicht. Curr Med Chem. (2017) 24:3002-9. doi: 10.2174/0929867324666170516123206
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Weller M, van den Bent M, Hopkins K, Tonn JC, Stupp R, Falini AE, et al. EANO-richtlijn voor de diagnose en behandeling van anaplastische gliomen en glioblastomen. Lancet Oncol. (2014) 15:e395-403. doi: 10.1016/s1470-2045(14)70011-7
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Souhami L, Seiferheld W, Brachman D, Podgorsak EB, Werner-Wasik M, Lustig R, et al. Randomized comparison of stereotactic radiosurgery followed by conventional radiotherapy with carmustine to conventional radiotherapy with carmustine for patients with glioblastoma multiforme: report of Radiation Therapy Oncology Group 93-05 protocol. Int J Radiat Oncol Biol Phys. (2004) 60:853-60. doi: 10.1016/j.ijrobp.2004.04.011
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Burger PC, Heinz ER, Shibata T, Kleihues P. Topografische anatomie en CT correlaties in de onbehandelde glioblastoma multiforme. J Neurosurg. (1988) 68:698-704. doi: 10.3171/jns.1988.68.5.0698
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Wick W, Platten M, Meisner C, Felsberg J, Tabatabai G, Simon M, et al. Temozolomide chemotherapy alone versus radiotherapy alone for malignant astrocytoma in the elderly: the NOA-08 randomised, phase 3 trial. Lancet Oncol. (2012) 13:707-15. doi: 10.1016/s1470-2045(12)70164-x
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Chen W, Silverman HD. Advances in evaluation of primary brain tumors. Semin Nucl Med. (2008) 38:240-50. doi: 10.1053/j.semnuclmed.2008.02.005
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Burger PC, Vogel FS, Green SB, Strike AT. Glioblastoma multiforme en anaplastisch astrocytoom. Pathologische criteria en prognostische implicaties. Cancer. (1985) 56:1106-11.
PubMed Abstract | Google Scholar
12. Omuro A, DeAngelis ML. Glioblastoma and other malignant gliomas: a clinical review. JAMA. (2013) 310:1842-50. doi: 10.1001/jama.2013.280319
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Lakhman Y, Veeraraghavan H, Chaim J, Feier D, Goldman DA, Moskowitz CS, et al. Differentiatie van uterus leiomyosarcoom van atypisch leiomyoom: diagnostische nauwkeurigheid van kwalitatieve MR beeldvormingskenmerken en haalbaarheid van textuuranalyse. Eur Radiol. (2017) 27:2903-15. doi: 10.1007/s00330-016-4623-9
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Skogen K, Schulz A, Dormagen JB, Ganeshan B, Helseth E, Server A. Diagnostic performance of texture analysis on MRI in grading cerebral gliomas. Eur J Radiol. (2016) 85:824-9. doi: 10.1016/j.ejrad.2016.01.013
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Gibbs P, Turnbull WL. Textural analysis of contrast-enhanced MR images of the breast. Magn Reson Med. (2003) 50:92-8. doi: 10.1002/mrm.10496
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Castellano G, Bonilha L, Li LM, Cendes F. Textuuranalyse van medische beelden. Clin Radiol. (2004) 59:1061-9. doi: 10.1016/j.crad.2004.07.008
PubMed Abstract | CrossRef Full Text | Google Scholar
17. Davnall F, Yip CS, Ljungqvist G, Selmi M, Ng F, Sanghera B, et al. Assessment of tumor heterogeneity: an emerging imaging tool for clinical practice? Insights Imaging. (2012) 3:573-89. doi: 10.1007/s13244-012-0196-6
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Xiao DD, Yan PF, Wang YX, Osman MS, Zhao YH. Glioblastoma and primary central nervous system lymphoma: preoperative differentiation by using MRI-based 3D texture analysis. Clin Neurol Neurosurg. (2018) 173:84-90. doi: 10.1016/j.clineuro.2018.08.004
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Itakura H, Achrol AS, Mitchell LA, Loya JJ, Liu T, Westbroek EM, et al. Magnetic resonance image features identify glioblastoma phenotypic subtypes with distinct molecular pathway activities. Sci Transl Med. (2015) 7:303ra138. doi: 10.1126/scitranslmed.aaa7582
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Nioche C, Orlhac F, Boughdad S, Reuze S, Goya-Outi J, Robert C, et al. LIFEx: a freeware for radiomic feature calculation in multimodality imaging to accelerate advances in the characterization of tumor heterogeneity. Cancer Res. (2018) 78:4786-9. doi: 10.1158/0008-5472.Can-18-0125
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Hu LS, Ning S, Eschbacher JM, Gaw N, Dueck AC, Smith KA, et al. Multi-parametric MRI and texture analysis to visualize spatial histologic heterogeneity and tumor extent in glioblastoma. PLoS ONE. (2015) 10:e0141506. doi: 10.1371/journal.pone.0141506
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Florez E, Nichols T, Parker EE, Lirertte ST, Howard CM, Fatemi A. Multiparametric magnetic resonance imaging in the assessment of primary brain tumors through radiomic features: a metric for guided radiation treatment planning. Cureus. (2018) 10:e3426. doi: 10.7759/cureus.3426
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Mahmoud-Ghoneim D, Alkaabi MK, de Certaines JD, Goettsche MF. The impact of image dynamic range on texture classification of brain white matter. BMC Med Imaging. (2008) 8:18. doi: 10.1186/1471-2342-8-18
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Ahn SY, Park CM, Park SJ, Kim HJ, Song C, Lee SM, et al. Prognostic value of computed tomography texture features in non-small cell lung cancers treated with definitive concomitant chemoradiotherapy. Invest Radiol. (2015) 50:719-25. doi: 10.1097/rli.000000000174
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Suh HB, Choi YS, Bae S, Ahn SS, Chang JH, Kang SG, et al. Primary central nervous system lymphoma and atypical glioblastoma: Differentiation using radiomics approach. Eur Radiol. (2018) 28:3832-9. doi: 10.1007/s00330-018-5368-4
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Mouthuy N, Cosnard G, Abarca-Quinones J, Michoux N. Multiparametric magnetic resonance imaging to differentiate high-grade gliomas and brain metastases. J Neuroradiol. (2012) 39:301-7. doi: 10.1016/j.neurad.2011.11.002
PubMed Abstract | CrossRef Full Text | Google Scholar
27. Glotsos D, Spyridonos P, Cavouras D, Ravazoula P, Dadioti PA, Nikiforidis G. An image-analysis system based on support vector machines for automatic grade diagnosis of brain-tumour astrocytomas in clinical routine. Med Inform Internet Med. (2005) 30:179-93. doi: 10.1080/14639230500077444
PubMed Abstract | CrossRef Full Text | Google Scholar
28. Dellacasa Bellingegni A, Gruppioni E, Colazzo G, Davalli A, Sacchetti R, Guglielmelli E, et al. NLR, MLP, SVM, en LDA: een vergelijkende analyse op EMG data van mensen met trans-radiale amputatie. J Neuroeng Rehabil. (2017) 14:82. doi: 10.1186/s12984-017-0290-6
PubMed Abstract | CrossRef Full Text | Google Scholar
29. Ion-Margineanu A, Van Cauter S, Sima DM, Maes F, Sunaert S, Himmelreich U, et al. Classifying glioblastoma multiforme follow-up progressive vs. responsive forms using multi-parametric MRI features. Front Neurosci. (2016) 10:615. doi: 10.3389/fnins.2016.00615
PubMed Abstract | CrossRef Full Text | Google Scholar
30. Fetit AE, Novak J, Peet AC, Arvanitits NT. Three-dimensional textural features of conventional MRI improve diagnostic classification of childhood brain tumors. NMR Biomed. (2015) 28:1174-84. doi: 10.1002/nbm.3353
PubMed Abstract | CrossRef Full Text | Google Scholar
31. Sun K, Huang SH, Wong DS, Jang SS. Design and application of a variable selection method for multilayer perceptron neural network with LASSO. IEEE Trans Neural Netw Learn Syst. (2017) 28:1386-96. doi: 10.1109/tnnls.2016.2542866
PubMed Abstract | CrossRef Full Text | Google Scholar
32. Louis DN, Perry A, Reifenberger G, von Deimling A, Figarella-Branger D, Cavenee WK, et al. De 2016 World Health Organization classificatie van tumoren van het centrale zenuwstelsel: een samenvatting. Acta Neuropathol. (2016) 131:803-20. doi: 10.1007/s00401-016-1545-1
PubMed Abstract | CrossRef Full Text | Google Scholar




