3.3: Particelle subatomiche – Elettroni, Protoni e Neutroni
Identificazione e localizzazione delle particelle subatomiche
Nel 1897, il fisico inglese J. J. Thomson (1856-1940) dimostrò che gli atomi non erano la forma più elementare della materia. I suoi esperimenti prevedevano l’uso di tubi a raggi catodici (CRT). In un ambiente sotto vuoto, questi dispositivi producono raggi invisibili che hanno origine da un elettrodo negativo (catodo) e continuano verso un elettrodo positivo (anodo). In questi esperimenti, Thomson dimostrò che i raggi catodici potevano essere deviati, o piegati, da campi magnetici o elettrici, il che indicava che i raggi catodici sono composti da particelle cariche. Ancora più importante, misurando l’entità della deflessione dei raggi catodici in campi magnetici o elettrici di varia intensità, Thomson fu in grado di calcolare il rapporto massa/carica delle particelle. Poiché le cariche simili si respingono e quelle opposte si attraggono, Thomson concluse che le particelle avevano una carica netta negativa; queste particelle sono ora chiamate elettroni. Più rilevante per il campo della chimica, Thomson trovò che il rapporto massa/carica dei raggi catodici è indipendente dalla natura degli elettrodi metallici o del gas, il che suggerì che gli elettroni erano componenti fondamentali di tutti gli atomi.
Durante gli anni 1910, gli esperimenti con i raggi X portarono a questa utile conclusione: la grandezza della carica positiva nel nucleo di ogni atomo di un particolare elemento è la stessa. In altre parole, tutti gli atomi dello stesso elemento hanno lo stesso numero di protoni. Inoltre, elementi diversi hanno un numero diverso di protoni nei loro nuclei, quindi il numero di protoni nel nucleo di un atomo è caratteristico di un particolare elemento. Questa scoperta fu così importante per la nostra comprensione degli atomi che il numero di protoni nel nucleo di un atomo è chiamato numero atomico. Questi esperimenti furono eseguiti da Ernest Rutherford. Gli si attribuisce il merito di aver definito una posizione centrale dell’atomo che ora è stata chiamata nucleo.
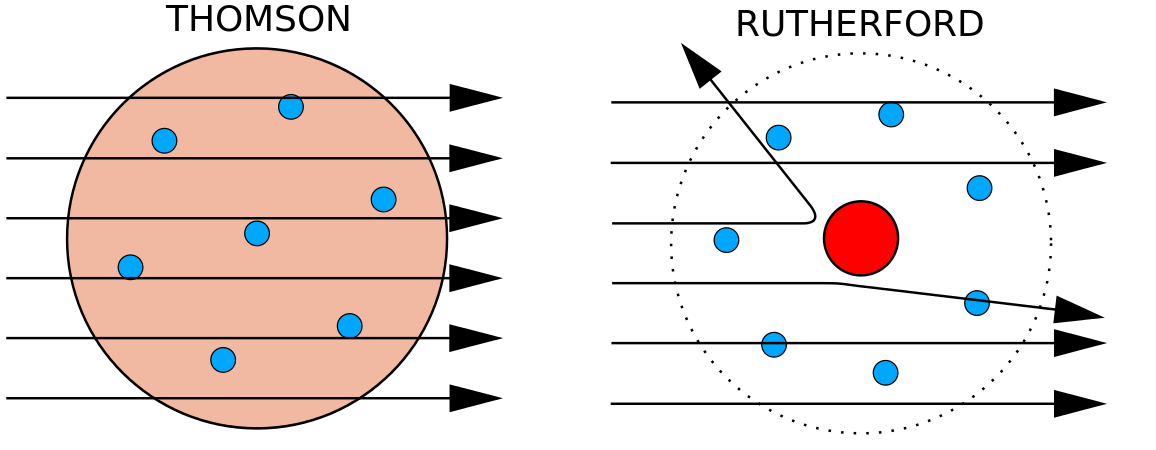
Rutherford era consapevole che i protoni erano all’interno di questa regione. Uno dei colleghi di Ernest Rutherford, James Chadwick, eseguì e studiò le reazioni radioattive del berillio. Colpendo un nucleo di berillio con particelle alfa, veniva emessa una particella di neutrone. Nel 1932, James Chadwick annunciò l’esistenza di una terza particella subatomica, il neutrone. Questa particella ha una massa di 1 unità di massa atomica, ma non ha alcuna carica. Dopo questa scoperta, la scienza e la tecnologia nucleare iniziarono immediatamente.
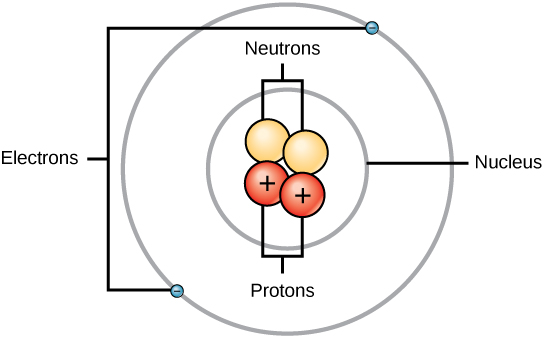
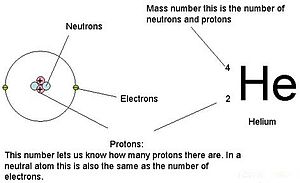
Le masse delle tre particelle subatomiche possono essere espresse in amu (unità di massa atomica) o grammi. Per semplicità, useremo l’unità amu per le tre subatomiche. Sia ai neutroni che ai protoni sono assegnate masse di 1 amu ciascuno. Al contrario, l’elettrone ha una massa trascurabile di .0005 amu. La massa di questa subatomica non è rappresentata nella massa decimale che appare sulla tavola periodica. Solo i protoni e i neutroni contribuiscono al valore della massa di un atomo.
it:User:Materialscientist)
Per gli atomi (specie neutre), il numero di elettroni è equivalente al numero di protoni. Di conseguenza, tutti gli atomi hanno una carica complessiva pari a zero. Per la discussione degli ioni (atomi che guadagnano o perdono elettroni), si veda l’ultima parte di questo capitolo. Gli atomi che differiscono in neutroni e valori di massa dalla tabella sono chiamati isotopi. Queste specie particolari possono essere viste nella seguente sezione del testo.
| Particella subatomica | Simbolo | Carica relativa | Localizzazione | Massa Amu |
|---|---|---|---|---|
| Protone | p | +1 | all’interno del nucleo | 1 |
| Neutrone | n | 0 | all’interno del nucleo | 1 |
| Elettrone | e- | -1 | fuori dal nucleo | 0.0005 (~0) |
Esempio \(\PageIndex{1})
Qual è vero?
- Il nucleo contiene protoni ed elettroni.
- La massa di un elettrone è inclusa nella massa dell’atomo
- Per un atomo, il numero di protoni = numero di elettroni.
Soluzione
- Falso, il nucleo contiene i protoni e i neutroni. Gli elettroni sono fuori dal nucleo.
- Falso, gli elettroni non contribuiscono al numero di massa di un atomo.
- Vero, tutti gli atomi sono neutri e devono avere lo stesso numero di protoni ed elettroni.




