Chimica
La formazione di una soluzione è un esempio di processo spontaneo, un processo che si verifica in condizioni specifiche senza la richiesta di energia da qualche fonte esterna. A volte mescoliamo una miscela per accelerare il processo di dissoluzione, ma questo non è necessario; una soluzione omogenea si formerebbe se aspettassimo abbastanza a lungo. L’argomento della spontaneità è criticamente importante per lo studio della termodinamica chimica e viene trattato più approfonditamente in un capitolo successivo di questo testo. Ai fini della discussione di questo capitolo, sarà sufficiente considerare due criteri che favoriscono, ma non garantiscono, la formazione spontanea di una soluzione:
- una diminuzione dell’energia interna del sistema (un cambiamento esotermico, come discusso nel capitolo precedente sulla termochimica)
- un aumento del disordine nel sistema (che indica un aumento dell’entropia del sistema, come imparerai nel capitolo successivo sulla termodinamica)
Nel processo di dissoluzione, un cambiamento di energia interna spesso, ma non sempre, si verifica quando il calore viene assorbito o sviluppato. Un aumento del disordine risulta sempre quando si forma una soluzione.
Quando le forze delle forze di attrazione intermolecolari tra le specie di soluto e solvente in una soluzione non sono diverse da quelle presenti nei componenti separati, la soluzione si forma senza alcun cambiamento energetico di accompagnamento. Una tale soluzione è chiamata soluzione ideale. Una miscela di gas ideali (o di gas come l’elio e l’argon, che si avvicinano al comportamento ideale) è un esempio di soluzione ideale, poiché le entità che compongono questi gas non sperimentano attrazioni intermolecolari significative.
Quando contenitori di elio e argon sono collegati, i gas si mescolano spontaneamente per diffusione e formano una soluzione (Figura 2). La formazione di questa soluzione implica chiaramente un aumento del disordine, poiché gli atomi di elio e di argon occupano un volume doppio rispetto a quello che ciascuno occupava prima della miscelazione.
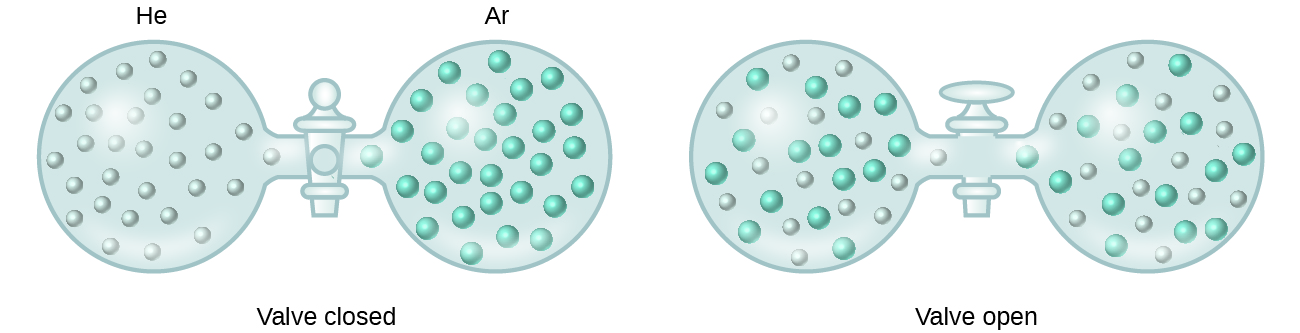
Soluzioni ideali possono formarsi anche quando liquidi strutturalmente simili vengono mescolati. Per esempio, le miscele degli alcoli metanolo (CH3OH) ed etanolo (C2H5OH) formano soluzioni ideali, così come le miscele degli idrocarburi pentano, C5H12, ed esano, C6H14. Mettendo il metanolo e l’etanolo, o il pentano e l’esano, nei bulbi mostrati nella figura 2, si avrà la stessa diffusione e il successivo mescolamento di questi liquidi che si osserva per i gas He e Ar (anche se ad una velocità molto più lenta), producendo soluzioni senza cambiamenti significativi di energia. A differenza di una miscela di gas, tuttavia, i componenti di queste soluzioni liquido-liquido sperimentano effettivamente forze attrattive intermolecolari. Ma poiché le molecole delle due sostanze mescolate sono strutturalmente molto simili, le forze attrattive intermolecolari tra molecole simili e diverse sono essenzialmente le stesse, e il processo di dissoluzione, quindi, non comporta alcun aumento o diminuzione apprezzabile di energia. Questi esempi illustrano come la diffusione da sola può fornire la forza motrice necessaria per causare la formazione spontanea di una soluzione. In alcuni casi, tuttavia, le grandezze relative delle forze intermolecolari di attrazione tra le specie soluto e solvente possono impedire la dissoluzione.
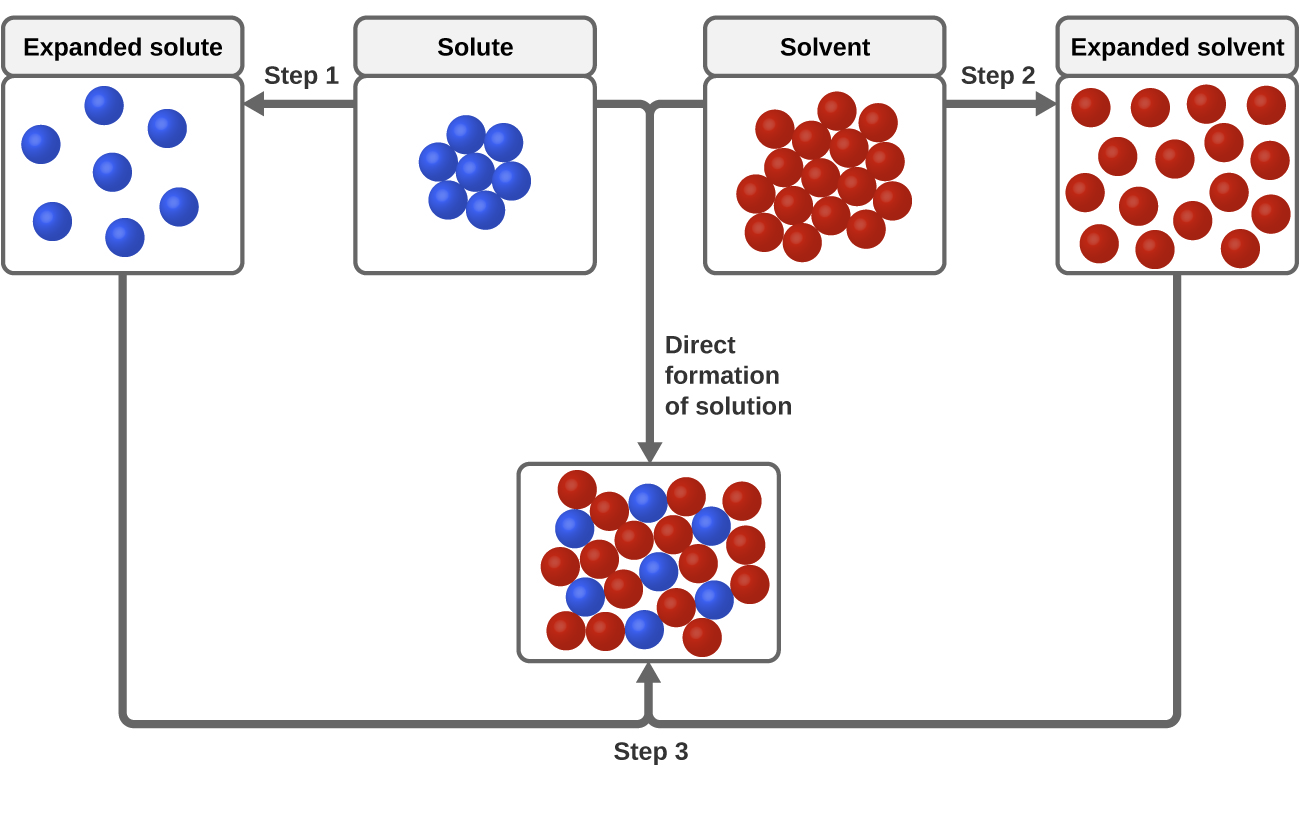
Tre tipi di forze attrattive intermolecolari sono rilevanti per il processo di dissoluzione: soluto-soluto, solvente-solvente, e soluto-solvente. Come illustrato nella figura 3, la formazione di una soluzione può essere vista come un processo graduale in cui l’energia viene consumata per superare le attrazioni soluto-soluto e solvente-solvente (processi endotermici) e rilasciata quando le attrazioni soluto-solvente sono stabilite (un processo esotermico indicato come solvatazione). Le grandezze relative dei cambiamenti di energia associati a questi processi graduali determinano se il processo di dissoluzione nel suo complesso rilascerà o assorbirà energia. In alcuni casi, le soluzioni non si formano perché l’energia richiesta per separare le specie di soluto e solvente è talmente maggiore dell’energia rilasciata dalla solvatazione.
Per esempio, gli oli da cucina e l’acqua non si mescolano in misura apprezzabile per produrre soluzioni (Figura 4). Il legame idrogeno è la forza attrattiva intermolecolare dominante presente nell’acqua liquida; le molecole idrocarburiche non polari degli oli da cucina non sono in grado di legarsi a idrogeno, essendo invece tenute insieme da forze di dispersione. La formazione di una soluzione olio-acqua richiederebbe il superamento del legame a idrogeno molto forte nell’acqua, così come le forze di dispersione molto forti tra le molecole di olio relativamente grandi. E, poiché le molecole d’acqua polari e le molecole d’olio non polari non subirebbero un’attrazione intermolecolare molto forte, verrebbe rilasciata pochissima energia dalla solvatazione.

D’altra parte, una miscela di etanolo e acqua si mescolerà in qualsiasi proporzione per produrre una soluzione. In questo caso, entrambe le sostanze sono in grado di legarsi a idrogeno, e quindi il processo di solvatazione è sufficientemente esotermico da compensare le separazioni endotermiche delle molecole di soluto e solvente.
Come notato all’inizio di questo modulo, la formazione spontanea di soluzioni è favorita, ma non garantita, da processi di dissoluzione esotermici. Mentre molti composti solubili, infatti, si dissolvono con il rilascio di calore, alcuni si dissolvono endotermicamente. Il nitrato di ammonio (NH4NO3) è uno di questi esempi ed è usato per fare impacchi freddi istantanei per il trattamento di lesioni come quello illustrato nella figura 5. Un sacchetto di plastica a parete sottile di acqua è sigillato dentro un sacchetto più grande con NH4NO3 solido. Quando il sacchetto più piccolo viene rotto, si forma una soluzione di NH4NO3 che assorbe il calore dall’ambiente circostante (l’area ferita a cui viene applicato l’impacco) e fornisce una compressione fredda che diminuisce il gonfiore. Le dissoluzioni endotermiche come questa richiedono un apporto di energia maggiore per separare le specie di soluti rispetto a quella che si recupera quando i soluti sono solvatati, ma sono comunque spontanee a causa dell’aumento del disordine che accompagna la formazione della soluzione.


Guarda questo breve video che illustra i processi di dissoluzione endotermici ed esotermici.
Concetti chiave e riassunto
Una soluzione si forma quando due o più sostanze si uniscono fisicamente per produrre una miscela che è omogenea a livello molecolare. Il solvente è il componente più concentrato e determina lo stato fisico della soluzione. I soluti sono gli altri componenti tipicamente presenti in concentrazioni inferiori a quelle del solvente. Le soluzioni possono formarsi endotermicamente o esotermicamente, a seconda delle grandezze relative delle forze di attrazione intermolecolare di soluto e solvente. Le soluzioni ideali si formano senza cambiamenti apprezzabili di energia.
Esercizi di fine capitolo di chimica
- Come differiscono le soluzioni dai composti? Da altre miscele?
- Quali delle principali caratteristiche delle soluzioni possiamo vedere nelle soluzioni di K2Cr2O7 mostrate in Figura 1?
- Quando il KNO3 è dissolto in acqua, la soluzione risultante è significativamente più fredda dell’acqua originaria.
(a) La dissoluzione del KNO3 è un processo endotermico o esotermico?
(b) Quali conclusioni puoi trarre sulle attrazioni intermolecolari coinvolte nel processo?
(c) La soluzione risultante è una soluzione ideale?
- Fai un esempio di ciascuno dei seguenti tipi di soluzioni:
(a) un gas in un liquido
(b) un gas in un gas
(c) un solido in un solido
- Indica i tipi più importanti di attrazioni intermolecolari in ciascuna delle seguenti soluzioni:
(a) La soluzione in Figura 1.
(b) NO(l) in CO(l)
(c) Cl2(g) in Br2(l)
(d) HCl(aq) in benzene C6H6(l)
(e) Metanolo CH3OH(l) in H2O(l)
- Prevedere se ciascuna delle seguenti sostanze sarebbe più solubile in acqua (solvente polare) o in un idrocarburo come l’eptano (C7H16, solvente non polare):
(a) olio vegetale (non polare)
(b) alcol isopropilico (polare)
(c) bromuro di potassio (ionico)
- Il calore viene rilasciato quando si formano alcune soluzioni; il calore viene assorbito quando si formano altre soluzioni. Fornisci una spiegazione molecolare per la differenza tra questi due tipi di processi spontanei.
- Soluzioni di idrogeno nel palladio possono essere formate esponendo il metallo Pd al gas H2. La concentrazione di idrogeno nel palladio dipende dalla pressione del gas H2 applicata, ma in modo più complesso di quanto possa essere descritto dalla legge di Henry. In certe condizioni, 0,94 g di idrogeno gassoso è dissolto in 215 g di palladio metallico.
(a) Determinare la molarità di questa soluzione (densità della soluzione = 1,8 g/cm3).
(b) Determinare la molarità di questa soluzione (densità della soluzione = 1,8 g/cm3).
(c) Determinare la percentuale in massa di atomi di idrogeno in questa soluzione (densità della soluzione = 1,8 g/cm3).




