Cloruro di sodio, NaCl
Il classico caso di legame ionico, la molecola di cloruro di sodio si forma dalla ionizzazione di atomi di sodio e cloro e l’attrazione degli ioni risultanti.
Un atomo di sodio ha un elettrone 3s fuori da un guscio chiuso, e ci vogliono solo 5,14 elettronvolt di energia per rimuovere quell’elettrone. Al cloro manca un elettrone per riempire un guscio, e rilascia 3,62 eV quando acquisisce quell’elettrone (la sua affinità elettronica è 3,62 eV). Questo significa che ci vogliono solo 1,52 eV di energia per donare uno degli elettroni del sodio al cloro quando sono lontani. Quando gli ioni risultanti vengono avvicinati, la loro energia potenziale elettrica diventa sempre più negativa, raggiungendo -1,52 eV a circa 0,94 nm di separazione. Questo significa che se gli atomi neutri di sodio e cloro si trovassero più vicini di 0,94 nm, sarebbe energeticamente favorevole trasferire un elettrone da Na a Cl e formare il legame ionico.
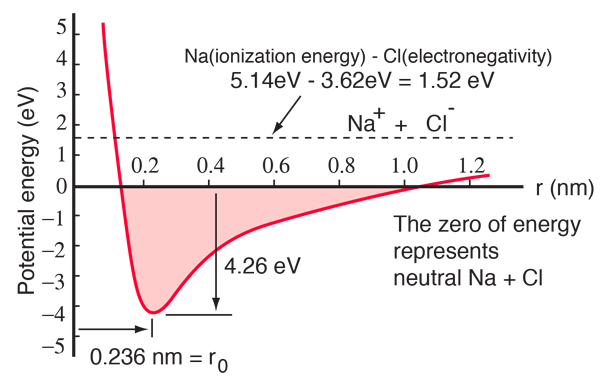
La curva dell’energia potenziale mostra che c’è un minimo a 0,236 nm di separazione e poi un ripido aumento del potenziale che rappresenta una forza repulsiva. Questa forza repulsiva è più di una semplice repulsione elettrostatica tra le nuvole di elettroni dei due atomi. Ha un carattere quantomeccanico radicato nel principio di esclusione di Pauli, e viene spesso chiamata semplicemente “repulsione da principio di esclusione”. Quando gli ioni sono molto separati, le funzioni d’onda dei loro elettroni centrali non si sovrappongono significativamente e possono avere numeri quantici identici. Man mano che si avvicinano, la sovrapposizione crescente delle funzioni d’onda fa sì che alcuni siano forzati in stati di energia superiore. Non ci sono due elettroni che possono occupare lo stesso stato, quindi quando si forma un nuovo insieme di stati energetici per il sistema composito a due nuclei, gli stati di energia inferiore vengono riempiti e alcuni degli elettroni vengono spinti in stati superiori. Questo richiede energia e viene vissuto come una repulsione, impedendo agli ioni di avvicinarsi l’uno all’altro.
Il diagramma di potenziale qui sopra è per il NaCl gassoso, e l’ambiente è diverso nel normale stato solido dove il cloruro di sodio (il comune sale da cucina) forma cristalli cubici. La separazione degli ioni è di 0,28 nm, un po’ più grande di quella nello stato gassoso.
Una parte importante dello studio della struttura molecolare è la descrizione dei legami chimici che si formano tra gli atomi. Gli studi classici sono gli estremi del legame ionico nel cloruro di sodio e il legame covalente nella molecola di idrogeno.
| Legami chimici | Ripulsione di Pauli nei legami ionici |
Esempio di energia di legame




