Frontiers in Oncology
Introduzione
Glioblastoma e astrocitoma anaplastico (ANA) sono due dei più comuni tumori primari del cervello negli adulti (1). C’è un vero aumento dei tassi di incidenza, soprattutto negli anziani (1-3). Nella pratica clinica, è difficile differenziare i pazienti con glioblastoma da quelli con ANA prima della chirurgia o della biopsia, perché i sintomi e i segni dei due tumori sono relativamente uniformi e aspecifici (4, 5). Tuttavia, la gestione per loro sono diversi, come il protocollo di chemioterapia, dosaggio e modalità di somministrazione (6). Per esempio, per i pazienti con ANA (WHO grado III), si raccomanda di ricevere la radioterapia o TMZ dopo la resezione o la biopsia; mentre per i pazienti con nuova diagnosi di glioblastoma (WHO grado IV), è la radioterapia più TMZ concomitante, seguita da TMZ adiuvante. Secondo studi precedenti, il glioblastoma e l’ANA crescono per invasione nel tessuto cerebrale normale, si diffondono attraverso il liquido cerebrospinale (CSF) e si estendono oltre una singola distribuzione dell’arteria carotidea o vertebrale, quindi entrambi hanno una scarsa risposta alla gestione medica e diventano le principali cause di morte per cancro negli adulti (7, 8). Inoltre, la prognosi del glioblastoma e dell’ANA sono diverse. Nella popolazione anziana, non c’è una differenza significativa nella prognosi tra glioblastoma e ANA, ma la differenza può esistere nella popolazione più giovane (9). Pertanto, è difficile ma cruciale distinguere il glioblastoma dall’ANA.
La risonanza magnetica (MRI) è il neuroimaging ottimale nella diagnosi preoperatoria del glioblastoma e dell’ANA per la sua capacità multiplanare e il contrasto superiore dei tessuti molli. Anche se alcuni studi hanno dimostrato che la presenza di potenziamento anulare e necrosi è suggestiva del glioblastoma, nella maggior parte dei casi, sia il glioblastoma che l’ANA appaiono come forme irregolari sulle immagini RM (iperdense sulla sequenza T2-pesata e ipodense sulla sequenza T1-pesata) con vari gradi di potenziamento del contrasto a base di Gd ed edema, di cui le differenze sono solitamente impercettibili all’occhio umano (10-12).
Di recente, l’analisi delle texture (TA), conosciuta anche come radiomica, è stata ampiamente applicata in diversi campi. I ricercatori hanno scoperto che l’AT è un metodo fattibile e promettente per facilitare la diagnosi differenziale, dal momento che ha permesso l’acquisizione di ulteriori informazioni quantitative dalle immagini MR che erano invisibili alla valutazione umana (13-15). La TA descrive la distribuzione di frequenza e l’organizzazione spaziale del valore del voxel per rivelare le possibili differenze nel tessuto tumorale (16). Studi precedenti hanno esplorato la fattibilità dell’applicazione dell’AT nella diagnosi differenziale, nella classificazione dei sottotipi di tumore e nel rilevamento dell’eterogeneità del tessuto tumorale (17-19). A nostra conoscenza, l’applicazione dell’AT nella diagnosi differenziale tra glioblastoma e ANA non è stata ancora riportata. Lo scopo di questo studio è stato quello di valutare la capacità discriminativa dell’analisi delle texture della risonanza magnetica utilizzando algoritmi di apprendimento automatico per differenziare il glioblastoma e l’ANA.
Materiali e metodi
Selezione dei pazienti
Abbiamo cercato retrospettivamente nel database della nostra istituzione e vagliato tutti i pazienti diagnosticati istopatologicamente come glioblastoma o ANA, da gennaio 2015 a dicembre 2018. I criteri di ammissibilità per i pazienti qualificati erano: (1) diagnosi istopatologica conclusiva di glioblastoma o ANA; (2) cartelle cliniche elettroniche elaborate, in particolare materiale patologico; (3) scansione diagnostica MR presso la nostra istituzione prima della resezione chirurgica. I criteri di esclusione erano: (1) storia di malattia intracranica (ad esempio, trauma cerebrale, infezione intracranica o altri tipi di tumore cerebrale), considerando l’interferenza del tessuto cicatriziale sull’intensità delle immagini; (2) presenza di artefatti da movimento sulla risonanza magnetica; (3) storia di trattamenti prima della scansione MR (ad esempio, chirurgia, chemioterapia o radioterapia); (4) pazienti che non hanno raggiunto i criteri per la diagnosi di glioblastoma o ANA secondo il sistema di classificazione OMS 2016. Un neuropatologo senior con 10 anni di esperienza ha giudicato se il paziente soddisfaceva i criteri (il sistema di classificazione OMS 2016) per il glioblastoma o ANA. Il comitato di revisione istituzionale ha approvato questo studio retrospettivo. Il consenso informato scritto è stato ottenuto dai partecipanti arruolati in questo studio. Il comitato etico dell’Università di Sichuan e il dipartimento di radiologia della nostra istituzione hanno approvato l’utilizzo delle statistiche per questo studio.
Acquisizione delle immagini RM
Per tutti i pazienti inclusi in questo studio, erano disponibili sequenze T1 pesate con contrasto e sono state ottenute su 3.0T Siemens Trio Scanner con i seguenti parametri: TR/TE/TI = 1900/2.26/900 ms, Flip angle = 9 °, 20 fette assiali con spessore = 5 mm, FOV assiale = 25.6 × 25.6 cm2 e matrice dati = 256 × 256. L’imaging T1 pesato con contrasto ha usato gadopentetato dimeglumina (0,1 mmol/Kg) come agente di contrasto per l’immagine potenziata con contrasto, e i dati multidirezionali della risonanza magnetica potenziata con contrasto sono stati raccolti durante il tempo di intervallo continuo di 90-250 s.
estrazione della trama
Nel nostro studio, il pacchetto LifeX (http://www.lifexsoft.org) è stato usato per estrarre le caratteristiche della trama. Le immagini T1 pesate (T1C) post-contrasto sono state selezionate per ulteriori analisi grazie alla chiara rappresentazione della posizione e del confine del tumore (20). Regione di interesse (ROI) è stato disegnato manualmente slice-by-slice nel piano assiale lungo le lesioni sulle immagini con contrasto migliorato per ottenere caratteristiche texture. Due neurochirurghi esperti, ciechi alle cartelle cliniche dei pazienti e alla diagnosi istopatologica, hanno disegnato le ROI seguite da un radiologo senior e da un neurochirurgo senior. I disaccordi sono stati affrontati discutendo e consultandosi con il radiologo senior e il neurochirurgo senior. Un totale di 40 caratteristiche texture sono state estratte dalle immagini MRI, tra cui minValue, meanValue, maxValue, stdValue, e parametri derivati da sei matrici: Matrice basata sull’istogramma (HISTO), Shape, matrice di co-occorrenza a livello di grigio (GLCM), matrice di lunghezza della corsa a livello di grigio (GLRLM), matrice di lunghezza della zona a livello di grigio (GLZLM) e matrice di dipendenza a livello di grigio di vicinato (NGLDM).
Selezione delle caratteristiche
C’erano 40 caratteristiche di texture in totale derivate da sei matrici selezionate. La spiegazione delle 40 caratteristiche di texture è stata mostrata nella Tabella 1 supplementare. Le statistiche di queste caratteristiche di texture sono state mostrate nella tabella supplementare 2. La selezione delle caratteristiche è stata eseguita per determinare le caratteristiche rilevanti e quindi evitare l’overfitting. Inoltre, l’algoritmo di apprendimento automatico applicato in questo studio non poteva prendere tutte le 40 caratteristiche di texture in analisi. Tre metodi indipendenti di selezione delle caratteristiche sono stati utilizzati per selezionare le caratteristiche ottimali della texture, tra cui la correlazione di distanza, il minimo restringimento assoluto e l’operatore di selezione (LASSO) e l’albero decisionale della correlazione del gradiente (GBDT). Sono stati così formati tre sottoinsiemi di caratteristiche texture che hanno costituito tre diversi set di dati.
Classificazione
L’analisi discriminante lineare (LDA) è un metodo di classificazione robusto per separare due classi cercando la combinazione lineare di predittori che massimizza la separazione tra gruppi. In questo studio, sono stati stabiliti tre modelli di classificazione basati sull’algoritmo LDA: Correlazione di distanza + LDA, LASSO + LDA, e GBDT + LDA. I dataset sono stati alimentati nell’algoritmo LDA, rispettivamente, e in modo indipendente. Ogni set di dati è stato suddiviso in modo casuale in un gruppo di formazione e un gruppo di convalida con un rapporto di 4:1. Il modello addestrato dal gruppo di formazione è stato poi applicato al gruppo di convalida indipendente per valutare le sue prestazioni. Per valutare la robustezza dell’algoritmo LDA, la procedura è stata ripetuta per 100 cicli con un’assegnazione dei casi diversa, casuale e indipendente. Una matrice di confusione è stata determinata utilizzando l’assegnazione vera dall’istopatologia e le previsioni dell’algoritmo LDA. La sensibilità standard, la specificità, le aree sotto la curva delle caratteristiche operative del ricevitore (AUC) e l’accuratezza sono state calcolate sia per il gruppo di formazione che per quello di convalida per rivelare la capacità discriminativa dei modelli. Il confronto di tre modelli (Distance Correlation + LDA, LASSO + LDA, e GBDT + LDA) è stato effettuato per determinare il modello discriminativo ottimale per il glioblastoma e ANA. Il diagramma di flusso della classificazione MRI per caratteristiche di texture è mostrato nella Figura 1.
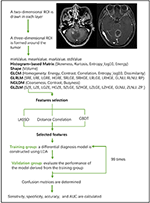
Figura 1. Diagramma di flusso della classificazione della risonanza magnetica in base alle caratteristiche della trama. ANA, astrocitoma anaplastico; LDA, analisi discriminante lineare; MRI, risonanza magnetica; LASSO, minimo assoluto restringimento e operatore di selezione; GBDT, albero di decisione di correlazione gradiente; HISTO, matrice basata su istogramma; GLCM, matrice di co-occorrenza di livello grigio; GLRLM, matrice di lunghezza di corsa di livello grigio; GLZLM, matrice di lunghezza di zona di livello grigio; NGLDM, matrice di dipendenza di livello grigio di vicinato; AUC, area sotto la curva caratteristica operativa del ricevitore.
Risultati
Caratteristiche dei pazienti
Un totale di 133 pazienti con glioblastoma (n = 76) o ANA (n = 57) ha soddisfatto i criteri di inclusione. Tutti i pazienti con glioblastoma sono stati arruolati in questo studio, mentre 10 pazienti con ANA sono stati esclusi secondo i criteri di esclusione. Infine, 76 pazienti con glioblastoma e 46 pazienti con ANA sono stati inclusi in questo studio. L’età media dei pazienti era 46,9 (15-67) e 40,0 (7-69), rispettivamente. Tutti i pazienti sono stati sottoposti a resezione chirurgica del tumore nel nostro reparto di neurochirurgia dal 2015 al 2018. La figura 2 mostra due casi del piano assiale delle immagini contrastate in pazienti con glioblastoma e ANA.
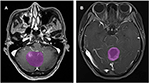
Figura 2. Esempi di due casi di immagini RM con contrasto in pazienti con glioblastoma e ANA. (A) immagini contrastate con ANA, (B) immagini contrastate con glioblastoma. ANA, astrocitoma anaplastico.
Glioblastoma vs. ANA
Ci sono stati tre modelli analizzati in questo studio, tra cui Distance Correlation + LDA, LASSO + LDA, GBDT + LDA. Le caratteristiche della texture utilizzate per la classificazione in questi modelli sono state mostrate nella tabella supplementare 3. Le prestazioni di ciascun modello sono state presentate nella tabella 1 (comprese sensibilità, specificità, accuratezza e AUC del gruppo di formazione e di convalida). LASSO + LDA ha ottenuto le migliori prestazioni con gli AUC più alti sia nel gruppo di formazione che in quello di validazione. La sensibilità, la specificità, l’accuratezza e l’AUC per il suo gruppo di formazione erano 0,989, 0,993, 0,996, e 0,997, rispettivamente; e per il gruppo di convalida, erano 0,927, 0,989, 0,968, e 0,974, rispettivamente. Inoltre, Distance Correlation + LDA e GBDT + LDA hanno anche mostrato una promettente capacità di discriminare il glioblastoma da ANA, con AUC ≥0,95 sia per i gruppi di formazione che per quelli di validazione.

Tabella 1. Discriminazione tra glioblastoma e ANA.
La figura 3 mostra la relazione tra le funzioni canoniche discriminanti dai modelli LASSO + LDA per i gruppi glioblastoma e ANA (triangoli e cerchi) e per i centroidi del gruppo (quadrati). In questa figura è stata osservata una sovrapposizione minima. Qualitativamente, l’analisi dei dati selezionati da LASSO potrebbe separare il glioblastoma da ANA. La figura 4 mostra la distribuzione della funzione LDA diretta determinata per il glioblastoma e ANA per uno dei 100 cicli di formazione indipendenti nell’analisi dei dati per illustrare le prestazioni del modello LASSO + LDA. Ci sono stati chiari spostamenti dei valori della funzione LDA, con spostamento a sinistra per ANA e spostamento a destra per il glioblastoma.
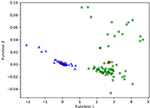
Figura 3. Relazione tra le funzioni discriminative canoniche dai modelli LASSO + LDA per i gruppi glioblastoma e ANA (triangoli e cerchi) e per i centroidi del gruppo (quadrati). In questa figura è stata osservata una sovrapposizione minima. Qualitativamente, l’analisi dei dati selezionati da LASSO potrebbe separare il glioblastoma da ANA. LASSO, minimo assoluto restringimento e operatore di selezione; LDA, analisi discriminante lineare; ANA, astrocitoma anaplastico.
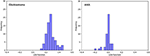
Figura 4. Distribuzione della funzione LDA diretta determinata per il glioblastoma e ANA per uno dei 100 cicli di allenamento indipendenti nell’analisi dei dati per illustrare le prestazioni del modello LASSO + LDA. Ci sono stati chiari spostamenti dei valori della funzione LDA, con spostamento a sinistra per ANA e spostamento a destra per il glioblastoma. La sovrapposizione minima è osservata tra i due gruppi e una forte somiglianza qualitativa è evidente tra i grafici per i cicli e i triangoli. LDA, analisi discriminante lineare; ANA, astrocitoma anaplastico; LASSO, minimo restringimento assoluto e operatore di selezione.
Discussione
La diagnosi differenziale pre-trattamento tra glioblastoma e ANA è importante considerando la differenza significativa nella strategia di trattamento e la prognosi del paziente. La risonanza magnetica, il principale esame radiologico preoperatorio per i tumori cerebrali, è altamente raccomandata per la buona sensibilità nell’individuazione delle lesioni. Tuttavia, la diagnosi accurata prima dell’operazione è ancora impegnativa per il motivo che entrambi i tumori presentano caratteristiche simili sulle immagini MR convenzionali che sono al di là della valutazione umana a occhio nudo (4, 5). In questo studio, abbiamo estratto le caratteristiche di texture facendo descrizione quantitativa delle immagini per massimizzare l’utilizzo dell’esame MR, con cui sono stati stabiliti tre modelli basati su LDA. I risultati hanno dimostrato che l’analisi delle texture basata sulla risonanza magnetica combinata con l’algoritmo LDA potrebbe consentire la differenziazione fattibile tra glioblastoma e ANA.
TA è un approccio matematico per caratterizzare l’eterogeneità del valore del voxel sulle immagini. Potrebbe visualizzare l’eterogeneità istologica spaziale che è invisibile alla valutazione dell’occhio umano (21). Teoricamente, le caratteristiche delle immagini delle lesioni potrebbero essere analizzate quantitativamente come caratteristiche di texture a causa dei loro diversi modelli migliorati sulle immagini MR (22). Inoltre, studi precedenti hanno suggerito che le caratteristiche di texture potrebbero riflettere una serie di processi patologici anormali del tumore come edema, effusione e necrosi, fornendo un potenziale meccanismo per le caratteristiche di texture nella discriminazione del glioblastoma da ANA (23, 24).
L’intelligenza artificiale è stata ampiamente esplorata nelle ricerche recenti. Combinata con le caratteristiche di texture estratte dalle immagini, è stata riportata per assistere nella classificazione del tumore, nella diagnosi clinica e nella previsione dell’esito. Uno studio volto a valutare le prestazioni diagnostiche degli algoritmi di apprendimento automatico basati sull’AT nel differenziare il PCNSL dal glioblastoma ha presentato prestazioni ottimali con un AUC medio di 0,921, mentre gli AUC di tre lettori erano tutti <0,8. Così, i ricercatori hanno concluso che le prestazioni diagnostiche degli algoritmi di apprendimento automatico basati sull’AT erano superiori a quelle dei lettori umani (25). Anche altri studi con finalità simili hanno dimostrato risultati simili con AUC superiori a 0,85 (18, 26). Inoltre, i ricercatori che mirano ad applicare l’apprendimento automatico nella classificazione degli astrocitomi hanno anche riportato una promettente capacità di discriminazione (27). Nel nostro studio, i modelli di classificazione sono stati stabiliti sulla base degli algoritmi LDA. LDA è il classificatore statistico che combina i parametri immessi in una funzione discriminante per classificare i casi in diversi gruppi (28). I nostri risultati hanno dimostrato che il modello basato su LDA ha rappresentato prestazioni promettenti nella diagnosi accurata tra glioblastoma e ANA.
L’adozione di caratteristiche ottimali per gli algoritmi di apprendimento automatico è stata impegnativa ma era necessaria rispetto alle prestazioni diagnostiche. Studi precedenti eseguono la selezione delle caratteristiche con vari metodi: Mann-Whitney U test con AUC di ROC, Student’s t-test con eliminazione ricorsiva delle caratteristiche, foresta casuale e discretizzazione basata sull’entropia, rispettivamente (18, 25, 29, 30). Sulla base dei risultati di questi studi, potremmo trarre la conclusione che il metodo di selezione adatto gioca un ruolo chiave nelle prestazioni del classificatore. Per quanto riguarda il nostro studio, un numero relativamente grande di parametri è stato estratto da diverse matrici, aumentando la possibilità di selezionare le caratteristiche ottimali, ma anche la difficoltà di selezione. Pertanto, sono stati valutati tre metodi di selezione delle caratteristiche (Distance Correlation, LASSO e GBDT) per selezionare quello con le migliori prestazioni. I risultati di questo studio hanno dimostrato che LASSO+LDA era il modello discriminativo adatto per il glioblastoma da ANA con il più alto AUC nel gruppo di test di 0,997. LASSO è stato proposto come un metodo di selezione delle variabili non lineare per la rete neurale in uno studio precedente con il vantaggio di minimizzare la somma comune degli errori al quadrato. Potrebbe produrre modelli interpretabili (simili alla selezione dei sottoinsiemi) quando esibisce simultaneamente la stabilità della regressione di cresta. Lo studio precedente ha illustrato che ha rappresentato una performance superiore rispetto ad altri metodi di selezione delle variabili all’avanguardia (31). Tuttavia, dobbiamo interpretare i risultati con attenzione che il guadagno aggiuntivo di informazioni dal confronto di diverse tecniche di apprendimento automatico è abbastanza limitato, in particolare dato che tutti i classificatori / metodi di selezione delle caratteristiche indagati sembrano eseguire abbastanza comparabilmente e la varianza in AUC forse parzialmente attribuita a causa del gruppo statistico. Pertanto, il nostro studio potrebbe essere considerato solo come generazione di ipotesi per futuri studi più grandi.
Ci sono state alcune limitazioni del nostro studio. In primo luogo, essendo uno studio retrospettivo monocentrico, la distorsione nella selezione dei pazienti era inevitabile. In secondo luogo, il numero di pazienti inclusi era relativamente piccolo, e un numero maggiore di pazienti era necessario in ulteriori studi per convalidare i risultati. In terzo luogo, ANA è ora diviso in tre categorie secondo la classificazione dell’Organizzazione Mondiale della Sanità 2016 dei tumori del sistema nervoso centrale: IDH-mutante, IDH- wildtype e NOS (32). La capacità del machine learning nel discriminare i sottotipi di ANA doveva essere esplorata in studi futuri. Quarto, i modelli di apprendimento automatico nel nostro studio non sono stati effettivamente convalidati in altri set di dati. Non abbiamo adottato altri set di dati dell’istituzione perché che le caratteristiche di texture potrebbero essere diverse quando estratto da immagini acquisite con vari scanner o protocolli. Questo potrebbe essere considerato come un’arma a doppio taglio. Da un lato, un insieme di variabili controllate potrebbe essere fornito; dall’altro, i risultati non potrebbero essere garantiti ampiamente applicati. Il protocollo di analisi e la procedura di elaborazione delle immagini erano pacchetti open-source e lo studio con una vasta popolazione è necessario per convalidare e riprodurre i nostri risultati.
Conclusione
In questo lavoro, abbiamo estratto i parametri quantitativi dalle immagini RM con contrasto e abbiamo usato tre metodi di selezione delle caratteristiche per selezionare i parametri più discriminanti. Poi abbiamo applicato l’algoritmo LDA per analizzare i parametri selezionati. Il nostro studio mostra che le caratteristiche della texture hanno una capacità promettente di discriminare il glioblastoma dall’ANA. Studi multicentrici con un maggior numero di pazienti sono giustificati per confermare questo risultato preliminare.
Data Availability
Siamo lieti di condividere i nostri dati con qualsiasi ricercatore qualificato senza indebite riserve. Si prega di contattare l’autore corrispondente se c’è qualcosa di cui hanno bisogno.
Dichiarazione etica
Gli studi che coinvolgono partecipanti umani sono stati rivisti e approvati dal Comitato Etico dell’Università di Sichuan. Il consenso informato scritto a partecipare a questo studio è stato fornito dal tutore legale/parente più prossimo dei partecipanti. Il consenso informato scritto è stato ottenuto dall’individuo(i), e dal tutore legale/vicino del minore(i), per la pubblicazione di qualsiasi immagine o dato potenzialmente identificabile incluso in questo articolo.
Contributi degli autori
ZT, CC, JX, e XM hanno contribuito all’ideazione e alla progettazione dello studio. CC e XO hanno arruolato i pazienti idonei e hanno ottenuto le cartelle cliniche e le immagini MRI di ogni paziente. YF e ZT hanno fatto l’analisi delle texture. JW ha stabilito i modelli ed eseguito altre analisi statistiche. ZT ha scritto la prima bozza del manoscritto. CC ha scritto sezioni del manoscritto. Tutti gli autori hanno contribuito alla revisione del manoscritto, hanno letto e approvato la versione presentata.
Conflitto di interessi
Gli autori dichiarano che la ricerca è stata condotta in assenza di relazioni commerciali o finanziarie che potrebbero essere interpretate come un potenziale conflitto di interessi.
Materiale supplementare
Il materiale supplementare per questo articolo può essere trovato online su: https://www.frontiersin.org/articles/10.3389/fonc.2019.00876/full#supplementary-material
Abbreviazioni
ANA, astrocitoma anaplastico; LDA, analisi discriminante lineare; MRI, risonanza magnetica; MR, risonanza magnetica; LASSO, Least absolute shrinkage and selection operator; GBDT, Gradient correlation decision tree; CSF, liquido cerebrospinale; TA, Texture analysis; ROI, regioni di interesse; HISTO, matrice basata sugli istogrammi; GLCM, matrice di co-occorrenza a livello di grigio; GLRLM, matrice di lunghezza della corsa a livello di grigio; GLZLM, matrice di lunghezza della zona a livello di grigio; NGLDM, matrice di dipendenza a livello di grigio di vicinato; AUC, Area sotto la curva della caratteristica operativa del ricevitore; PCNSL, Linfoma primario del sistema nervoso centrale; MLP, Perceptron multilivello; IDH, Isocitrato deidrogenasi.
1. Torre LA, Bray F, Siegel RL, Ferlay J, Lortet-Tieulent J, Jemal A. Statistiche globali sul cancro, 2012. CA Cancer J Clin. (2015) 65:87-108. doi: 10.3322/caac.21262
PubMed Abstract | CrossRef Full Text | Google Scholar
2. Chen W, Zheng R, Baade PD, Zhang S, Zeng H, Bray F, et al. Statistiche sul cancro in Cina, 2015. CA Cancer J Clin. (2016) 66:115-32. doi: 10.3322/caac.21338
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Wen PY, Kesari S. Gliomi maligni negli adulti. N Engl J Med. (2008) 359:492-507. doi: 10.1056/NEJMra0708126
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Grimm SA, Chamberlain CM. Astrocitoma anaplastico. CNS Oncol. (2016) 5:145-57. doi: 10.2217/cns-2016-0002
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Batash R, Asna N, Schaffer P, Francis N, Schaffer M. Glioblastoma multiforme, diagnosi e trattamento; recente revisione della letteratura. Curr Med Chem. (2017) 24:3002-9. doi: 10.2174/0929867324666170516123206
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Weller M, van den Bent M, Hopkins K, Tonn JC, Stupp R, Falini AE, et al. Linea guida EANO per la diagnosi e il trattamento di gliomi anaplastici e glioblastoma. Lancet Oncol. (2014) 15:e395-403. doi: 10.1016/s1470-2045(14)70011-7
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Souhami L, Seiferheld W, Brachman D, Podgorsak EB, Werner-Wasik M, Lustig R, et al. Confronto randomizzato di radiochirurgia stereotassica seguita da radioterapia convenzionale con carmustina a radioterapia convenzionale con carmustina per i pazienti con glioblastoma multiforme: rapporto del protocollo Radiation Therapy Oncology Group 93-05. Int J Radiat Oncol Biol Phys. (2004) 60:853-60. doi: 10.1016/j.ijrobp.2004.04.011
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Burger PC, Heinz ER, Shibata T, Kleihues P. Anatomia topografica e correlazioni CT nel glioblastoma multiforme non trattato. J Neurosurg. (1988) 68:698-704. doi: 10.3171/jns.1988.68.5.0698
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Wick W, Platten M, Meisner C, Felsberg J, Tabatabai G, Simon M, et al. Temozolomide chemioterapia da sola contro la sola radioterapia per l’astrocitoma maligno negli anziani: il NOA-08 randomizzato, studio di fase 3. Lancet Oncol. (2012) 13:707-15. doi: 10.1016/s1470-2045(12)70164-x
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Chen W, Silverman HD. Progressi nella valutazione dei tumori cerebrali primari. Semin Nucl Med. (2008) 38:240-50. doi: 10.1053/j.semnuclmed.2008.02.005
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Burger PC, Vogel FS, Green SB, Strike AT. Glioblastoma multiforme e astrocitoma anaplastico. Criteri patologici e implicazioni prognostiche. Cancer. (1985) 56:1106-11.
PubMed Abstract | Google Scholar
12. Omuro A, DeAngelis ML. Glioblastoma e altri gliomi maligni: una revisione clinica. JAMA. (2013) 310:1842-50. doi: 10.1001/jama.2013.280319
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Lakhman Y, Veeraraghavan H, Chaim J, Feier D, Goldman DA, Moskowitz CS, et al. Differenziazione di leiomiosarcoma uterino da leiomioma atipico: accuratezza diagnostica delle caratteristiche qualitative di imaging MR e fattibilità dell’analisi della texture. Eur Radiol. (2017) 27:2903-15. doi: 10.1007/s00330-016-4623-9
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Skogen K, Schulz A, Dormagen JB, Ganeshan B, Helseth E, Server A. Prestazioni diagnostiche di analisi delle texture su MRI nella classificazione dei gliomi cerebrali. Eur J Radiol. (2016) 85:824-9. doi: 10.1016/j.ejrad.2016.01.013
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Gibbs P, Turnbull WL. Analisi testuale delle immagini di risonanza magnetica a contrasto del seno. Magn Reson Med. (2003) 50:92-8. doi: 10.1002/mrm.10496
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Castellano G, Bonilha L, Li LM, Cendes F. Analisi della struttura delle immagini mediche. Clin Radiol. (2004) 59:1061-9. doi: 10.1016/j.crad.2004.07.008
PubMed Abstract | CrossRef Full Text | Google Scholar
17. Davnall F, Yip CS, Ljungqvist G, Selmi M, Ng F, Sanghera B, et al. Valutazione di eterogeneità del tumore: uno strumento di imaging emergente per la pratica clinica? Approfondimenti Imaging. (2012) 3:573-89. doi: 10.1007/s13244-012-0196-6
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Xiao DD, Yan PF, Wang YX, Osman MS, Zhao YH. Glioblastoma e linfoma primario del sistema nervoso centrale: differenziazione preoperatoria utilizzando l’analisi 3D texture basata su MRI. Clin Neurol Neurosurg. (2018) 173:84-90. doi: 10.1016/j.clineuro.2018.08.004
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Itakura H, Achrol AS, Mitchell LA, Loya JJ, Liu T, Westbroek EM, et al. Le caratteristiche dell’immagine di risonanza magnetica identificano sottotipi fenotipici di glioblastoma con attività distinte del percorso molecolare. Sci Transl Med. (2015) 7:303ra138. doi: 10.1126/scitranslmed.aaa7582
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Nioche C, Orlhac F, Boughdad S, Reuze S, Goya-Outi J, Robert C, et al. LIFEx: un freeware per il calcolo delle caratteristiche radiomiche nell’imaging multimodale per accelerare i progressi nella caratterizzazione dell’eterogeneità tumorale. Cancer Res. (2018) 78:4786-9. doi: 10.1158/0008-5472.Can-18-0125
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Hu LS, Ning S, Eschbacher JM, Gaw N, Dueck AC, Smith KA, et al. Multi-parametrico MRI e analisi delle texture per visualizzare l’eterogeneità istologica spaziale e l’estensione del tumore nel glioblastoma. PLoS ONE. (2015) 10:e0141506. doi: 10.1371/journal.pone.0141506
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Florez E, Nichols T, Parker EE, Lirertte ST, Howard CM, Fatemi A. Risonanza magnetica multiparametrica nella valutazione dei tumori cerebrali primari attraverso le caratteristiche radiomiche: una metrica per la pianificazione del trattamento radioattivo guidato. Cureus. (2018) 10:e3426. doi: 10.7759/cureus.3426
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Mahmoud-Ghoneim D, Alkaabi MK, de Certaines JD, Goettsche MF. L’impatto della gamma dinamica dell’immagine sulla classificazione della texture della materia bianca del cervello. BMC Med Imaging. (2008) 8:18. doi: 10.1186/1471-2342-8-18
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Ahn SY, Park CM, Park SJ, Kim HJ, Song C, Lee SM, et al. Valore prognostico delle caratteristiche della texture della tomografia computerizzata nei tumori del polmone non a piccole cellule trattati con chemioterapia concomitante definitiva. Invest Radiol. (2015) 50:719-25. doi: 10.1097/rli.00000000000174
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Suh HB, Choi YS, Bae S, Ahn SS, Chang JH, Kang SG, et al. Linfoma primario del sistema nervoso centrale e glioblastoma atipico: differenziazione con approccio radiomico. Eur Radiol. (2018) 28:3832-9. doi: 10.1007/s00330-018-5368-4
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Mouthuy N, Cosnard G, Abarca-Quinones J, Michoux N. Risonanza magnetica multiparametrica per differenziare i gliomi di alto grado e metastasi cerebrali. J Neuroradiol. (2012) 39:301-7. doi: 10.1016/j.neurad.2011.11.002
PubMed Abstract | CrossRef Full Text | Google Scholar
27. Glotsos D, Spyridonos P, Cavouras D, Ravazoula P, Dadioti PA, Nikiforidis G. Un sistema di analisi delle immagini basato su macchine vettoriali di supporto per la diagnosi automatica del grado di astrocitomi del cervello nella routine clinica. Med Inform Internet Med. (2005) 30:179-93. doi: 10.1080/14639230500077444
PubMed Abstract | CrossRef Full Text | Google Scholar
28. Dellacasa Bellingegni A, Gruppioni E, Colazzo G, Davalli A, Sacchetti R, Guglielmelli E, et al. NLR, MLP, SVM, e LDA: un’analisi comparativa su dati EMG di persone con amputazione trans-radiale. J Neuroeng Rehabil. (2017) 14:82. doi: 10.1186/s12984-017-0290-6
PubMed Abstract | CrossRef Full Text | Google Scholar
29. Ion-Margineanu A, Van Cauter S, Sima DM, Maes F, Sunaert S, Himmelreich U, et al. Classificazione glioblastoma multiforme follow-up progressivo vs forme reattive utilizzando caratteristiche multi-parametriche MRI. Fronte Neurosci. (2016) 10:615. doi: 10.3389/fnins.2016.00615
PubMed Abstract | CrossRef Full Text | Google Scholar
30. Fetit AE, Novak J, Peet AC, Arvanitits NT. Caratteristiche testuali tridimensionali della risonanza magnetica convenzionale migliorano la classificazione diagnostica dei tumori cerebrali infantili. NMR Biomed. (2015) 28:1174-84. doi: 10.1002/nbm.3353
PubMed Abstract | CrossRef Full Text | Google Scholar
31. Sun K, Huang SH, Wong DS, Jang SS. Progettazione e applicazione di un metodo di selezione variabile per rete neurale multilayer perceptron con LASSO. IEEE Trans Neural Netw Learn Syst. (2017) 28:1386-96. doi: 10.1109/tnnls.2016.2542866
PubMed Abstract | CrossRef Full Text | Google Scholar
32. Louis DN, Perry A, Reifenberger G, von Deimling A, Figarella-Branger D, Cavenee WK, et al. 2016 World Health Organization classificazione dei tumori del sistema nervoso centrale: una sintesi. Acta Neuropathol. (2016) 131:803-20. doi: 10.1007/s00401-016-1545-1
PubMed Abstract | CrossRef Full Text | Google Scholar




