Inibizione degli enzimi
Gli enzimi sono necessari per la maggior parte, se non per tutti, i processi necessari alla vita. Gli enzimi catalizzano una reazione riducendo l’energia di attivazione necessaria perché la reazione avvenga. Tuttavia, gli enzimi devono essere strettamente regolati per garantire che i livelli del prodotto non salgano a livelli indesiderati. Questo si ottiene con l’inibizione dell’enzima.
Tipi di inibizione
Gli inibitori reversibili e irreversibili sono sostanze chimiche che si legano a un enzima per sopprimere la sua attività. Un metodo per ottenere questo risultato è quello di legarsi quasi permanentemente a un enzima. Questi tipi di inibitori sono chiamati irreversibili. Tuttavia, altre sostanze chimiche possono legarsi transitoriamente a un enzima. Questi sono chiamati reversibili. Gli inibitori reversibili si legano o a un sito attivo (inibitori competitivi), o a un altro sito sull’enzima (inibitori non competitivi).
 Fig 1 – Diagramma per mostrare l’effetto degli inibitori enzimatici competitivi e non competitivi.
Fig 1 – Diagramma per mostrare l’effetto degli inibitori enzimatici competitivi e non competitivi.Inibitori competitivi
Gli inibitori competitivi competono con il substrato al sito attivo, e quindi aumentano il Km (la costante di Michaelis-Menten). Tuttavia, la Vmax rimane invariata perché, con una concentrazione sufficiente di substrato, la reazione può ancora completarsi. Il grafico dell’attività dell’enzima contro la concentrazione del substrato sarebbe spostato a destra a causa dell’aumento del Km, mentre il grafico Lineweaver-Burke sarebbe più ripido rispetto all’assenza di inibitore.
Inibitori non competitivi
Gli inibitori non competitivi si legano ad un’altra posizione dell’enzima e quindi diminuiscono il VMAX. Tuttavia, il KM è invariato. Questo è dimostrato da un massimo più basso su un grafico che traccia l’attività dell’enzima contro la concentrazione del substrato e un’intercetta y più alta su un grafico Lineweaver-Burke quando viene confrontato con nessun inibitore.
| Competitivo | Non-Competitivo | |
| Dove agisce? | Sito attivo | Sito alternativo |
| Cambio di Km | Aumento | Modificato |
| Cambiamento di Vmax | Incremento | Riduzione |
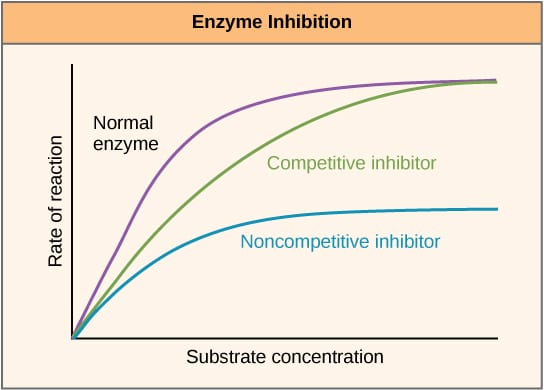 Fig 2 – Diagramma per mostrare l’effetto degli inibitori dell’enzima sul tasso di reazione e come varia con la concentrazione del substrato.
Fig 2 – Diagramma per mostrare l’effetto degli inibitori dell’enzima sul tasso di reazione e come varia con la concentrazione del substrato.Inibizione allosterica
Gli enzimi allosterici mostrano una curva sigmoidale in contrasto con la curva iperbolica degli enzimi di Michaelis-Menten. Questo perché la maggior parte degli enzimi allosterici contengono più subunità che possono influenzarsi a vicenda quando il substrato si lega all’enzima. L’inibizione può influenzare sia K0.5, che è la concentrazione di substrato per la semisaturazione, Vmax o entrambi. Questo si traduce in uno spostamento della curva verso destra, e nel caso della riduzione di Vmax, sposta la curva verso il basso.
Gli enzimi allosterici hanno due stati: uno stato a bassa affinità chiamato stato “T” e lo stato ad alta affinità “R”. Gli inibitori funzionano legandosi preferenzialmente allo stato T di un enzima allosterico, inducendo l’enzima a mantenere questo stato di bassa affinità.
Questo è estremamente utile per limitare la quantità di prodotto di un enzima, poiché il prodotto può poi andare a inibire lo stesso tipo di enzima per garantire che la quantità di prodotto non sia eccessiva. Questo è noto come inibizione a feedback. Per esempio, l’ATP inibisce allostericamente la piruvato chinasi per prevenire una maggiore formazione di piruvato, quindi alla fine si forma meno ATP. Inoltre, la fosfofruttochinasi è allostericamente inibita dal citrato, un intermedio del ciclo di Kreb. Questo significa che la glicolisi sarà limitata quando c’è un’alta generazione di ATP dal ciclo di Kreb.
 Fig 3 – Diagramma per mostrare il meccanismo di inibizione e attivazione allosterica.
Fig 3 – Diagramma per mostrare il meccanismo di inibizione e attivazione allosterica.Fosforilazione
La fosforilazione fornisce un altro meccanismo con cui gli enzimi possono essere inibiti. Questo avviene tipicamente attraverso l’azione degli enzimi chinasi, che possono inibire o attivare un enzima a seconda della situazione. Gli enzimi chinasi scindono un gruppo fosfato dall’ATP e lo legano all’enzima. In situazioni in cui questo si traduce in un aumento dell’attività dell’enzima, crea una reazione a cascata, permettendo di generare una grande risposta da un piccolo stimolo.
Zimogeni
Gli enzimi possono anche essere secreti in uno stato inattivo, che sono chiamati zimogeni. Gli zimogeni sono un meccanismo utile che permette agli enzimi di essere trasportati in modo sicuro in luoghi diversi, senza che l’enzima diventi attivo e svolga la sua funzione lungo la strada. Essi rimangono inattivi a causa di un’aggiunta di aminoacidi nella proteina. Pertanto, per attivare uno zimogeno, un altro enzima deve scindere questi aminoacidi aggiuntivi. Per esempio, il chimotripsinogeno è sintetizzato dal pancreas, ma è inattivo e non può funzionare. Quando viaggia verso l’intestino, un altro enzima (tripsina) scinde gli aminoacidi aggiuntivi per produrre la forma attivata, la chimotripsina.
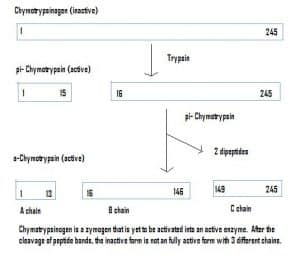 Fig 4 – Diagramma che mostra l’attivazione del chimotripsinogeno nel sistema gastrointestinale e gli enzimi coinvolti in ogni fase.
Fig 4 – Diagramma che mostra l’attivazione del chimotripsinogeno nel sistema gastrointestinale e gli enzimi coinvolti in ogni fase.Rilevanza clinica – Farmacocinetica
L’uso clinico più importante dell’inibizione enzimatica è l’uso di farmaci. Gli ACE-inibitori sono un trattamento comune per l’ipertensione. L’angiotensina I è convertita in angiotensina II dall’azione dell’enzima di conversione dell’angiotensina (ACE). Tuttavia, l’Angiotensina II causa numerosi effetti che riguardano un aumento della pressione sanguigna. Pertanto, gli ACE-inibitori sono stati progettati per inibire competitivamente l’azione dell’ACE, il che si traduce in una minore formazione di Angiotensina II e una pressione sanguigna più bassa.
In alternativa, la penicillina si lega irreversibilmente al sito attivo di un enzima chiamato DD-transpeptidasi. La DD-transpeptidasi è responsabile della fase finale della sintesi della parete cellulare batterica. Inibendo questo enzima, i batteri non possono sintetizzare una parete cellulare e quindi non possono sostenere la vita.
Infine, il cianuro è un esempio di inibitore non competitivo. Il cianuro si lega all’enzima finale della catena di trasporto degli elettroni e impedisce a questo enzima di catalizzare la reazione da ossigeno ad acqua. Questo impedisce il flusso di elettroni lungo la catena di trasporto degli elettroni e nessun ATP può essere generato, il che porta alla morte.




