CHEM 101 – Elektrolity
GENERAL CHEMISTRY TOPICS
Elektrolity
Dysocjacja związków jonowych w wodzie powoduje powstawanie ruchliwych wodnych gatunków jonowych.Równania chemiczne dla rozpuszczania i dysocjacji w wodzie. Elektrolity mocne i słabe.
Elektrolity (akompaniament muzyczny do tego tematu) to substancje, które w roztworze wodnym tworzą gatunki jonowe. Istnienie nośników ładunku w roztworze można wykazać za pomocą prostego doświadczenia. Przewodnictwo mediów wodnych można obserwować za pomocą pary elektrod, podłączonych do źródła napięcia, które są zanurzone w roztworze. Prąd przewodzony przez roztwór może być wtedy łatwo zmierzony, a żarówka może być użyta jako wizualny wskaźnik przewodności roztworu.
Gdy ten eksperyment jest wykonywany z czystą wodą, żarówka w ogóle nie świeci. Woda sama w sobie nie przewodzi łatwo prądu; jest przykładem substancji molekularnej, która jest nieelektrolitem. Podobnie jest z wieloma innymi substancjami molekularnymi. Na przykład, cukier stołowy (sacharoza, C12H22O11) – jest dość dobrze rozpuszczalny w wodzie, ale roztwór cukru najwyraźniej nie przewodzi prądu lepiej niż sama woda. Z drugiej strony, gdy przeprowadzimy eksperyment z dowolnie rozpuszczalnym związkiem jonowym, takim jak chlorek sodu, żarówka świeci jasno.
Przedstawmy to, co naszym zdaniem dzieje się z tymi kontrastującymi przypadkami rozpuszczania związku cząsteczkowego i jonowego, pisząc następujące równania chemiczne:
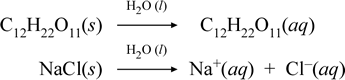
Pierwsze równanie powyżej przedstawia rozpuszczanie nieelektrolitu, związku cząsteczkowego sacharozy. Drugie równanie reprezentuje rozpuszczanie związku jonowego, chlorku sodu.Kluczową różnicą pomiędzy dwoma równaniami chemicznymi w tym przypadku jest tworzenie w drugim z nich wodnych gatunków jonowych jako produktów. Jony mogą swobodnie dyfundować indywidualnie w jednorodnej mieszaninie, a kiedy przyłożone zostanie napięcie, jony będą poruszać się zgodnie z różnicą energii elektrycznej potencjalnej między elektrodami, przenosząc w ten sposób prąd elektryczny. Zauważ, że woda nie jest pokazana po stronie reagentów w tych równaniach, ale zamiast tego jest pokazana powyżej strzałki, wskazując, że woda określa środowisko, w którym zachodzi proces rozpuszczania. Superstoichiometryczny status wody w tej symbolice może być odczytany jako proces rozpuszczania zachodzący z wodą jako rozpuszczalnikiem. Nie będziemy zapisywać wody jako reagenta w tworzeniu roztworu wodnego przez prosty proces rozpuszczania. Istnieje wiele przypadków, w których substancja reaguje z wodą podczas mieszania się z nią i rozpuszczania w niej. Taka reakcja solutu w roztworze wodnym prowadzi do powstania odrębnych chemicznie produktów. W takich przypadkach woda może być wyraźnie pokazana w równaniu chemicznym jako gatunek reagujący.
Silne i słabe elektrolity
Okazuje się, że kiedy rozpuszczalny związek jonowy, taki jak chlorek sodu, ulega rozpuszczeniu w wodzie, tworząc roztwór wodny składający się z rozpuszczonych jonów, strzałka w prawo użyta w równaniu chemicznym jest uzasadniona tym, że (tak długo jak nie została osiągnięta granica rozpuszczalności) stały chlorek sodu dodany do rozpuszczalnika wodnego całkowicie dysocjuje. Innymi słowy, w rzeczywistości następuje 100% konwersja NaCl(s) do Na+(aq) i Cl-(aq). W rezultacie, w naszym doświadczeniu z przewodnictwem, roztwór chlorku sodu jest wysoce przewodni ze względu na obfitość jonów, a żarówka świeci jasno. W takim przypadku mówimy, że chlorek sodu jest mocnym elektrolitem.
Dla kontrastu, rozważmy substancję molekularną kwas octowy, HC2H3O2.Kiedy kwas octowy rozpuszcza się w wodzie, tworzy niezdysocjowany, rozpuszczony, molekularny gatuneksymbolizowany jako HC2H3O2(aq), podobnie jak w przypadku sacharozy powyżej. Kiedy jednak przeprowadzimy naszą próbę przewodnictwa z roztworem kwasu octowego, stwierdzimy, że żarówka świeci, choć dość słabo w porównaniu z jasnością obserwowaną dla roztworu chlorku sodu. W tym przypadku musi zachodzić przynajmniej częściowe tworzenie się jonów z kwasu octowego w wodzie. Równanie chemiczne reprezentujące ten proces musi pokazywać wytwarzanie jonów. Rozsądną propozycją takiego równania byłoby:
![]()
Należy tu zwrócić uwagę na dwie rzeczy. Po pierwsze, jest to przypadek, w którym uwzględniamy wodę jako reagent. Dwie substancje molekularne, woda i kwas octowy, reagują tworząc jony wieloatomowe hydroniowy i octanowy. Przedstawiające to równanie jest równaniem jonowym. Drugą cechą, która zasługuje na dalsze omówienie, jest zastąpienie strzałki w prawo symbolem podwójnej strzałki z pojedynczą poprzeczką, oznaczającym równowagę chemiczną, a w tym przypadku warunek równowagi dla reakcji faworyzuje reagentów, co oznacza, że w roztworze wodnym kwasu octowego większość kwasu octowego pozostaje w postaci cząsteczek kwasu octowego, a tylko niewielka jego część w dowolnym momencie oddaje H+ wodzie, tworząc jony. Niewielka liczba powstających jonów wyjaśnia, dlaczego roztwór kwasu octowego nie przewodzi prądu tak dobrze jak roztwór chlorku sodu, powodując jedynie słabe świecenie żarówki naszego konduktometru. Dlatego rozróżniamy mocne elektrolity, takie jak chlorek sodu, i kwas octowy, który jest przykładem słabego elektrolitu.
Jak sugeruje nazwa kwasu octowego, substancja ta jest również kwasem, jak również słabym elektrolitem. W związku z tym, klasyfikujemy kwas octowy jako słaby kwas. Nasza pierwsza (i najmniej ogólna) definicja kwasu to substancja, która tworzy w wodzie jon hydroniowy, co właśnie pokazuje nasze powyższe równanie jonowe, pamiętając o tym, że słaby kwas tworzy stosunkowo niewielkie ilości jonu hydroniowego.
Chemicy bardzo lubią skróty, a ważnym skrótem dla jonu hydroniowego jest H+(aq), i jest on powszechnie używany. Jest to pokazane w skróconej wersji powyższego równania, które jest pokazane poniżej. Aby było jasne, sam H+ byłby tylko wyizolowanym protonem (dla 1H); dlatego ważne jest, aby zauważyć, że taki gatunek nie istnieje w roztworze wodnym.
Ponadto, strzałki mają nierówną długość, aby wskazać równowagę preferowaną przez reagenta, w której jest znacznie mniej jonów niż cząsteczek kwasu octowego.
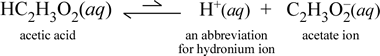
Przedstawiając hydronium jako H+(aq), równanie jonowe dla kwasu octowego w wodzie jest formalnie zrównoważone bez włączania cząsteczki wody jako reagenta, co jest implikowane w powyższym równaniu.
Amoniak: Przykład słabego elektrolitu, który jest słabą zasadą
Kwas octowy, jak właśnie widzieliśmy, jest związkiem molekularnym, który jest słabym kwasem i elektrolitem. Amoniak, NH3, inny prosty związek molekularny, również reaguje w niewielkim stopniu z wodą, tworząc jony amonowe i wodorotlenkowe. Nasza pierwsza, najmniej ogólna definicja zasady to substancja, która tworzy jony wodorotlenkowe w wodzie. Tak więc, amoniak jest słabą zasadą i podobnie jak kwas octowy, nie przewodzi prądu elektrycznego tak dobrze jak sól wodna. Tak więc amoniak jest również słabym elektrolitem.
![]()
Symbolika naszego równania chemicznego ponownie wskazuje na korzystną dla reagenta równowagę dla słabego elektrolitu.
Rozszerzenia i powiązania
Bardziej ilościowe podejście do równań wykorzystuje słabe kwasy i słabe zasady jako ważne przykłady.




