CHEM 245 – Inhibicja enzymów
BIOCHEMISTRY TOPICS
Inhibicja enzymów
Rodzaje inhibitorów i inhibicji.Odwracalne i nieodwracalne inhibitory i inhibicja. Modele i efekty kinetyczne inhibicji kompetycyjnej i niekompetycyjnej. Mieszane inhibicji.Przykłady inhibicji enzymów.
Swoistość enzymów nie jest ściśle ograniczona do substratów. Często aktywność enzymu jest obniżana przez specyficzne oddziaływania z cząsteczkami określanymi mianem inhibitorów. Inhibicja enzymów jest jednym z najważniejszych zjawisk w biochemii. Na przykład, wiele leków, antybiotyków i toksyn wywiera swoje działanie poprzez zdolność do hamowania enzymów. Inhibitory, które są strukturalnie podobne do substratu są często inhibitorami kompetycyjnymi, ponieważ konkurują o wiązanie w miejscu aktywnym. Inhibicja enzymu może być odwracalna (jak to zwykle ma miejsce, gdy inhibitor wiąże się z enzymem poprzez niekowalencyjne interakcje) lub nieodwracalna (jak to ma miejsce w wielu przypadkach, gdy inhibitory działają poprzez kowalencyjne modyfikacje enzymu, być może celując w reszty krytyczne dla katalizy).
Możemy sobie wyobrazić kilka prostych modeli odwracalnej inhibicji. Najprostszym z nich jest bezpośrednia okluzja miejsca aktywnego przez inhibitor. Byłoby to widoczne w przypadku cząsteczki o pewnym podobieństwie strukturalnym do substratu. Wiązanie substratu i inhibitora wzajemnie się wykluczają w tym modelu inhibicji kompetycyjnej.
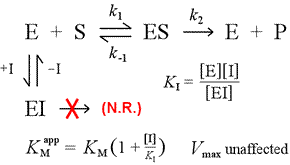
Po prawej stronie jest pokazany prosty mechanistyczny model dla konkurencyjnej inhibicji. Inhibitor, I, wiąże się tylko z wolnym enzymem E, ze stałą dysocjacji KI , i blokuje wiązanie substratu (S). Wiążąc część enzymu w nieaktywnym kompleksie EI, mniejsza jego część jest dostępna przy danym stężeniu substratu, aby połączyć się z substratem i utworzyć ES, a następnie potencjalnie przekształcić się w produkty. Obserwuje się wzrost niezbędnego do osiągnięcia ½Vmax, stąd wzrasta pozorna wartość KM.
Poprzez zwiększanie do coraz większych poziomów, substrat może przytłoczyć inhibitor, konkurując z nim o wolny enzym w stopniu umożliwiającym zbliżenie się do prawdziwego Vmax.
Możemy sobie łatwo wyobrazić, że cząsteczka, która przypomina substrat w pewnych kluczowych cechach strukturalnych, może konkurować z substratem o wiązanie w miejscu aktywnym. Nazywa się to analogiem substratu i stanowi częsty przykład konkurencyjnych inhibitorów enzymów. Jeśli sposób w jaki enzymy zwiększają szybkość reakcji polega na selektywnej stabilizacji stanu przejściowego reakcji, to jeśli możemy znaleźć cząsteczkę, która przypomina stan przejściowy (w strukturze i polarności lub ładunku), taki analog stanu przejściowego powinien być bardzo dobrym inhibitorem kompetycyjnym.
Przeciwstawimy model inhibicji kompetycyjnej inhibicji niekompetycyjnej, w której inhibitor wiąże się tylko z kompleksem enzym-substrat. Można sobie wyobrazić, że dzieje się tak w wyniku interakcji enzym-substrat typu induced-fit, w której miejsce wiązania dla inhibitora jest dostępne wyłącznie w indukowanej konformacji ES.
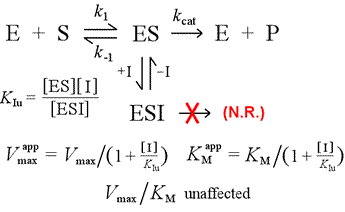
Po lewej: Mechanistyczny model inhibicji niekompetycyjnej. W tym modelu inhibitor wiąże się tylko z kompleksem ES, a nie z wolnym enzymem. Kompleks trójskładnikowy, ESI, nie przechodzi do produktów. Ma to wpływ na obniżenie pozornego Vmax. Stała dysocjacji inhibitora dla ESI jest oznaczana jako KIu. W efekcie wyjaśnionym przez zasadę Le Châteliera, pozorna KM jest niższa, ponieważ wiązanie inhibitora usuwa część produktu (ES) „równowagi” tworzenia ES.
Model inhibicji, w którym inhibitor wiąże zarówno wolny enzym, jak i kompleks enzym-substrat, to inhibicja mieszana. Stała dysocjacji inhibitora może się różnić pomiędzy E i ES (tj. KI ≠ KIu). Szczególny przypadek, w którym KI = KIu, nosi nazwę inhibicji niekompetycyjnej. Zauważmy, że w tym przypadku KM nie ulega zmianie, natomiast Vmax ulega obniżeniu.
Typy odwracalnego hamowania enzymów – podsumowanie
Widzieliśmy, że różne modele odwracalnego hamowania mogą być rozróżnione w zależności od wpływu na parametry kinetyczne. Poniższa tabela podsumowuje typy inhibicji i ich wpływ na te parametry.

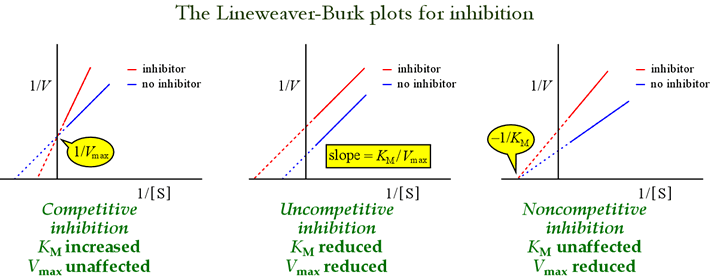
Plany Lineweaver-Burk, lub podwójna odwrotność są przydatne do identyfikacji wzorów inhibicji. Rysunek poniżej pokazuje, jak różne rodzaje inhibicji wpływają na wykres.
Przykłady inhibicji enzymów
Pierwszy i najczęściej stosowany lek, acetylosalicylan (salicylan = ortohydroksybenzoesan), powszechnie znany jako aspiryna, jest skutecznym środkiem przeciwbólowym (uśmierzającym ból), przeciwgorączkowym (obniżającym gorączkę) i przeciwzapalnym. Właściwości lecznicze kory wierzby były znane w niektórych kulturach od wieków. W XIX wieku odkryto, że składnikiem aktywnym jest połączenie alkoholu salicylowego. Na podstawie tych i innych obserwacji, a także postępów w syntezie chemicznej, aspiryna stała się dostępna w połowie wieku, po przygotowaniu jej przez Hoffmana, chemika zatrudnionego przez firmę Bayer. Bardziej nowoczesne badania wykazały, że właściwości lecznicze aspiryny wynikają głównie z jej zdolności do nieodwracalnego hamowania enzymu znanego jako cyklooksygenaza, który jest wymagany do syntezy prostaglandyn i tromboksanów.
Cyklooksygenazy katalizują pierwszy etap konwersji arachidonianu do prekursora prostaglandyn i tromboksanów, prostaglandyny G2 (PGG2, struktury i reakcja). Reakcja ta wykorzystuje dwie cząsteczki O2 i przekształca kwas tłuszczowy C20:4 w peroksydowaną cząsteczkę zawierającą pierścień cyklopentanowy (PGG2 – PG oznacza „prostaglandynę”). Enzym cyklooksygenaza posiada również aktywność hydroperoksydazy, która przekształca PGG2 w PGH2. Dlatego też „cyklooksygenaza” (COX) powinna być bardziej precyzyjnie określana jako syntaza endoperoksydazy prostaglandyny H (PGHS). Hamowanie aktywności cyklooksygenazy przez aspirynę wynika z jej zdolności do chemicznej modyfikacji reszty serynowej (Ser530) enzymu. Reszta serynowa otrzymuje od aspiryny grupę acetylową, co jest modyfikacją nieodwracalną. Tak więc aspiryna jest przykładem nieodwracalnego inhibitora. Istnieją właściwie dwie izozymy COX: forma konstytutywna, COX-1 (PGHS-1), i forma indukowana (w warunkach zapalenia), COX-2 (PGHS-2). Niesteroidowe leki przeciwzapalne (NLPZ), takie jak aspiryna, ibuprofen i naproksen, hamują obie izoformy. W konsekwencji leki te wywołują niepożądane efekty uboczne, np. podrażnienie przewodu pokarmowego. Dlatego też aktualnym celem badań farmakologicznych jest opracowanie inhibitorów specyficznych dla COX-2, efektu, który, jak się uważa, pośredniczy w większości przeciwbólowych i przeciwzapalnych efektów leków z grupy NLPZ.
Powiązane strony tematyczne:
- introductory chemical kinetics
- introductory enzymology
- kinetyka enzymatyczna
- równanie Michaelisa-Mentena
.




