Chlorek sodu, NaCl
Klasyczny przypadek wiązania jonowego, cząsteczka chlorku sodu powstaje w wyniku jonizacji atomów sodu i chloru oraz przyciągania się powstałych w ten sposób jonów.
An atom sodu ma jeden elektron 3s poza zamkniętą powłoką, i to trwa tylko 5.14 elektronowoltów energii, aby usunąć ten elektron. Chlorowi brakuje jednego elektronu do wypełnienia powłoki, i uwalnia 3.62 eV kiedy nabywa ten elektron (jego powinowactwo elektronowe wynosi 3.62 eV).Oznacza to, że potrzeba tylko 1.52 eV energii aby oddać jeden z elektronów sodu do chloru kiedy są daleko od siebie. Kiedy powstałe jony są zbliżane do siebie, ich elektryczna energia potencjalna staje się coraz bardziej ujemna, osiągając -1,52 eV przy około 0,94 nm separacji. Oznacza to, że gdyby neutralne atomy sodu i chloru znalazły się bliżej niż 0,94 nm, korzystne energetycznie byłoby przeniesienie elektronu z Na do Cl i utworzenie wiązania jonowego.
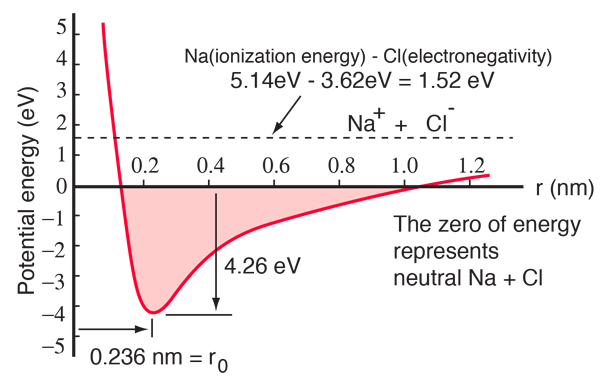
Krzywa energii potencjalnej pokazuje, że istnieje minimum przy separacji 0,236 nm, a następnie gwałtowny wzrost potencjału, który reprezentuje siłę odpychającą. Ta siła odpychająca jest czymś więcej niż tylko elektrostatycznym odpychaniem pomiędzy chmurami elektronowymi dwóch atomów. Ma ono charakter kwantowo-mechaniczny, zakorzeniony w zasadzie wykluczania Pauliego i często nazywane jest po prostu „odpychaniem z zasady wykluczania”. Gdy jony są od siebie bardzo oddalone, funkcje falowe ich elektronów jądra nie nakładają się znacząco i mogą mieć identyczne liczby kwantowe. W miarę zbliżania się do siebie, coraz większe nakładanie się funkcji falowych powoduje, że niektóre z nich są zmuszane do przechodzenia w wyższe stany energetyczne. Żadne dwa elektrony nie mogą zajmować tego samego stanu, więc gdy nowy zestaw stanów energetycznych jest tworzony dla złożonego układu dwóch jąder, niższe stany energetyczne są wypełniane, a niektóre elektrony są wypychane do wyższych stanów. Wymaga to energii i jest odczuwane jako odpychanie, co zapobiega zbliżaniu się jonów do siebie.
Potencjał diagram powyżej jest dla gazowego NaCl, i środowisko jest inne w normalnym stanie stałym, gdzie chlorek sodu (wspólna sól kuchenna) tworzy sześcienne kryształy. Separacja jonów wynosi 0,28 nm, nieco większa niż w stanie gazowym.
Główną częścią badania struktury molekularnej jest opis wiązań chemicznych, które są tworzone między atomami. Klasycznymi badaniami są skrajne przypadki wiązania jonowego w chlorku sodu i wiązania kowalencyjnego w cząsteczce wodoru.
| Wiązania chemiczne | Odpychanie Pauliego w wiązaniach jonowych |
Przykład energii wiązania




