Frontiers in Neuroscience
Wprowadzenie
Generowanie nowych neuronów w dorosłym hipokampie, regionie mózgu zaangażowanym w nawigację przestrzenną i tworzenie pamięci (Buzsaki i Moser, 2013), jest uderzającą formą plastyczności, która utrzymuje się przez całe życie u kilku gatunków, w tym u ludzi (Altman i Das, 1965; Eriksson i in., 1998; Moreno-Jiménez i in., 2019). Spośród wielu warunków regulujących neurogenezę hipokampa u dorosłych, jednym z najbardziej wiarygodnych procesów, który został szeroko opisany, jest uwarunkowany wiekiem spadek produkcji neuronów, podczas gdy wcześniej istniejące populacje neuronów pozostają niezmienne wraz z normalnym starzeniem się (Kuhn i in., 1996; Kempermann i in., 1998; Burke i Barnes, 2010). Starzenie się wpływa na wiele funkcji w mózgu, w tym transmisję synaptyczną i plastyczność, które, jak się uważa, przyczyniają się do utraty pamięci (Burke i Barnes, 2006; Fan i in., 2017). Biorąc pod uwagę, że hipokamp jest szczególnie podatny na zmiany związane z wiekiem i neurodegenerację, znalezienie strategii zwiększających plastyczność w tej strukturze staje się istotne w celu zapobiegania lub łagodzenia skutków starzenia się (Bartsch i Wulff, 2015). Ćwiczenia fizyczne i bodźce poznawcze poprawiają zdrowie mózgu i mają tendencję do łagodzenia efektów starzenia się. Jedna z bezpośrednich korzyści może wynikać z zależnego od aktywności wzrostu poziomu czynnika neurotroficznego pochodzenia mózgowego (brain-derived neurotrophic factor, BDNF), który, jak wykazano, przywraca plastyczność synaptyczną, zwiększa neurogenezę i poprawia uczenie się u myszy w średnim wieku (Marlatt i in., 2012; Trinchero i in., 2017). Ćwiczenia zmniejszają również aktywację mikrogleju, zwiększają zależną od aktywności plastyczność synaptyczną, proliferację neuronalnych komórek progenitorowych oraz przyspieszają rozwój i integrację urodzonych w dorosłym wieku komórek ziarnistych (granule cells, GCs) w starzejącym się hipokampie (van Praag i in., 2005; Kronenberg i in., 2006; O’Callaghan i in., 2009; Marlatt i in., 2012; Gebara i in., 2013). Efekty te przyczyniają się do przywrócenia plastyczności zależnej od hipokampa i korelują z zachowaniami adaptacyjnymi. Tak więc, starzejące się zwierzęta, które słabo radzą sobie w zadaniach związanych z uczeniem się przestrzennym i separacją wzorców, poprawiają swoje wyniki po ćwiczeniach (van Praag i in., 2005; Marlatt i in., 2012; Wu i in., 2015; Duzel i in., 2016; Xu i in., 2017).
Stopień, w jakim neurogeneza przyczynia się do pozytywnych efektów behawioralnych ćwiczeń u starzejących się zwierząt, jest wciąż przedmiotem badań. Możliwe jest, że wzrost tempa neurogenezy wywierany przez ćwiczenia fizyczne przyczynia się do poprawy zachowania. Jednak w grę mogą wchodzić również inne mechanizmy (Meshi i in., 2006). Przyspieszona po ćwiczeniach integracja nowych neuronów w starzejącym się zakręcie zębatym, która modyfikuje jakość nowych GC, może również przyczyniać się do poprawy zachowania. Podczas gdy neurony urodzone u myszy w średnim wieku rozwijają się powoli, długotrwałe dobrowolne ćwiczenia promują wzrost dendrytów, tworzenie się spine’ów i integrację neuronów (Trinchero i in., 2017). Podobne efekty zaobserwowano dzięki krótkiej ekspozycji na wzbogacenie środowiska (EE) (Trinchero i in., 2019). Jeśli skumulowane w wielu kohortach neuronalnych, przyspieszona integracja neuronalna wywołana przez ćwiczenia może wywierać znaczący wpływ na zależne od hipokampa uczenie się i zachowanie. W tej pracy wykazujemy, że kilka kohort nowych GC może być szybko zintegrowanych z istniejącymi wcześniej obwodami myszy, które nadal angażują się w dobrowolne bieganie, i że te efekty utrzymują się po tym, jak myszy przestały biegać.
Materiały i metody
Mice i chirurgia
Myszy samce C57BL/6J były trzymane w 4-5 zwierząt na klatkę w standardowych warunkach. Ośmiomiesięczne (8M) myszy zostały wybrane, ponieważ po przekroczeniu tego wieku następuje silny spadek neurogenezy hipokampa, który wyklucza badanie znakowanych neuronów (Morgenstern i in., 2008; Trinchero i in., 2017). Myszy znieczulano (150 μg ketaminy/15 μg ksylazyny w 10 μl soli fizjologicznej/g), a retrowirus infuzowano do przegrodowego regionu prawego girusa zębatego (1,5 μl z prędkością 0,15 μl/min) za pomocą sterylnych skalibrowanych pipet mikrokapilarnych poprzez operację stereotaksji; współrzędne od bregmy (w mm): -2 anteroposterior, -1,5 lateral, and -1,9 ventral. We wskazanym czasie mózgi zostały utrwalone, a sekcje przygotowane do obrazowania konfokalnego (Trinchero i in., 2017). Do analizy włączono tylko GCs z septal dentate gyrus, odpowiadające sekcjom zlokalizowanym od -0,96 do -2,30 mm od bregmy, zgodnie z atlasem mózgu myszy (Paxinos i Franklin, 2001). Protokoły eksperymentalne zostały zatwierdzone przez Institutional Animal Care and Use Committee of Fundación Instituto Leloir, zgodnie z Zasadami badań biomedycznych z udziałem zwierząt Rady Międzynarodowych Organizacji Nauk Medycznych oraz przepisami zawartymi w Przewodniku dotyczącym opieki nad zwierzętami laboratoryjnymi i ich wykorzystywania.
Bieganie
Dystanse biegowe były rejestrowane dla każdego eksperymentu przy użyciu bezprzewodowych kółek biegowych. W doświadczeniach przedstawionych na rycinie 1 zwierzęta trzymano z kołem biegowym przez 7 lub 21 dni, jak wskazano. W tych warunkach myszy przebiegały ∼2 km/dzień. Na rysunkach 2, 3, w których myszy biegały przez 1, 2 lub 3 miesiące, monitorowany dystans wynosił ∼10 km/dzień.
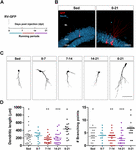
Rysunek 1. Długie, ale nie krótkie okresy biegu przyspieszają morfologiczne dojrzewanie nowych GC. (A) Projekt eksperymentu. Po wstrzyknięciu RV-GFP nastąpiła ekspozycja na 1 tydzień dobrowolnego biegu we wskazanych oknach lub przez cały eksperyment (0-21 dpi). (B) Reprezentatywne obrazy GCs z ekspresją GFP (czerwony) z 21-dpi, pobrane z grupy siedzącej i z grupy 0-21 biegającej. NeuN (niebieski) oznacza warstwę komórek ziarnistych (GCL) (ML, warstwa molekularna). Pasek skali, 50 μm. (C) Reprezentatywne obrazy konfokalne GFP-GCs z 21-dpi dla różnych grup. Pasek skali, 50 μm. (D) Złożoność dendrytów (długość i punkty rozgałęzień) dla różnych okien operacyjnych. ∗, ∗∗, i ∗∗∗ oznaczają p < 0.05, p < 0.01, i p < 0.001 w porównaniu z grupą biegnącą 0-21 po teście Kruskala-Wallisa i teście post hoc Dunna. Nie stwierdzono różnic między żadną z grup biegających przez 7 dni. Liczebność próbek (neurony/mysz): 27/3 (Sed), 14/3 (0-7), 27/3 (7-14), 22/3 (14-21) i 15/3 (0-21). Słupki poziome oznaczają średnią ± SEM. Otwarte kółka odpowiadają przykładowym neuronom.
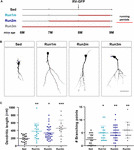
Rysunek 2. Wpływ biegu na różne kohorty neuronów. (A) Projekt eksperymentu. Po wstrzyknięciu RV-GFP nastąpiły 3 tygodnie biegu i poprzedzone warunkami siedzącymi (Run1m), 1 (Run2m), lub 2 miesiące biegu (Run3m). Wszystkie grupy porównano z myszami prowadzącymi siedzący tryb życia (Sed). Całkowitą długość dendrytów analizowano w 21 dpi. (B) Reprezentatywne obrazy konfokalne GFP-GCs. Pasek skali, 50 μm. (C) Złożoność dendrytów (długość i punkty rozgałęzień) dla różnych okien biegania. ∗, ∗∗, i ∗∗∗ oznaczają p < 0,05, p < 0,01 i p < 0,001 w porównaniu z Sed po teście Kruskala-Wallisa, a następnie teście post hoc Dunna. Liczebność próbek (neurony/mysz): 20/3 (Sed), 19/3 (Run1m), 31/3 (Run2m) i 15/3 (Run3m). Słupki poziome oznaczają średnią ± SEM. Otwarte kółka odpowiadają przykładowym neuronom.

Rysunek 3. Trwałe efekty przewlekłych ćwiczeń fizycznych. (A) Projekt eksperymentu. Po wstrzyknięciu RV-GFP nastąpiły 3 tygodnie biegania (Run1m) lub poprzedzone 1 miesiącem ćwiczeń (Run-1m) lub 1 miesiącem ćwiczeń i 1 miesiącem bez koła biegowego (Run-2m). Wszystkie grupy porównano z myszami siedzącymi (Sed). Całkowitą długość dendrytów analizowano w 21 dpi. (B) Reprezentatywne obrazy konfokalne znakowanych GCs. Pasek skali, 50 μm. (C) Złożoność dendrytów (długość i punkty rozgałęzień) dla różnych okien operacyjnych. ∗∗∗∗ oznacza p < 0,001 w porównaniu do Sed po teście Kruskala-Wallisa, a następnie teście post hoc Dunna. Liczebność próbek (neurony/mice): 33/4 (Sed), 39/4 (Run1m), 15/4 (Run-1m) i 18/3 (Run-2m). (D) Morfologia MFB w CA3 została przeanalizowana dla grup Run1m i Run-1m i porównana z Sed. Reprezentatywne obrazy konfokalne. Pasek skali, 5 μm. (E) ∗ i ∗∗ oznaczają p < 0,05 i p < 0,01 po teście Kruskala-Wallisa, a następnie teście post hoc Dunna. Liczebność próbek: 27/4 (Sed), 32/4 (Run1m) i 18/4 (Run-1m). Słupki poziome oznaczają średnią ± SEM. Otwarte kółka odpowiadają przykładowym boutonom.
Immunofluorescencja
Immunobarwienie wykonano na 60-μm swobodnie pływających przekrojach koronalnych. Przeciwciała nakładano w soli fizjologicznej buforowanej trisem (TBS) z 3% surowicą oślą i 0,25% Tritonem X-100. Immunofluorescencję przeprowadzono z użyciem przeciwciał anty GFP (poliklon królika; 1:500; Invitrogen), anty NeuN (monoklonalne mysie; 1:50; dar od F.H. Gage, Salk Institute for Biological Studies, La Jolla, CA, Stany Zjednoczone), przeciwciał osioł anty-rabbit Cy3 i osioł anty-mouse Cy5 (1:250; Jackson Immuno Research Laboratories).
Mikroskopia Konfokalna
Do pomiarów długości dendrytów obrazy pozyskiwano (40×; NA 1,3; oil-immersion) z przekrojów o grubości 60-μm, wykonując stosy Z obejmujące 35-50 plasterków optycznych, jednostka airy = 1 w odstępach 0,8-μm (Trinchero i in., 2017). Długość dendrytów była następnie mierzona za pomocą oprogramowania LSM Image Browser z projekcji trójwymiarowych rekonstrukcji na pojedynczą płaszczyznę w GCs wyrażających GFP. Obrazy MFB znakowanych GFP w regionie CA3 uzyskano w odstępach 0,4 μm (63×; NA 1,4; oil-immersion) przy powiększeniu cyfrowym 6. Obszar i liczbę filopodiów analizowano na podstawie projekcji trójwymiarowych rekonstrukcji na pojedynczą płaszczyznę. Do kwantyfikacji wybrano boutony włókien mszystych (MFB), które spełniały następujące kryteria: (i) średnica boutonu była >trzykrotnie większa niż średnica włókna, (ii) bouton był połączony z włóknem mszystym przynajmniej na jednym końcu (Toni i in., 2008). Filopodia były identyfikowane jako wypukłości powstające z dużych terminali mszystych (1 μm < długość < 20 μm) (Acsady i in., 1998). Rozszerzenia filopodialne mierzono licząc liczbę występów na terminal. Do przechwytywania obrazów i analizy właściwości morfologicznych wszystkie badane grupy eksperymentalne były ślepe dla operatora.
Analiza statystyczna
Jeśli nie określono inaczej, dane przedstawiono jako średnie ± SEM. Normalność oceniano za pomocą testu Shapiro-Wilksa, testu omnibus D’Agostino-Pearsona i testu Kołmogorowa-Smirnowa, przy wartości p równej 0,05. Gdy dane spełniały testy normalności (rozkład gaussowski i równość wariancji), stosowano test t niesparowanych z poprawką Welcha lub ANOVA z testem post hoc Bonferroniego. W przypadkach nie spełniających normalności stosowano następujące testy nieparametryczne: test Manna-Whitneya dla porównań niezależnych oraz test Kruskala-Wallisa dla porównań wielokrotnych.
Wyniki
Wcześniej wykazaliśmy, że bieganie przyspiesza rozwój i integrację funkcjonalną nowych GC w starzejącym się hipokampie (Trinchero i in., 2017). Teraz zbadaliśmy, czy ten rodzaj plastyczności wymaga trwałego poziomu aktywności, który kumuluje się w czasie, czy też krótsze okresy biegania mogą również wyzwalać szybszą integrację, jak wcześniej zaobserwowano w przypadku ekspozycji na EE (Trinchero i in., 2019). Aby odpowiedzieć na to pytanie, nowe kohorty neuronów zostały oznakowane u myszy w średnim wieku (8 miesięcy życia; 8M) za pomocą retrowirusa wyrażającego GFP (RV-GFP). Myszom pozwolono używać koła do biegania przez 1 tydzień w różnych oknach rozwoju neuronów, lub biegać przez cały okres wzrostu neuronów (3 tygodnie; Figury 1A,B). Jak opisano wcześniej, nowe GC wykazywały powolny rozwój u myszy prowadzących siedzący tryb życia, co skutkowało krótkimi dendrytami o niewielkich rozgałęzieniach w wieku 3 tygodni. Jednotygodniowy bieg nie zmienił ogólnego wyglądu nowych GC w żadnym z badanych przedziałów czasowych (Ryc. 1C,D). W przeciwieństwie do tego, bieganie przez cały 3-tygodniowy interwał spowodowało zwiększenie długości dendrytów i rozgałęzień, spójne z przyspieszoną integracją neuronów.
Obserwowane efekty ćwiczeń zostały przetestowane na pojedynczej kohorcie neuronów, tej, która została retrowirusowo oznakowana. Jednakże, ponieważ nowe GC są stale generowane, można sobie wyobrazić, że GC urodzone w różnych momentach w okresie ćwiczeń mogą być również pod wpływem aktywności. Aby przetestować tę hipotezę, zastosowaliśmy prostą strategię znakowania kohort neuronów urodzonych w różnym czasie w odniesieniu do inicjacji ćwiczeń poprzez wystawianie myszy na działanie kółek biegowych w różnych odstępach czasu, ale zawsze analizując strukturę neuronów 3 tygodnie po wstrzyknięciu retrowirusa (dla uproszczenia określane jako 1m). W ten sposób porównano trzy kohorty: jedną biegającą przez 3 tygodnie, oznaczoną tuż na początku ćwiczeń (Run1m), jedną biegającą przez 2 miesiące, oznaczoną 1 miesiąc po rozpoczęciu ćwiczeń (Run2m) i jedną biegającą 3 miesiące, oznaczoną 2 miesiące po rozpoczęciu ćwiczeń (Run3m) (Figura 2A). Zaobserwowaliśmy podobny stopień wzrostu neuronów we wszystkich warunkach w porównaniu z myszami siedzącymi, co wskazuje, że wszystkie kohorty neuronalne urodzone w mózgu myszy w średnim wieku wykonującej dobrowolny bieg będą podlegać szybkiemu wzrostowi i integracji (Figura 2B,C). Drzewa dendrytyczne GC u myszy Run3m były nieco dłuższe niż u myszy Run1m lub Run2m, co sugeruje, że promocja integracji neuronalnej może być odpowiedzią na mechanizm, którego efekt kumuluje się w czasie. Jednak 1 miesiąc biegania spowodował prawie maksymalny wpływ na rozwój GC.
Później zbadaliśmy wpływ ćwiczeń w starzejącym się mózgu na kohorty neuronalne urodzone po zakończeniu aktywności. Porównaliśmy, jak bieganie przez 3-4 tygodnie wpływa na rozwój nowych GC urodzonych zaraz na początku (Run1m), na końcu (Run-1m) lub 1 miesiąc po zakończeniu ćwiczeń (Run-2m; Figura 3A). Co zaskakujące, kohorty neuronów urodzonych na początku lub na końcu okresu biegowego reagowały podobnie (Figura 3B,C). W przeciwieństwie do tego, kohorty urodzone 1 miesiąc po zakończeniu ćwiczeń (Run-2m) wykazały tylko subtelny efekt.
Aby w pełni zintegrować się z obwodem, GC ustanawiają glutamatergiczne połączenia pobudzające na komórkach piramidowych CA3 poprzez duże MFBs, i rekrutują GABAergiczne hamowanie wyprzedzające na komórkach piramidowych poprzez filopodialne rozszerzenia, które powstają z tych terminali (Acsady i in., 1998; Toni i in., 2008; Sun i in., 2013; Restivo i in., 2015). Podczas gdy analiza konfokalna nie wykazała zmian w obszarze MFBs neuronów urodzonych w Run-1m lub Run1m w porównaniu do kontroli, liczba filopodiów/MFBs wzrosła o ∼100% (Ryc. 3D,E). Wyniki te wskazują, że ćwiczenia fizyczne specyficznie zwiększają łączność z nowych GC na hamującą sieć lokalną (Trinchero et al., 2019).
Dyskusja
Dorosła neurogeneza obejmuje sekwencję złożonych kroków rozwojowych, których efektem jest integracja nowych jednostek przetwarzających informacje. Neuronalne komórki macierzyste strefy podwsierdziowej opuszczają stan spoczynku, aby stać się proliferującymi neuronalnymi komórkami progenitorowymi, które powiększają populację prekursorów (transit amplifying cells) (Bonaguidi i in., 2012). Komórki progenitorowe generują neurony, które migrują, rozwijają się i integrują z obwodem. Podczas tego wydłużonego okna czasowego dochodzi do wyraźnej redukcji puli neuronów w wyniku apoptotycznej śmierci komórek. Dobrowolne ćwiczenia fizyczne i EE stanowią silny bodziec stymulujący neurogenezę hipokampa u gryzoni przez całe życie (van Praag i in., 1999a, b; Kronenberg i in., 2003, 2006; Wu i in., 2008; Kannangara i in., 2011). Neurogeneza zmniejsza się w starzejącym się mózgu, głównie w wyniku redukcji wielkości puli komórek progenitorowych. Zarówno bieganie jak i EE mogą przeciwdziałać zmniejszonej produkcji neuronów u starzejących się zwierząt, działając poprzez różne mechanizmy (Kempermann i in., 2010). Bieganie działa na dwóch poziomach w celu zwiększenia neurogenezy: zwiększając tempo proliferacji neuronalnych komórek progenitorowych (van Praag i in., 1999b, 2005; Cooper i in., 2018) oraz przyspieszając dojrzewanie i funkcjonalną integrację rozwijających się neuronów (Trinchero i in., 2017). EE zwiększa przeżywalność, a także przyspiesza dojrzewanie nowych GC, ale nie wpływa na proliferację (Trinchero i in., 2017, 2019).
Bieganie promuje również przepisywanie połączeń neuronalnych i modulację właściwości wewnętrznych w nowych GC podczas pierwszego tygodnia rozwoju u młodych dorosłych myszy (Sah i in., 2017). Niedawno donieśliśmy o krytycznym okresie podczas drugiego tygodnia dojrzewania GCs u starzejących się zwierząt, w którym EE indukuje wzrost dendrytyczny i szybszą integrację nowych neuronów w obwodzie (Trinchero i in., 2019). Zapytaliśmy tutaj, czy bieganie przez 1 tydzień w dowolnym momencie rozwoju GCs wpłynęłoby na ich integrację, ale nie znaleźliśmy żadnego efektu (Figura 1). Cały 3-tygodniowy okres biegania był wymagany do regulacji neurogenezy. Brak krótkoterminowej modulacji sugeruje, że w mechanizmie pośredniczą czynniki, które muszą się nagromadzić, aby wywołać zauważalne zmiany. Co ciekawe, dobrowolne ćwiczenia nasilają produkcję BDNF, która gromadzi się przez tygodnie, zanim osiągnie poziom plateau, który wywiera maksymalne działanie (Vecchio i in., 2018). Chociaż neurotrofiny są kluczowymi mediatorami, efekty obserwowane tutaj są prawdopodobne, aby być pośredniczone przez wiele mechanizmów. Ćwiczenia fizyczne również zwiększają aktywność elektryczną w zakręcie zębatym, zwiększają przepływ krwi i modulują neurozapalenie (Piatti i in., 2011; Speisman i in., 2013; Trinchero i in., 2017). Udział innych mechanizmów wymaga dalszych badań.
Pokazujemy tutaj, że ∼3 tygodniowe GCs od starzejących się myszy chronicznie narażonych na działanie koła jezdnego (do 3 miesięcy) prezentują w pełni rozwinięty fenotyp z długimi i złożonymi arborizacjami dendrytycznymi, podobnymi do tych z nowych GCs generowanych u młodych dorosłych myszy (Figura 2). Dojrzałe GC u młodych dorosłych i myszy w średnim wieku osiągają równoważną długość dendrytyczną i złożoność pod koniec rozwoju, porównywalną do 3-tygodniowych GC u starzejących się myszy narażonych na EE lub bieganie (Piatti i in., 2011; Trinchero i in., 2017, 2019). Te zgromadzone dowody przemawiają za wyraźnym przyspieszeniem szybkości dojrzewania wywołanego przez bieganie.
Na poziomie wyjścia neuronalnego, bieganie promowało szybki wzrost filopodialnych rozszerzeń, ale nie modyfikowało rozmiaru MBFs (Figura 3D,E). Wynik ten sugeruje, że nowe GC integrują się szybko, ale ich wyjście może być ukierunkowane na aktywację interneuronów GABAergicznych w CA3 (kontaktowanych przez filopodia), a nie komórek piramidowych kontaktowanych przez MFBs (Acsady i in., 1998; Toni i in., 2008; Sun i in., 2013; Restivo i in., 2015). Zaskakujące jest to, że EE prowokowała wyraźny wzrost zarówno wielkości MFBs, jak i liczby filopodialnych rozszerzeń u starzejących się myszy, co jest zgodne z bardziej zrównoważoną modulacją wyjścia neuronalnego (Trinchero i in., 2019). Spekulujemy, że zmiany spowodowane EE obejmują zależne od aktywności przemodelowanie specyficznych synaps, które stają się wzmocnione do kodowania wskazówek przestrzennych (Nicoll i Schmitz, 2005; Holtmaat i Svoboda, 2009). W przeciwieństwie do tego, bieganie może stanowić ogólny bodziec dla nowych GC, aby stały się przygotowane do połączenia z konkretnymi celami, gdy kodowanie staje się konieczne, zachowując jednocześnie hamujący ton z interneuronów GABAergicznych, który może działać jako mechanizm ograniczający aktywność postsynaptyczną, dopóki nowe GC nie zostaną prawidłowo zmontowane w otaczającej sieci.
Nasze wyniki wskazują, że starzejący się mózg generuje sygnały neurogenne, gdy myszy kontynuują bieganie przez dłuższy czas (miesiące). W tym kontekście, kolejne kohorty neuronalne urodzone u biegających myszy będą się szybko rozwijać i integrować, pozwalając starzejącym się obwodom na gromadzenie znacznej liczby nowych neuronów (rysunek 4). Ciągła inkorporacja nowych GC o cechach przypominających to, co występuje u młodszych myszy, skutkuje odmłodzonym hipokampem z neuronami, które mogą być przygotowane do reagowania na przyszłe doświadczenia.
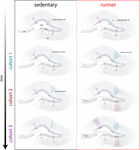
Rysunek 4. Odmłodzenie sieci hipokampalnej wywołane bieganiem u myszy w średnim wieku. Schematyczne przedstawienie przebiegu czasowego integracji neuronów u myszy siedzących (po lewej) i biegających (po prawej) po przedłużonych interwałach dobrowolnych ćwiczeń. W strefie podgranularnej zakrętu zębatego, komórki podobne do promienistych zwojów (RGL) pozostają w stanie spoczynku (u góry). Starzejące się myszy prowadzące siedzący tryb życia wykazują niski wskaźnik neurogenezy, a nowe neurony rozwijają się w sposób powolny (reprezentatywne kohorty zaznaczono różnymi kolorami). U myszy biegających, produkcja nowych GC jest zwiększona, a te nowe jednostki rozwijają się i integrują szybciej, rozszerzając sieć neuronalną w sposób kumulatywny w dłuższym okresie czasu. Ostatecznie, te nowe kohorty w pełni dojrzałych neuronów stają się zaangażowane do przetwarzania informacji na żądanie.
Z szerszej perspektywy, wzrost długowieczności związanej z nowoczesnym społeczeństwem towarzyszy wyższe ryzyko dla spadku poznawczego. W związku z tym istotne staje się zrozumienie mechanizmów leżących u podstaw dobrze znanych korzyści płynących z ćwiczeń fizycznych w funkcjonowaniu mózgu. Ponadto, mogą istnieć długoterminowe różnice między osobami uprawiającymi ćwiczenia w różnych odstępach czasu w życiu i tymi, które wykonywały ćwiczenia w sposób ciągły, pod względem zmniejszenia ryzyka rozwoju chorób neurodegeneracyjnych (Llorens-Martin, 2018). Nasze wyniki pokazują, że ciągłe bieganie promuje integrację wielu kohort neuronalnych, podnosząc w ten sposób złożoność sieci w niezwykły sposób. Projektowanie różnych strategii w celu zwiększenia skuteczności integracji nowych neuronów w hipokampie może służyć jako obiecujący mechanizm plastyczności, aby ostatecznie złagodzić spadek poznawczy występujący w zdrowym i chorym starzejącym się mózgu. Wreszcie, rozbiór mechanizmów leżących u podstaw różnych aspektów takiej przyspieszonej integracji neuronalnej i rozwoju nauczy nas wiele o potencjale plastyczności sieci neuronalnych w starzejącym się mózgu.
Dostępność danych
Dane, które wspierają ustalenia tego badania są dostępne od odpowiadającego autora na uzasadnione żądanie.
Oświadczenie etyczne
Badanie na zwierzętach zostało przejrzane i zatwierdzone przez komitet ds. wykorzystania i opieki nad zwierzętami laboratoryjnymi Instytutu Leloir.
Wkład autorów
MT i MH przeprowadzili eksperymenty i przeanalizowali dane. MT, MH, i AS zaprojektowali eksperymenty i napisali manuskrypt. AS zapewnił wsparcie finansowe.
Funding
Ta praca była wspierana przez Argentyńską Agencję Promocji Nauki i Technologii (Grant# PICT2015-3814), National Institute of Neurological Disorders and Stroke oraz Fogarty International Center (Grant# R01NS103758) dla AS, który jest badaczem w Consejo Nacional de Investigaciones Científicas y Técnicas (CONICET). MT był wspierany przez stypendium CONICET.
Conflict of Interest Statement
Autorzy deklarują, że badania były prowadzone przy braku jakichkolwiek komercyjnych lub finansowych relacji, które mogłyby być interpretowane jako potencjalny konflikt interesów.
Podziękowania
Dziękujemy członkom laboratorium AS za wnikliwe dyskusje.
Acsady, L., Kamondi, A., Sik, A., Freund, T., and Buzsaki, G. (1998). GABAergic cells are the major postsynaptic targets of mossy fibers in the rat hippocampus. J. Neurosci. 18, 3386-3403.
PubMed Abstract | Google Scholar
Altman, J., and Das, G. D. (1965). Autoradiograficzne i histologiczne dowody postnatalnej neurogenezy hipokampa u szczurów. J. Comp. Neurol. 124, 319-335.
Google Scholar
Bartsch, T., and Wulff, P. (2015). Hipokamp w starzeniu się i chorobie: od plastyczności do podatności. Neuroscience 309, 1-16. doi: 10.1016/j.neuroscience.2015.07.084
PubMed Abstract | CrossRef Full Text | Google Scholar
Bonaguidi, M. A., Song, J., Ming, G. L., and Song, H. (2012). A unifying hypothesis on mammalian neural stem cell properties in the adult hippocampus. Curr. Opin. Neurobiol. 22, 754-761. doi: 10.1016/j.conb.2012.03.013
PubMed Abstract | CrossRef Full Text | Google Scholar
Burke, S. N., and Barnes, C. A. (2006). Neural plasticity in the ageing brain. Nat. Rev. Neurosci. 7, 30-40.
PubMed Abstract | Google Scholar
Burke, S. N., and Barnes, C. A. (2010). Senescent synapses and hippocampal circuit dynamics. Trends Neurosci. 33, 153-161. doi: 10.1016/j.tins.2009.12.003
PubMed Abstract | CrossRef Full Text | Google Scholar
Buzsaki, G., and Moser, E. I. (2013). Memory, navigation and theta rhythm in the hippocampal-entorhinal system. Nat. Neurosci. 16, 130-138. doi: 10.1038/nn.3304
PubMed Abstract | CrossRef Full Text | Google Scholar
Cooper, C., Moon, H. Y., and van Praag, H. (2018). W biegu po plastyczność hipokampa. Cold Spring Harb. Perspect. Med. 8:a029736. doi: 10.1101/cshperspect.a029736
PubMed Abstract | CrossRef Full Text | Google Scholar
Duzel, E., van Praag, H., and Sendtner, M. (2016). Can physical exercise in old age improve memory and hippocampal function? Brain 139, 662-673. doi: 10.1093/brain/awv407
PubMed Abstract | CrossRef Full Text | Google Scholar
Eriksson, P. S., Perfilieva, E., Bjork-Eriksson, T., Alborn, A. M., Nordborg, C., Peterson, D. A., et al. (1998). Neurogenesis in the adult human hippocampus. Nat. Med. 4, 1313-1317.
PubMed Abstract | Google Scholar
Fan, X., Wheatley, E. G., and Villeda, S. A. (2017). Mechanizmy starzenia się hipokampa i potencjał odmładzania. Annu. Rev. Neurosci. 40, 251-272. doi: 10.1146/annurev-neuro-072116-031357
PubMed Abstract | CrossRef Full Text | Google Scholar
Gebara, E., Sultan, S., Kocher-Braissant, J., and Toni, N. (2013). Adult hippocampal neurogenesis inversely correlates with microglia in conditions of voluntary running and aging. Front. Neurosci. 7:145. doi: 10.3389/fnins.2013.00145
PubMed Abstract | CrossRef Full Text | Google Scholar
Holtmaat, A., and Svoboda, K. (2009). Experience-dependent structural synaptic plasticity in the mammalian brain. Nat. Rev. Neurosci. 10, 647-658. doi: 10.1038/nrn2699
PubMed Abstract | CrossRef Full Text | Google Scholar
Kannangara, T. S., Lucero, M. J., Gil-Mohapel, J., Drapala, R. J., Simpson, J. M., Christie, B. R., et al. (2011). Running reduces stress and enhances cell genesis in aged mice. Neurobiol. Aging 32, 2279-2286. doi: 10.1016/j.neurobiolaging.2009.12.025
PubMed Abstract | CrossRef Full Text | Google Scholar
Kempermann, G., Fabel, K., Ehninger, D., Babu, H., Leal-Galicia, P., Garthe, A., et al. (2010). Why and how physical activity promotes experience-induced brain plasticity. Front. Neurosci. 4:189. doi: 10.3389/fnins.2010.00189
PubMed Abstract | CrossRef Full Text | Google Scholar
Kempermann, G., Kuhn, H. G., and Gage, F. H. (1998). Experience-induced neurogenesis in the senescent dentate gyrus. J. Neurosci. 18, 3206-3212.
PubMed Abstract | Google Scholar
Kronenberg, G., Bick-Sander, A., Bunk, E., Wolf, C., Ehninger, D., and Kempermann, G. (2006). Physical exercise prevents age-related decline in precursor cell activity in the mouse dentate gyrus. Neurobiol. Aging 27, 1505-1513. doi: 10.1016/j.neurobiolaging.2005.09.016
PubMed Abstract | CrossRef Full Text | Google Scholar
Kronenberg, G., Reuter, K., Steiner, B., Brandt, M. D., Jessberger, S., Yamaguchi, M., et al. (2003). Subpopulations of proliferating cells of the adult hippocampus respond differently to physiologic neurogenic stimuli. J. Comp. Neurol. 467, 455-463. doi: 10.1002/cne.10945
PubMed Abstract | CrossRef Full Text | Google Scholar
Kuhn, H. G., Dickinson-Anson, H., and Gage, F. H. (1996). Neurogenesis in the dentate gyrus of the adult rat: age-related decrease of neuronal progenitor proliferation. J. Neurosci. 16, 2027-2033.
PubMed Abstract | Google Scholar
Llorens-Martin, M. (2018). Exercising new neurons to vanquish Alzheimer disease. Brain Plast. 4, 111-126. doi: 10.3233/bpl-180065
PubMed Abstract | CrossRef Full Text | Google Scholar
Marlatt, M. W., Potter, M. C., Lucassen, P. J., and van Praag, H. (2012). Running throughout middle-age improves memory function, hippocampal neurogenesis, and BDNF levels in female C57BL/6J mice. Dev. Neurobiol. 72, 943-952. doi: 10.1002/dneu.22009
PubMed Abstract | CrossRef Full Text | Google Scholar
Meshi, D., Drew, M. R., Saxe, M., Ansorge, M. S., David, D., Santarelli, L., et al. (2006). Hippocampal neurogenesis nie jest wymagane dla behawioralnych efektów wzbogacenia środowiska. Nat. Neurosci. 9, 729-731. doi: 10.1038/nn1696
PubMed Abstract | CrossRef Full Text | Google Scholar
Moreno-Jiménez, E. P., Flor-García, M., Terreros-Roncal, J., Rábano, A., Cafini, F., Pallas-Bazarra, N., et al. (2019). Dorosła neurogeneza hipokampa jest obfita u osób zdrowych neurologicznie i gwałtownie spada u pacjentów z chorobą Alzheimera. Nat. Med. 25, 554-560.
Google Scholar
Morgenstern, N. A., Lombardi, G., and Schinder, A. F. (2008). Newborn granule cells in the ageing dentate gyrus. J. Physiol. 586, 3751-3757. doi: 10.1113/jphysiol.2008.154807
PubMed Abstract | CrossRef Full Text | Google Scholar
Nicoll, R. A., and Schmitz, D. (2005). Synaptic plasticity at hippocampal mossy fibre synapses. Nat. Rev. Neurosci. 6, 863-876.
PubMed Abstract | Google Scholar
O’Callaghan, R. M., Griffin, E. W., and Kelly, A. M. (2009). Long-term treadmill exposure protects against age-related neurodegenerative change in the rat hippocampus. Hippocampus 19, 1019-1029. doi: 10.1002/hipo.20591
PubMed Abstract | CrossRef Full Text | Google Scholar
Paxinos, G., and Franklin, K. B. J. (2001). The Mouse Brain in Stereotaxic Coordinates. Amsterdam: Elsevier.
Google Scholar
Piatti, V. C., Davies-Sala, M. G., Esposito, M. S., Mongiat, L. A., Trinchero, M. F., and Schinder, A. F. (2011). The timing for neuronal maturation in the adult hippocampus is modulated by local network activity. J. Neurosci. 31, 7715-7728. doi: 10.1523/JNEUROSCI.1380-11.2011
PubMed Abstract | CrossRef Full Text | Google Scholar
Restivo, L., Niibori, Y., Mercaldo, V., Josselyn, S. A., and Frankland, P. W. (2015). Development of adult-generated cell connectivity with excitatory and inhibitory cell populations in the hippocampus. J. Neurosci. 35, 10600-10612. doi: 10.1523/JNEUROSCI.3238-14.2015
PubMed Abstract | CrossRef Full Text | Google Scholar
Sah, N., Peterson, B. D., Lubejko, S. T., Vivar, C., and van Praag, H. (2017). Running reorganizuje obwody jednotygodniowych, dorosłych neuronów hipokampa. Sci. Rep. 7:10903. doi: 10.1038/s41598-017-11268-z
PubMed Abstract | CrossRef Full Text | Google Scholar
Speisman, R. B., Kumar, A., Rani, A., Foster, T. C., and Ormerod, B. K. (2013). Codzienne ćwiczenia poprawiają pamięć, stymulują neurogenezę hipokampa i modulują cytokiny immunologiczne i neuroimmunologiczne u starzejących się szczurów. Brain Behav. Immun. 28, 25-43. doi: 10.1016/j.bbi.2012.09.013
PubMed Abstract | CrossRef Full Text | Google Scholar
Sun, G. J., Sailor, K. A., Mahmood, Q. A., Chavali, N., Christian, K. M., Song, H., et al. (2013). Seamless reconstruction of intact adult-born neurons by serial end-block imaging reveals complex axonal guidance and development in the adult hippocampus. J. Neurosci. 33, 11400-11411. doi: 10.1523/JNEUROSCI.1374-13.2013
PubMed Abstract | CrossRef Full Text | Google Scholar
Toni, N., Laplagne, D. A., Zhao, C., Lombardi, G., Ribak, C. E., Gage, F. H., et al. (2008). Neurons born in the adult dentate gyrus form functional synapses with target cells. Nat. Neurosci. 11, 901-907. doi: 10.1038/nn.2156
PubMed Abstract | CrossRef Full Text | Google Scholar
Trinchero, M. F., Buttner, K. A., Sulkes Cuevas, J. N., Temprana, S. G., Fontanet, P., Monzon Salinas, M. C., et al. (2017). Wysoka plastyczność nowych komórek ziarnistych w starzejącym się hipokampie. Cell Rep. 21, 1129-1139. doi: 10.1016/j.celrep.2017.09.064
PubMed Abstract | CrossRef Full Text | Google Scholar
Trinchero, M. F., Herrero, M., Monzon-Salinas, M. C., and Schinder, A. F. (2019). Experience-dependent structural plasticity of adult-born neurons in the aging hippocampus. Front. Neurosci. 13:739. doi: 10.3389/fnins.2019.00739
PubMed Abstract | CrossRef Full Text | Google Scholar
van Praag, H., Christie, B. R., Sejnowski, T. J., and Gage, F. H. (1999a). Running enhances neurogenesis, learning, and long-term potentiation in mice. Proc. Natl. Acad. Sci. U.S.A. 96, 13427-13431.
Google Scholar
van Praag, H., Kempermann, G., and Gage, F. H. (1999b). Bieganie zwiększa proliferację komórek i neurogenezę w dorosłym girusie zębatym myszy. Nat. Neurosci. 2, 266-270.
PubMed Abstract | Google Scholar
van Praag, H., Shubert, T., Zhao, C., and Gage, F. H. (2005). Exercise zwiększa uczenia się i neurogenezy hipokampa w wieku myszy. J. Neurosci. 25, 8680-8685.
PubMed Abstract | Google Scholar
Vecchio, L. M., Meng, Y., Xhima, K., Lipsman, N., Hamani, C., and Aubert, I. (2018). Neuroprotekcyjne efekty ćwiczeń: utrzymanie zdrowego mózgu przez cały okres starzenia się. Brain Plast. 4, 17-52. doi: 10.3233/bpl-180069
PubMed Abstract | CrossRef Full Text | Google Scholar
Wu, C. W., Chang, Y. T., Yu, L., Chen, H. I., Jen, C. J., Wu, S. Y., et al. (2008). Exercise enhances the proliferation of neural stem cells and neurite growth and survival of neuronal progenitor cells in dentate gyrus of middle-aged mice. J. Appl. Physiol. 105, 1585-1594. doi: 10.1152/japplphysiol.90775.2008
PubMed Abstract | CrossRef Full Text | Google Scholar
Wu, M. V., Luna, V. M., and Hen, R. (2015). Running rescues a fear-based contextual discrimination deficit in aged mice. Front. Syst. Neurosci. 9:114. doi: 10.3389/fnsys.2015.00114
PubMed Abstract | CrossRef Full Text | Google Scholar
Xu, B., Sun, A., He, Y., Qian, F., Liu, L., Chen, Y., et al. (2017). Running-induced memory enhancement correlates with the preservation of thin spines in the hippocampal area CA1 of old C57BL/6 mice. Neurobiol. Aging 52, 106-116. doi: 10.1016/j.neurobiolaging.2017.01.002
PubMed Abstract | CrossRef Full Text | Google Scholar
.




