Frontiers in Oncology
Introduction
Glioblastoma i astrocytoma anaplastyczny (ANA) są dwoma z najczęstszych pierwotnych guzów mózgu u dorosłych (1). Obserwuje się rzeczywisty wzrost zachorowań, zwłaszcza u osób starszych (1-3). W praktyce klinicznej trudno jest odróżnić pacjentów z glioblastoma od tych z ANA przed operacją lub biopsją, ponieważ objawy i oznaki tych dwóch guzów są stosunkowo jednolite i niespecyficzne (4, 5). Jednak postępowanie w ich przypadku jest różne, np. protokół chemioterapii, dawkowanie i sposób podawania (6). Na przykład u pacjentów z ANA (stopień III wg WHO) zaleca się radioterapię lub TMZ po resekcji lub biopsji, natomiast u pacjentów z nowo rozpoznanym glioblastoma (stopień IV wg WHO) stosuje się radioterapię plus jednoczesną TMZ, a następnie adjuwantową TMZ. Według wcześniejszych badań, glioblastoma i ANA rosną przez inwazję do prawidłowej tkanki mózgowej, rozprzestrzeniają się przez płyn mózgowo-rdzeniowy (CSF) i wykraczają poza pojedynczą dystrybucję tętnicy szyjnej lub kręgowej, przez co źle reagują na leczenie i stają się głównymi przyczynami zgonów z powodu nowotworów u dorosłych (7, 8). Ponadto rokowanie w przypadku glioblastoma i ANA jest odmienne. W populacji osób starszych nie ma istotnej różnicy w rokowaniu pomiędzy glioblastoma i ANA, ale różnica ta może występować w populacji młodszej (9). Dlatego też odróżnienie glioblastoma od ANA jest trudne, ale kluczowe.
Rezonans magnetyczny (MRI) jest optymalnym badaniem neuroobrazowym w przedoperacyjnej diagnostyce glioblastoma i ANA ze względu na możliwość wielopłaszczyznowego obrazowania i doskonały kontrast tkanek miękkich. Chociaż niektóre badania wykazały, że obecność pierścieniowatego wzmocnienia i martwicy sugeruje glejaka, w większości przypadków zarówno glejak, jak i ANA pojawiają się jako nieregularne kształty na obrazach MR (hiperdensyjne na sekwencji T2-zależnej i hipodensyjne na sekwencji T1-zależnej) z różnym stopniem wzmocnienia kontrastowego opartego na Gd i obrzękiem, których różnice są zwykle niezauważalne dla ludzkiego oka (10-12).
Ostatnio analiza tekstury (TA), znana również jako radiomika, była szeroko stosowana w różnych dziedzinach. Naukowcy stwierdzili, że TA jest wykonalną i obiecującą metodą ułatwiającą diagnostykę różnicową, ponieważ umożliwia pozyskanie dodatkowych informacji ilościowych z obrazów MR, które były niewidoczne dla oceny ludzkiej (13-15). TA opisuje rozkład częstotliwości i organizację przestrzenną wartości wokseli, aby ujawnić możliwe różnice w tkance nowotworowej (16). We wcześniejszych pracach badano możliwość zastosowania TA w diagnostyce różnicowej, klasyfikacji podtypów guzów i wykrywaniu heterogenności tkanki nowotworowej (17-19). Według naszej wiedzy, zastosowanie TA w diagnostyce różnicowej pomiędzy glioblastoma a ANA nie zostało jeszcze opisane. Celem tego badania była ocena zdolności dyskryminacyjnej analizy tekstury MRI przy użyciu algorytmów uczenia maszynowego do różnicowania glioblastoma i ANA.
Materiały i metody
Wybór pacjentów
Przeszukaliśmy retrospektywnie bazę danych naszej instytucji i prześwietliliśmy wszystkich pacjentów histopatologicznie zdiagnozowanych jako glioblastoma lub ANA, od stycznia 2015 do grudnia 2018 roku. Kryteriami kwalifikującymi zakwalifikowanych pacjentów były: (1) rozstrzygające rozpoznanie histopatologiczne glioblastoma lub ANA; (2) opracowana elektroniczna dokumentacja medyczna, w szczególności materiał patologiczny; (3) diagnostyczne badanie MR w naszej instytucji przed resekcją chirurgiczną. Kryteriami wyłączenia z badania były: (1) historia choroby wewnątrzczaszkowej (np. uraz mózgu, infekcja wewnątrzczaszkowa lub inne rodzaje guza mózgu), z uwzględnieniem interferencji tkanki bliznowatej na intensywność obrazów; (2) obecność artefaktu ruchu na MRI; (3) historia zabiegów przed skanowaniem MR (np. operacja, chemioterapia lub radioterapia); (4) pacjenci, którzy nie osiągnęli kryteriów rozpoznania glejaka lub ANA zgodnie z systemem klasyfikacji WHO z 2016 roku. Starszy neuropatolog z 10-letnim doświadczeniem oceniał, czy pacjent spełniał kryteria (system klasyfikacji WHO z 2016 r.) dla glioblastoma lub ANA. Instytucjonalna komisja rewizyjna zatwierdziła to retrospektywne badanie. Uzyskano pisemną świadomą zgodę od uczestników zapisanych do tego badania. Komitet Etyczny Uniwersytetu Syczuańskiego i wydział radiologii naszej instytucji zatwierdziły wykorzystanie statystyk do tego badania.
Akwizycja obrazów MR
Dla wszystkich pacjentów włączonych do tego badania dostępne były wzmocnione kontrastem sekwencje T1-ważone, które uzyskano na 3,0T Siemens Trio Scanner z następującymi parametrami: TR/TE/TI = 1900/2,26/900 ms, Flip angle = 9 °, 20 osiowych plastrów o grubości = 5 mm, osiowy FOV = 25,6 × 25,6 cm2 i macierz danych = 256 × 256. W obrazowaniu T1-zależnym wzmocnionym kontrastem użyto gadopentetatu dimegluminy (0,1 mmol/Kg) jako środka kontrastowego dla obrazu wzmocnionego kontrastem, a wielokierunkowe dane MRI wzmocnionego kontrastem zostały zebrane podczas ciągłego czasu przerwy 90-250 s.
Ekstrakcja tekstury
W naszym badaniu pakiet LifeX (http://www.lifexsoft.org) został użyty do ekstrakcji cech tekstury. Obrazy pokontrastowe T1-weighted (T1C) zostały wybrane do dalszej analizy ze względu na wyraźne zobrazowanie lokalizacji i granicy guza (20). Region zainteresowania (ROI) został ręcznie narysowany plaster po plastrze w płaszczyźnie osiowej wzdłuż zmian na obrazach wzmocnionych kontrastem w celu uzyskania cech tekstury. Dwóch doświadczonych neurochirurgów, ślepych na dokumentację medyczną pacjentów i diagnozę histopatologiczną, rysowało ROI, a następnie były one edytowane przez starszego radiologa i starszego neurochirurga. Nieporozumienia były rozwiązywane poprzez dyskusję i konsultacje ze starszym radiologiem i starszym neurochirurgiem. Z obrazów MRI wyodrębniono łącznie 40 cech tekstury, w tym minValue, meanValue, maxValue, stdValue oraz parametry pochodzące z sześciu macierzy: Histogram-based matrix (HISTO), Shape, Gray-level co-occurrence matrix (GLCM), Gray-level run length matrix (GLRLM), Gray-level zone length matrix (GLZLM), and Neighborhood gray-level dependence matrix (NGLDM).
Wybór cech
W sumie było 40 cech tekstury pochodzących z sześciu wybranych macierzy. Objaśnienia 40 cech tekstury przedstawiono w Tabeli 1. Statystyka cech tekstury została przedstawiona w Tabeli 2. Selekcja cech została przeprowadzona w celu określenia odpowiednich cech, a tym samym uniknięcia nadmiernego dopasowania. Ponadto, algorytm uczenia maszynowego zastosowany w tym badaniu nie mógł uwzględnić w analizie wszystkich 40 cech tekstury. Do wyboru optymalnych cech tekstury zastosowano trzy niezależne metody selekcji cech, w tym korelację odległościową, najmniejszy bezwzględny skurcz i operator selekcji (LASSO) oraz gradientowe korelacyjne drzewo decyzyjne (GBDT). W ten sposób utworzono trzy podzbiory cech tekstury, które stanowiły trzy różne zestawy danych.
Klasyfikacja
Liniowa analiza dyskryminacyjna (LDA) jest solidną metodą klasyfikacji służącą do oddzielania dwóch klas poprzez poszukiwanie liniowej kombinacji predyktorów, która maksymalizuje separację między grupami. W niniejszej pracy, w oparciu o algorytm LDA, stworzono trzy modele klasyfikacyjne: Distance Correlation + LDA, LASSO + LDA oraz GBDT + LDA. Zbiory danych były wprowadzane do algorytmu LDA odpowiednio i niezależnie od siebie. Każdy zbiór danych został losowo podzielony na grupę treningową i walidacyjną w stosunku 4:1. Model wytrenowany w grupie treningowej został następnie zastosowany do niezależnej grupy walidacyjnej w celu oceny jego wydajności. Aby ocenić odporność algorytmu LDA, procedurę powtórzono dla 100 cykli z różnym, losowym i niezależnym przypisaniem przypadków. Wyznaczono macierz konfuzji wykorzystując prawdziwe przypisanie z histopatologii i przewidywania algorytmu LDA. Obliczono standardową czułość, swoistość, obszary pod krzywą charakterystyki operacyjnej odbiornika (AUC) oraz dokładność zarówno dla grupy treningowej, jak i walidacyjnej, aby ujawnić zdolność dyskryminacyjną modeli. Porównanie trzech modeli (Distance Correlation + LDA, LASSO + LDA oraz GBDT + LDA) przeprowadzono w celu określenia optymalnego modelu dyskryminacyjnego dla glejaka i ANA. Schemat przepływu klasyfikacji MRI według cech tekstury przedstawiono na rysunku 1.
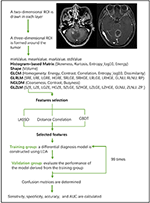
Rysunek 1. Schemat blokowy klasyfikacji MRI według cech tekstury. ANA, anaplastic astrocytoma; LDA, linear discriminant analysis; MRI, Magnetic Resonance Imaging; LASSO, least absolute shrinkage and selection operator; GBDT, gradient correlation decision tree; HISTO, histogram-based matrix; GLCM, Gray-level co-occurrence matrix; GLRLM, Gray-level run length matrix; GLZLM, Gray-level zone length matrix; NGLDM, Neighborhood gray-level dependence matrix; AUC, area under receiver operating characteristic curve.
Wyniki
Charakterystyka pacjentów
Ogółem kryteria włączenia spełniło 133 pacjentów z glejakiem (n = 76) lub ANA (n = 57). Wszyscy pacjenci z glioblastoma zostali włączeni do badania, podczas gdy 10 pacjentów z ANA zostało wykluczonych zgodnie z kryteriami wykluczenia. Ostatecznie do badania włączono 76 pacjentów z glioblastoma i 46 pacjentów z ANA. Średni wiek pacjentów wynosił odpowiednio 46,9 (15-67) i 40,0 (7-69) lat. Wszyscy pacjenci zostali poddani chirurgicznej resekcji guza w naszym oddziale neurochirurgii w latach 2015-2018. Na rycinie 2 przedstawiono dwa przypadki z płaszczyzny osiowej obrazów wzmocnionych kontrastem u pacjentów z glejakiem i ANA.
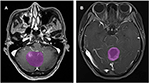
Figure 2. Przykłady dwóch przypadków z obrazów MR wzmocnionych kontrastem u pacjentów z glioblastoma i ANA. (A) obrazy wzmocnione kontrastem z ANA, (B) obrazy wzmocnione kontrastem z glioblastoma. ANA, Anaplastic astrocytoma.
Glioblastoma vs. ANA
W tym badaniu analizowano trzy modele, w tym Distance Correlation + LDA, LASSO + LDA, GBDT + LDA. Cechy tekstury użyte do klasyfikacji w tych modelach zostały przedstawione w tabeli 3. Wydajność każdego z modeli przedstawiono w tabeli 1 (czułość, specyficzność, dokładność oraz AUC dla grupy treningowej i walidacyjnej). LASSO + LDA osiągnęły najlepszą wydajność z najwyższymi AUC zarówno w grupie treningowej, jak i walidacyjnej. Czułość, specyficzność, dokładność i AUC dla grupy szkoleniowej wynosiły odpowiednio 0,989, 0,993, 0,996 i 0,997, a dla grupy walidacyjnej odpowiednio 0,927, 0,989, 0,968 i 0,974. Ponadto, korelacja odległościowa + LDA i GBDT + LDA również wykazały obiecującą zdolność do odróżniania glejaka od ANA, z AUC ≥0,95 zarówno dla grup szkoleniowych, jak i walidacyjnych.

Tabela 1. Dyskryminacja między glioblastoma i ANA.
Rysunek 3 przedstawia zależności między kanonicznymi funkcjami dyskryminacyjnymi z modeli LASSO + LDA dla grup glioblastoma i ANA (trójkąty i koła) oraz dla centroidów grup (kwadraty). Na rysunku tym zaobserwowano minimalne nakładanie się funkcji. Jakościowo, analiza danych wybranych przez LASSO mogła oddzielić glioblastoma od ANA. Na rycinie 4 przedstawiono rozkład bezpośredniej funkcji LDA wyznaczonej dla glejaka i ANA dla jednego ze 100 niezależnych cykli treningowych w analizie danych w celu zilustrowania wydajności modelu LASSO + LDA. Zaobserwowano wyraźne przesunięcia wartości funkcji LDA, z przesunięciem w lewo dla ANA i w prawo dla glioblastoma.
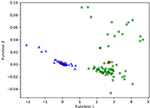
Rysunek 3. Zależność między kanonicznymi funkcjami dyskryminacyjnymi z modeli LASSO + LDA dla grup glejaka i ANA (trójkąty i kółka) oraz dla centroidów grup (kwadraty). Na rysunku tym zaobserwowano minimalne nakładanie się funkcji. Jakościowo, analiza danych wybranych przez LASSO mogła oddzielić glioblastoma od ANA. LASSO, least absolute shrinkage and selection operator; LDA, linear discriminant analysis; ANA, Anaplastic astrocytoma.
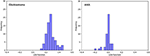
Rysunek 4. Rozkład bezpośredniej funkcji LDA wyznaczonej dla glioblastoma i ANA dla jednego ze 100 niezależnych cykli treningowych w analizie danych w celu zobrazowania wydajności modelu LASSO + LDA. Zaobserwowano wyraźne przesunięcia wartości funkcji LDA, z przesunięciem w lewo dla ANA i w prawo dla glejaka. Obserwuje się minimalne nakładanie się obu grup, a między wykresami dla cykli i trójkątów widoczne jest silne podobieństwo jakościowe. LDA, linear discriminant analysis; ANA, anaplastic astrocytoma; LASSO, least absolute shrinkage and selection operator.
Dyskusja
Diagnostyka różnicowa przed leczeniem pomiędzy glioblastoma i ANA jest ważna, biorąc pod uwagę znaczącą różnicę w strategii leczenia i rokowaniu pacjentów. Badanie MR, główne radiologiczne badanie przedoperacyjne w przypadku guzów mózgu, jest bardzo zalecane ze względu na dobrą czułość w wykrywaniu zmian. Jednak dokładna diagnoza przed operacją jest nadal wyzwaniem ze względu na to, że oba guzy prezentują podobne cechy na konwencjonalnych obrazach MR, które są poza oceną ludzkiego gołego oka (4, 5). W niniejszej pracy wyodrębniliśmy cechy tekstury, tworząc ilościowy opis obrazów, aby zmaksymalizować wykorzystanie badania MR, za pomocą którego stworzono trzy modele oparte na LDA. Wyniki wykazały, że analiza tekstury oparta na MRI w połączeniu z algorytmem LDA może umożliwić wykonalne różnicowanie między glejakiem a ANA.
TA jest matematycznym podejściem do charakteryzowania heterogeniczności wartości wokseli na obrazach. Może ona wizualizować przestrzenną heterogenność histologiczną, która jest niewidoczna dla oceny ludzkiego oka (21). Teoretycznie, cechy obrazów zmian chorobowych mogą być analizowane ilościowo jako cechy tekstury ze względu na ich różne wzmocnione wzory na obrazach MR (22). Ponadto, wcześniejsze badania sugerowały, że cechy tekstury mogą odzwierciedlać szereg nieprawidłowych procesów patologicznych guza, takich jak obrzęk, wysięk i martwica, zapewniając potencjalny mechanizm dla cech tekstury w odróżnianiu glejaka od ANA (23, 24).
Sztuczna inteligencja jest szeroko eksplorowana w ostatnich badaniach. W połączeniu z cechami tekstury wyodrębnionymi z obrazów, okazała się ona pomocna w klasyfikacji guzów, diagnostyce klinicznej i przewidywaniu wyników. Badanie mające na celu ocenę wydajności diagnostycznej algorytmów uczenia maszynowego opartych na TA w różnicowaniu PCNSL od glioblastoma wykazało optymalną wydajność ze średnim AUC wynoszącym 0,921, podczas gdy AUC wszystkich trzech czytelników wynosiło <0,8. Tym samym badacze doszli do wniosku, że skuteczność diagnostyczna algorytmów uczenia maszynowego opartych na TA była lepsza niż skuteczność ludzkich czytników (25). Inne badania o podobnym celu również wykazały podobne wyniki z AUC wyższym niż 0,85 (18, 26). Co więcej, badacze dążący do zastosowania uczenia maszynowego w klasyfikacji astrocytoma również wykazali obiecującą zdolność do dyskryminacji (27). W naszym badaniu modele klasyfikacyjne zostały stworzone w oparciu o algorytmy LDA. LDA jest klasyfikatorem statystycznym łączącym wprowadzone parametry w funkcję dyskryminacyjną w celu zaklasyfikowania przypadków do różnych grup (28). Nasze wyniki wykazały, że model oparty na LDA reprezentował obiecującą wydajność w dokładnej diagnostyce pomiędzy glioblastoma i ANA.
Przyjęcie optymalnych cech dla algorytmów uczenia maszynowego było wyzwaniem, ale było konieczne w odniesieniu do wydajności diagnostycznej. Poprzednie badania przeprowadzały selekcję cech przy użyciu różnych metod: Test U Manna-Whitneya z AUC ROC, test t-Studenta z rekurencyjną eliminacją cech, las losowy i dyskretyzacja oparta na entropii, odpowiednio (18, 25, 29, 30). Na podstawie wyników tych badań można wysnuć wniosek, że odpowiednia metoda selekcji odgrywa kluczową rolę w wydajności klasyfikatora. W przypadku naszego badania, stosunkowo duża liczba parametrów została wyodrębniona z różnych macierzy, co zwiększa szansę na wybór optymalnych cech, ale również zwiększa trudność wyboru. Dlatego też, trzy metody selekcji cech (korelacja odległościowa, LASSO i GBDT) zostały ocenione w celu wybrania tej o najlepszej wydajności. Wyniki tego badania wykazały, że LASSO+LDA jest odpowiednim modelem dyskryminacyjnym dla glejaka z ANA z najwyższym AUC w grupie testowej wynoszącym 0,997. LASSO zostało zaproponowane w poprzednich badaniach jako nieliniowa metoda wyboru zmiennych dla sieci neuronowej, której zaletą jest minimalizacja wspólnej sumy błędów kwadratowych. Pozwala ona na tworzenie interpretowalnych modeli (podobnie jak selekcja podzbiorów) przy jednoczesnym wykazywaniu stabilności regresji grzbietowej. Poprzednie badania wykazały, że reprezentuje ona wyższą wydajność niż inne metody selekcji zmiennych state-of-the-art (31). Jednakże, musimy ostrożnie interpretować wyniki, że dodatkowy zysk w informacjach z porównania różnych technik uczenia maszynowego jest dość ograniczony, szczególnie biorąc pod uwagę, że wszystkie badane metody wyboru klasyfikatorów/cech wydają się działać dość porównywalnie, a wariancja w AUC może być częściowo przypisana do grupy statystycznej. Dlatego nasze badanie może być traktowane jedynie jako tworzenie hipotez dla przyszłych, większych badań.
Istniały pewne ograniczenia naszego badania. Po pierwsze, jako retrospektywne badanie jednoośrodkowe, stronniczość w wyborze pacjenta była nieunikniona. Po drugie, liczba włączonych pacjentów była stosunkowo niewielka, a większa liczba pacjentów była wymagana w dalszych badaniach w celu potwierdzenia wyników. Po trzecie, ANA jest obecnie podzielony na trzy kategorie zgodnie z Klasyfikacją Nowotworów Ośrodkowego Układu Nerwowego Światowej Organizacji Zdrowia z 2016 roku: IDH-mutant, IDH- wildtype oraz NOS (32). W przyszłych badaniach należało zbadać zdolność uczenia maszynowego do dyskryminacji podtypów ANA. Po czwarte, modele uczenia maszynowego w naszym badaniu nie zostały zwalidowane w innych zestawach danych. Nie przyjęliśmy zbiorów danych innych instytucji, ponieważ cechy tekstury mogą być różne w przypadku ekstrakcji z obrazów uzyskanych za pomocą różnych skanerów lub protokołów. Może to być postrzegane jako miecz obosieczny. Z jednej strony, zestaw kontrolowanych zmiennych może być dostarczony; z drugiej strony, wyniki nie mogą być zagwarantowane do szerokiego zastosowania. Protokół analizy i procedura przetwarzania obrazu były pakietami typu open-source, a badania z udziałem dużej populacji są wymagane do zatwierdzenia i odtworzenia naszych wyników.
Wnioski
W tej pracy, wyodrębniliśmy parametry ilościowe z obrazów MR wzmocnionych kontrastem i użyliśmy trzech metod selekcji cech, aby wybrać najbardziej dyskryminujące parametry. Następnie zastosowaliśmy algorytm LDA do analizy wybranych parametrów. Nasze badania wykazały, że cechy tekstury mają obiecującą zdolność do odróżniania glejaka od ANA. Badania wieloośrodkowe z większą liczbą pacjentów są uzasadnione w celu potwierdzenia tego wstępnego wyniku.
Dostępność danych
Z przyjemnością udostępnimy nasze dane wszystkim wykwalifikowanym badaczom bez zbędnych zastrzeżeń. Please contact corresponding author if there is anything they need.
Ethics Statement
The studies involving human participants were reviewed and approved by the Ethics Committee of Sichuan University. Pisemna świadoma zgoda na udział w tym badaniu została dostarczona przez opiekuna prawnego/najbliższego krewnego uczestników. Pisemna świadoma zgoda została uzyskana od osoby (osób) i prawnego opiekuna/najbliższej rodziny nieletniego (nieletnich) na publikację wszelkich potencjalnie identyfikowalnych obrazów lub danych zawartych w tym artykule.
Wkład autorów
ZT, CC, JX, i XM przyczynili się do koncepcji i projektu badania. CC i XO zapisali kwalifikujących się pacjentów i uzyskali dokumentację medyczną oraz obrazy MRI każdego pacjenta. YF i ZT przeprowadzili analizę tekstury. JW stworzył modele i wykonał inne analizy statystyczne. ZT napisał pierwszy szkic manuskryptu. CC napisała część manuskryptu. All authors contributed to manuscript revision, read, and approved the submitted version.
Conflict of Interest Statement
The authors declare that the research was conducted in the absence of any commercial or financial relationships that could be construed as a potential conflict of interest.
Supplementary Material
The Supplementary Material for this article can be found online at: https://www.frontiersin.org/articles/10.3389/fonc.2019.00876/full#supplementary-material
Abbreviations
ANA, Anaplastic astrocytoma; LDA, linear discriminant analysis; MRI, Magnetic Resonance Imaging; MR, Magnetic Resonance; LASSO, Least absolute shrinkage and selection operator; GBDT, Gradient correlation decision tree; CSF, Cerebrospinal fluid; TA, Texture analysis; ROI, Regions of interest; HISTO, Histogram-based matrix; GLCM, Grey-level co-occurrence matrix; GLRLM, Grey-level run length matrix; GLZLM, Grey-level zone length matrix; NGLDM, Neighborhood grey-level dependence matrix; AUC, Area under the receiver operating characteristic curve; PCNSL, Primary central nervous system lymphoma; MLP, Multilayer perceptron; IDH, Isocitrate dehydrogenase.
1. Torre LA, Bray F, Siegel RL, Ferlay J, Lortet-Tieulent J, Jemal A. Global cancer statistics, 2012. CA Cancer J Clin. (2015) 65:87-108. doi: 10.3322/caac.21262
PubMed Abstract | CrossRef Full Text | Google Scholar
2. Chen W, Zheng R, Baade PD, Zhang S, Zeng H, Bray F, et al. Statystyki nowotworów w Chinach, 2015. CA Cancer J Clin. (2016) 66:115-32. doi: 10.3322/caac.21338
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Wen PY, Kesari S. Malignant gliomas in adults. N Engl J Med. (2008) 359:492-507. doi: 10.1056/NEJMra0708126
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Grimm SA, Chamberlain CM. Anaplastyczny astrocytoma. CNS Oncol. (2016) 5:145-57. doi: 10.2217/cns-2016-0002
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Batash R, Asna N, Schaffer P, Francis N, Schaffer M. Glioblastoma multiforme, diagnostyka i leczenie; najnowszy przegląd literatury. Curr Med Chem. (2017) 24:3002-9. doi: 10.2174/0929867324666170516123206
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Weller M, van den Bent M, Hopkins K, Tonn JC, Stupp R, Falini AE, et al. EANO guideline for the diagnosis and treatment of anaplastic gliomas and glioblastoma. Lancet Oncol. (2014) 15:e395-403. doi: 10.1016/s1470-2045(14)70011-7
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Souhami L, Seiferheld W, Brachman D, Podgorsak EB, Werner-Wasik M, Lustig R, et al. Randomized comparison of stereotactic radiosurgery followed by conventional radiotherapy with carmustine to conventional radiotherapy with carmustine for patients with glioblastoma multiforme: report of Radiation Therapy Oncology Group 93-05 protocol. Int J Radiat Oncol Biol Phys. (2004) 60:853-60. doi: 10.1016/j.ijrobp.2004.04.011
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Burger PC, Heinz ER, Shibata T, Kleihues P. Anatomia topograficzna i korelacje CT w nieleczonym glioblastoma multiforme. J Neurosurg. (1988) 68:698-704. doi: 10.3171/jns.1988.68.5.0698
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Wick W, Platten M, Meisner C, Felsberg J, Tabatabai G, Simon M, et al. Temozolomide chemotherapy alone versus radiotherapy alone for malignant astrocytoma in the elderly: the NOA-08 randomised, phase 3 trial. Lancet Oncol. (2012) 13:707-15. doi: 10.1016/s1470-2045(12)70164-x
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Chen W, Silverman HD. Postępy w ocenie pierwotnych guzów mózgu. Semin Nucl Med. (2008) 38:240-50. doi: 10.1053/j.semnuclmed.2008.02.005
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Burger PC, Vogel FS, Green SB, Strike AT. Glioblastoma multiforme i anaplastyczny astrocytoma. Pathologic criteria and prognostic implications. Cancer. (1985) 56:1106-11.
PubMed Abstract | Google Scholar
12. Omuro A, DeAngelis ML. Glioblastoma i inne złośliwe glejaki: przegląd kliniczny. JAMA. (2013) 310:1842-50. doi: 10.1001/jama.2013.280319
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Lakhman Y, Veeraraghavan H, Chaim J, Feier D, Goldman DA, Moskowitz CS, et al. Differentiation of uterine leiomyosarcoma from atypical leiomyoma: diagnostic accuracy of qualitative MR imaging features and feasibility of texture analysis. Eur Radiol. (2017) 27:2903-15. doi: 10.1007/s00330-016-4623-9
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Skogen K, Schulz A, Dormagen JB, Ganeshan B, Helseth E, Server A. Diagnostic performance of texture analysis on MRI in grading cerebral gliomas. Eur J Radiol. (2016) 85:824-9. doi: 10.1016/j.ejrad.2016.01.013
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Gibbs P, Turnbull WL. Textural analysis of contrast-enhanced MR images of the breast. Magn Reson Med. (2003) 50:92-8. doi: 10.1002/mrm.10496
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Castellano G, Bonilha L, Li LM, Cendes F. Texture analysis of medical images. Clin Radiol. (2004) 59:1061-9. doi: 10.1016/j.crad.2004.07.008
PubMed Abstract | CrossRef Full Text | Google Scholar
17. Davnall F, Yip CS, Ljungqvist G, Selmi M, Ng F, Sanghera B, et al. Assessment of tumor heterogeneity: an emerging imaging tool for clinical practice? Insights Imaging. (2012) 3:573-89. doi: 10.1007/s13244-012-0196-6
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Xiao DD, Yan PF, Wang YX, Osman MS, Zhao YH. Glioblastoma and primary central nervous system lymphoma: preoperative differentiation by using MRI-based 3D texture analysis. Clin Neurol Neurosurg. (2018) 173:84-90. doi: 10.1016/j.clineuro.2018.08.004
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Itakura H, Achrol AS, Mitchell LA, Loya JJ, Liu T, Westbroek EM, et al. Cechy obrazu rezonansu magnetycznego identyfikują podtypy fenotypowe glioblastoma z odmienną aktywnością szlaków molekularnych. Sci Transl Med. (2015) 7:303ra138. doi: 10.1126/scitranslmed.aaa7582
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Nioche C, Orlhac F, Boughdad S, Reuze S, Goya-Outi J, Robert C, et al. LIFEx: bezpłatne oprogramowanie do obliczania cech radiomedycznych w obrazowaniu multimodalnym w celu przyspieszenia postępów w charakterystyce heterogeniczności guza. Cancer Res. (2018) 78:4786-9. doi: 10.1158/0008-5472.Can-18-0125
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Hu LS, Ning S, Eschbacher JM, Gaw N, Dueck AC, Smith KA, et al. Multi-parametric MRI and texture analysis to visualize spatial histologic heterogeneity and tumor extent in glioblastoma. PLoS ONE. (2015) 10:e0141506. doi: 10.1371/journal.pone.0141506
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Florez E, Nichols T, Parker EE, Lirertte ST, Howard CM, Fatemi A. Multiparametric magnetic resonance imaging in the assessment of primary brain tumors through radiomic features: a metric for guided radiation treatment planning. Cureus. (2018) 10:e3426. doi: 10.7759/cureus.3426
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Mahmoud-Ghoneim D, Alkaabi MK, de Certaines JD, Goettsche MF. The impact of image dynamic range on texture classification of brain white matter. BMC Med Imaging. (2008) 8:18. doi: 10.1186/1471-2342-8-18
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Ahn SY, Park CM, Park SJ, Kim HJ, Song C, Lee SM, et al. Wartość prognostyczna cech tekstury tomografii komputerowej w niedrobnokomórkowych rakach płuca leczonych definitywną równoczesną chemioradioterapią. Invest Radiol. (2015) 50:719-25. doi: 10.1097/rli.000000000174
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Suh HB, Choi YS, Bae S, Ahn SS, Chang JH, Kang SG, et al. Primary central nervous system lymphoma and atypical glioblastoma: Differentiation using radiomics approach. Eur Radiol. (2018) 28:3832-9. doi: 10.1007/s00330-018-5368-4
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Mouthuy N, Cosnard G, Abarca-Quinones J, Michoux N. Multiparametryczne obrazowanie rezonansu magnetycznego w celu różnicowania glejaków o wysokim stopniu złośliwości i przerzutów do mózgu. J Neuroradiol. (2012) 39:301-7. doi: 10.1016/j.neurad.2011.11.002
PubMed Abstract | CrossRef Full Text | Google Scholar
27. Glotsos D, Spyridonos P, Cavouras D, Ravazoula P, Dadioti PA, Nikiforidis G. An image-analysis system based on support vector machines for automatic grade diagnosis of brain-tumour astrocytomas in clinical routine. Med Inform Internet Med. (2005) 30:179-93. doi: 10.1080/14639230500077444
PubMed Abstract | CrossRef Full Text | Google Scholar
28. Dellacasa Bellingegni A, Gruppioni E, Colazzo G, Davalli A, Sacchetti R, Guglielmelli E, et al. NLR, MLP, SVM, and LDA: a comparative analysis on EMG data from people with trans-radial amputation. J Neuroeng Rehabil. (2017) 14:82. doi: 10.1186/s12984-017-0290-6
PubMed Abstract | CrossRef Full Text | Google Scholar
29. Ion-Margineanu A, Van Cauter S, Sima DM, Maes F, Sunaert S, Himmelreich U, et al. Classifying glioblastoma multiforme follow-up progressive vs. responsive forms using multi-parametric MRI features. Front Neurosci. (2016) 10:615. doi: 10.3389/fnins.2016.00615
PubMed Abstract | CrossRef Full Text | Google Scholar
30. Fetit AE, Novak J, Peet AC, Arvanitits NT. Three-dimensional textural features of conventional MRI improve diagnostic classification of childhood brain tumours. NMR Biomed. (2015) 28:1174-84. doi: 10.1002/nbm.3353
PubMed Abstract | CrossRef Full Text | Google Scholar
31. Sun K, Huang SH, Wong DS, Jang SS. Projektowanie i zastosowanie metody wyboru zmiennych dla wielowarstwowej sieci neuronowej perceptronu z LASSO. IEEE Trans Neural Netw Learn Syst. (2017) 28:1386-96. doi: 10.1109/tnnls.2016.2542866
PubMed Abstract | CrossRef Full Text | Google Scholar
32. Louis DN, Perry A, Reifenberger G, von Deimling A, Figarella-Branger D, Cavenee WK, et al. The 2016 World Health Organization classification of tumors of the central nervous system: a summary. Acta Neuropathol. (2016) 131:803-20. doi: 10.1007/s00401-016-1545-1
PubMed Abstract | CrossRef Full Text | Google Scholar
.




