Frontiers in Pharmacology
Introduction
Olanzapina jest jednym z najszerzej stosowanych leków przeciwpsychotycznych drugiej generacji (SGAs) w schizofrenii, zaburzeniu dwubiegunowym i objawach psychotycznych. Oprócz poprawy w zakresie głównych objawów psychozy, olanzapina wykazuje dużą akceptowalność, zmniejsza liczbę przypadków przerwania leczenia i zapobiega nawrotom w przyszłości (Leucht i in., 2009). Wiele randomizowanych badań klinicznych (RCT) i metaanaliz sugeruje, że olanzapina jest jednym z najskuteczniejszych leków przeciwpsychotycznych u pacjentów ze schizofrenią (Leucht et al., 2013; Huhn et al., 2019).
Najczęstszym działaniem niepożądanym olanzapiny jest przyrost masy ciała (Allison et al., 1999). Olanzapina wywołuje największy przyrost masy ciała spośród SGAs. W badaniu Comparison of Atypicals for First Episode (CAFE) wykazano, że 80% pacjentów leczonych olanzapiną przybrało ponad 7% początkowej masy ciała w 52. tygodniu (McEvoy i in., 2007). Wskaźnik przerwania stosowania olanzapiny z powodu przyrostu masy ciała lub towarzyszących działań metabolicznych był 2-8 razy wyższy niż w przypadku innych leków przeciwpsychotycznych w badaniu Clinical Antipsychotic Trials in Intervention Effectiveness (CATIE) (Lieberman i in., 2005). Przyrost masy ciała, poza tym, że wiąże się z mniejszym przestrzeganiem zaleceń dotyczących leczenia, jest również związany z istotną chorobowością i śmiertelnością. Biorąc pod uwagę wysoki wskaźnik otyłości u pacjentów ze schizofrenią (42%), należy uważnie ocenić potencjalne ryzyko przyrostu masy ciała wywołanego olanzapiną (Newcomer, 2006). W niektórych badaniach z randomizacją kontrolowaną (RCT) stwierdzono, że pacjenci z chorobami psychicznymi umierają do 30 lat wcześniej niż populacja ogólna (Das-Munshi et al., 2017). Wiodącą przyczyną zgonów w tej populacji są choroby serca. Głównym czynnikiem ryzyka chorób serca i przedwczesnej śmierci u tych pacjentów jest przyrost masy ciała (Fekadu et al., 2015).
Mechanizmy leżące u podstaw indukowanego przez leki przeciwpsychotyczne przyrostu masy ciała i niekorzystnych efektów metabolicznych nie są dobrze poznane (Correll et al., 2011). Olanzapina jest związana z podwyższonym apetytem i przyjmowaniem pokarmów oraz zmniejszoną aktywnością lub upośledzeniem regulacji metabolicznej (Roerig i wsp., 2005; Henderson i wsp., 2015). Fountaine i wsp. donieśli, że u zdrowych mężczyzn olanzapina zwiększała masę ciała poprzez zwiększone spożycie pokarmu, bez dowodów na zmniejszenie aktywności lub poziomu wydatków (Fountaine i wsp., 2010). Obserwacja ta jest zgodna z obserwacjami dotyczącymi męskich młodocianych pacjentów z rozpoznaniem schizofrenii (Gothelf i in., 2002). Pacjenci mieli istotnie zwiększony wskaźnik masy ciała z powodu zwiększonego spożycia kalorii po 4-tygodniowym leczeniu olanzapiną (Gothelf i in., 2002). Jednak obecne dowody dotyczące związku apetytu z przyrostem masy ciała są niejednoznaczne (Poyurovsky i in., 2007; Case i in., 2010). Case i wsp. wykazali, że wczesne zmiany apetytu nie były konsekwentnie skorelowane z ogólną zmianą masy ciała w czterech różnych badaniach (Case i wsp., 2010). Ponadto w żadnym badaniu nie podano dokładnego czasu zwiększenia apetytu, nie porównano szybkości przyrostu masy ciała w zależności od czasu zwiększenia apetytu ani nie oceniono różnic w przyroście masy ciała i efektach metabolicznych między pacjentami ze zwiększonym i niezmienionym apetytem. Dlatego oceniliśmy związek między zwiększeniem apetytu a zmianami masy ciała wywołanymi olanzapiną i towarzyszącymi efektami metabolicznymi u pacjentów ze schizofrenią w pierwszej fazie leczenia, którzy nie są leczeni farmakologicznie.
Materiały i metody
Uczestnicy
Badanie to przeprowadzono w Instytucie Zdrowia Psychicznego Drugiego Szpitala Xiangya, Central South University, Chiny w okresie od grudnia 2016 r. do kwietnia 2019 r. Uczestników oceniano pod kątem schizofrenii zgodnie z kryteriami określonymi przez Diagnostic and Statistical Manual of Mental Disorders-Fifth Edition (DSM-5) (A.P. Association, 2013). Ponieważ pacjenci nie przyjmujący leków przeciwpsychotycznych/pierwszy epizod wydają się bardziej przybierać na wadze po leczeniu olanzapiną (Correll i in., 2011), do badania włączono chorych na schizofrenię pierwszego epizodu w wieku 18-50 lat.
Kryteria wykluczenia obejmowały (i) klinicznie nieprawidłowe wyniki badania fizykalnego, badań laboratoryjnych lub wyniki elektrokardiogramu (EKG); (ii) zaburzenia, takie jak niepełnosprawność intelektualna, zaburzenia związane z używaniem substancji lub alkoholu, rozpoznanie innych określonych chorób ogólnoustrojowych zgodnie z kryteriami DSM-5; (iii) choroby sercowo-naczyniowe i metaboliczne, takie jak cukrzyca, dyslipidemia i nadciśnienie; (iv) zaburzenia odżywiania w wywiadzie; (v) ścisła dieta w ciągu miesiąca przed badaniem przesiewowym lub podczas badania; oraz (vi) ciąża lub laktacja.
Interwencja
Wcześniejsze badania sugerowały, że tempo indukowanego olanzapiną przyrostu masy ciała było najszybsze podczas pierwszych 12 tygodni leczenia (Correll i wsp., 2009). Dlatego uczestnicy byli leczeni olanzapiną (15-20 mg/dobę o godzinie 20:00) przez 12 tygodni. Początkowa dawka olanzapiny wynosiła 5 mg/dobę, a następnie została dostosowana do 15-20 mg/dobę w pierwszym tygodniu.
Ocena
Oceny wyjściowe obejmowały dane demograficzne, dokładny wywiad medyczny, pomiary antropometryczne (waga i wzrost), apetyt, badanie fizykalne i analizy laboratoryjne. Apetyt był oceniany codziennie, 30 min przed obiadem, czterema standaryzowanymi pytaniami: Głód, Poczucie sytości, Myślenie o jedzeniu i Objadanie się. Odpowiedzi były oceniane w skali od 0 do 10, gdzie 0 = „wcale”, a 10 = „bardzo”. Wzrost apetytu definiowano jako >10% wzrost wyjściowych wyników apetytu. Spadek apetytu definiowano jako >10% spadek apetytu. Do oceny nasilenia objawów schizofrenii zastosowano skalę PANSS (Positive and Negative Syndrome Scale). Działania niepożądane oceniano za pomocą skali TESS (Treatment Emergent Symptom Scale). Podczas każdej wizyty kontrolnej powtarzano wszystkie oceny wyjściowe (w tym badanie przedmiotowe, pomiary antropometryczne, apetyt i TESS) z wyjątkiem PANSS. PANSS została ponownie oceniona w tygodniu 12.
Przed leczeniem i w stanie na czczo, masa ciała i wzrost zostały zmierzone po tym, jak uczestnicy zdjęli buty z lekkim ubraniem wewnętrznym. Apetyt oceniano przed obiadem i oparto na ocenie lekarza oceniającego w dniu badania. Wyniki badań laboratoryjnych, w tym stężenie glukozy w osoczu, czynność wątroby i nerek, oceniano za pomocą procedur enzymatycznych przy użyciu automatycznego analizatora chemicznego Boehringer Mannheim/Hitachi 714. Insulina była mierzona za pomocą testu immunoenzymatycznego ELISA (enzyme-linked immunosorbent assays).
Pierwszorzędowymi wynikami były odsetek pacjentów, którzy mieli zwiększony apetyt i okres czasu między leczeniem olanzapiną a zwiększonym apetytem. Wyniki drugorzędowe obejmowały zmiany masy ciała, wskaźnika masy ciała (BMI), glukozy na czczo, insuliny na czczo i wskaźnika insulinooporności, profili lipidowych, które obejmowały triglicerydy, cholesterol, lipoproteiny o dużej gęstości (HDL-C) i lipoproteiny o małej gęstości (LDL-C) oraz wynik w skali PANSS. BMI obliczano zgodnie z kryteriami Working Group on Obesity in China: zdrowa waga (18,5 ≤ BMI <25 kg/m2), nadwaga (25 ≤ BMI ≤ 28 kg/m2) i otyłość (BMI > 28 kg/m2). Dyslipidemię zdefiniowano jako cholesterol ≥ 5,18 mmolċl-1, triglicerydy ≥ 1,70 mmolċl-1, HDL-C < 1,04 mmolċl-1 lub LDL-C ≥ 3,37 mmolċl-1 na podstawie chińskich wytycznych dotyczących dyslipidemii (Hu, 2017). Włączono również analizę odsetka pacjentów, którzy uzyskali więcej niż 7% wyjściowej masy ciała po 12 tygodniach, co stanowi wartość graniczną dla klinicznie istotnego przyrostu masy ciała (Kanders i in., 1991).
Analiza statystyczna
Statistical Package for Social Sciences, wersja 25.0 (SPSS v25.0) został zastosowany do analizy statystycznej. Zmienne ciągłe i zmienne kategoryczne opisano za pomocą statystyk sumarycznych (średnie i odchylenia standardowe) lub częstości i procentów, odpowiednio. Test t-Studenta i analizę chi kwadrat zastosowano do analizy różnic pomiędzy grupami w zmianach masy ciała, BMI, stężenia glukozy i insuliny na czczo, wskaźnika insulinooporności, triglicerydów, cholesterolu, HDL-C i LDL-C od linii podstawowej do każdego punktu czasowego. Zbadaliśmy związek między wagą, BMI, wskaźnikiem insulinooporności, LDL-C i apetytem za pomocą analizy regresji liniowej. Wartość P (p) < 0,05 uznano za istotną statystycznie.
Wyniki
W badaniu uczestniczyło łącznie 33 pacjentów z rozpoznaniem schizofrenii (średni wiek, 23,5 roku; zakres 18-36 lat). Większy był odsetek kobiet (63,6%, 21/33). Wszyscy pacjenci znajdowali się w normie BMI (średnia BMI, 21,3 ± 1,7 kg/m2). Średni czas trwania schizofrenii wynosił 11,2 ± 3,7 (zakres 5-18) miesięcy. Dwie pacjentki zrezygnowały z udziału w badaniu po 4 tygodniach z powodu zwiększonego apetytu; pozostałych 31 (93,9%) uczestników ukończyło badanie (Tabela 1).
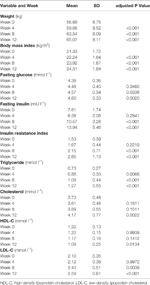
Tabela 1 Podsumowanie masy ciała i pomiarów metabolicznych według badań.
Zwiększenie apetytu po leczeniu olanzapiną
Po 12-tygodniowym leczeniu olanzapiną u 77,4% (24/31) pacjentów stwierdzono zwiększenie apetytu, a u 22,6% (7/31) pacjentów apetyt pozostał niezmieniony. Jak pokazano na rycinie 1, w przypadku 24 pacjentów, którzy mieli zwiększony apetyt, wzrost apetytu rozpoczął się w ciągu pierwszych 8 tygodni leczenia olanzapiną i trwał do końca leczenia. Średni czas od rozpoczęcia leczenia olanzapiną do zwiększenia apetytu wynosił 20,3 dnia (SD = 14,4), a 25,0% (6/24) i 70,8% (17/24) zwiększyło apetyt odpowiednio w ciągu 1 tygodnia i 4 tygodni. Dwóch pacjentów zwiększyło apetyt w 3. dniu po leczeniu olanzapiną. Nie stwierdzono istotnej różnicy w indukowanym olanzapiną apetycie pomiędzy różnymi płciami przy zastosowaniu dwukierunkowej analizy ANOVA.
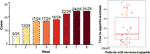
Rysunek 1 Liczba pacjentów ze zwiększonym apetytem podczas 8-tygodniowych okresów leczenia olanzapiną.
Changes of Body Weight and BMI After Olanzapine Treatment
Po leczeniu olanzapiną obserwowano istotne zwiększenie masy ciała i BMI (Tabela 1). Średni przyrost masy ciała wynosił 7,9 kg podczas 12-tygodniowego okresu leczenia olanzapiną, przy czym pacjenci przybrali na wadze odpowiednio 2,4, 4,0 i 1,5 kg w pierwszym, drugim i trzecim 4-tygodniowym okresie leczenia. Kobiety częściej przybierały na wadze (P < 0,001), przy czym średni przyrost masy ciała w okresie badania wynosił 9,19 kg w porównaniu z 5,90-kg przyrostem masy ciała u mężczyzn. Spośród wszystkich pacjentów 80,6% (25/31) i 61,3% (19/31) zwiększyło początkową masę ciała odpowiednio o więcej niż 7% i 10% podczas 12-tygodniowego leczenia olanzapiną (Tabela uzupełniająca 1). Po 12 tygodniach u 51,6% (16/31) pacjentów wystąpiła nadwaga (BMI>25 kg/m2).
Zmiany zaburzeń metabolicznych po leczeniu olanzapiną
W ciągu 12 tygodni obserwowano istotne zwiększenie stężenia glukozy na czczo, insuliny na czczo, wskaźnika insulinooporności, triglicerydów, cholesterolu i LDL-C oraz zmniejszenie stężenia HDL-C (Tabela 1). Żaden z pacjentów włączonych do badania nie miał dyslipidemii na poziomie wyjściowym. W oparciu o chińskie wytyczne dotyczące dyslipidemii, u 38,7% (12/31) pacjentów stwierdzono dyslipidemię po 12 tygodniach leczenia olanzapiną.
Appetite Increase and Olanzapine Induced Weight Gain
W celu wykrycia wpływu zwiększonego apetytu na indukowany olanzapiną przyrost masy ciała, podzieliliśmy pacjentów na dwie grupy (grupa zwiększonego apetytu i grupa niezmienionego apetytu ) w oparciu o to, czy apetyt zwiększył się czy nie po 12 tygodniach leczenia olanzapiną.
W porównaniu z grupą o niezmienionym apetycie, wystąpiły znaczące wzrosty masy ciała i poziomu BMI w grupie zwiększonego apetytu po 12-tygodniowym leczeniu olanzapiną (Tabela 2). Figura 2 pokazała porównanie przyrostu masy ciała i wyników związanych z metabolizmem między grupami zwiększonego i niezmienionego apetytu. Szczegółowe analizy przedstawiono w tabeli uzupełniającej 2. Przyrost masy ciała między dwiema grupami był znaczący (P = 0,01) przy użyciu dwukierunkowej analizy ANOVA. Średnia masa ciała wzrosła o 9,1 kg (SD = 4,1) w grupie o zwiększonym apetycie i 3,9 kg (SD = 2,0) w grupie o niezmienionym apetycie, z istotną różnicą między tymi dwiema grupami podczas 12-tygodniowego okresu leczenia olanzapiną. Większy odsetek pacjentów (91,7%) w grupie zwiększonego apetytu uzyskał więcej niż 7% początkowej masy ciała po 12 tygodniach w porównaniu z pacjentami w grupie niezmienionego apetytu (42,9%; χ2 = 8,27, df = 1, p = 0,004). Podobnie, więcej pacjentów w grupie zwiększonego apetytu (19/24, 79,2%) uzyskało więcej niż 10% początkowej masy ciała po 12 tygodniach w porównaniu z pacjentami w grupie niezmienionego apetytu (0,0%; χ2 = 14,32, df = 1, p < 0,001) (tabele uzupełniające 3-5). Po 12-tygodniowym leczeniu olanzapiną u 58,3% pacjentów wystąpiła nadwaga w grupie zwiększonego apetytu w porównaniu z 28,6% pacjentów w grupie niezmienionego apetytu. Zwiększenie apetytu silnie pośredniczyło w indukowanym olanzapiną przyroście masy ciała z efektem pośredniczącym 66,2%.

Tabela 2 Statystyki opisowe miar wyników między grupami zwiększonego i niezmienionego apetytu na poziomie podstawowym oraz w tygodniach 4, 8 i 12.
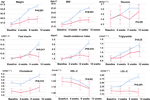
Rysunek 2 Porównanie masy ciała, BMI, stężenia glukozy i lipidów między grupami o zwiększonym i niezmienionym apetycie. Niebieska linia oznacza pacjentów ze zwiększonym apetytem; czerwona linia oznacza pacjentów z niezmienionym apetytem.
Appetite Increase and Olanzapine Induced Metabolic Disturbances
Zaobserwowano istotne różnice w stężeniu insuliny (p = 0,017), wskaźnika insulinooporności (p = 0,015) i LDL-C (p = 0,001) pomiędzy grupami zwiększonego apetytu i niezmienionego apetytu po 12 tygodniach (Figura 2 i Tabela 2). Czterech pacjentów z grupy zwiększonego apetytu miało cholesterol ≥ 5,18 mmolċl-1, dziewięciu miało triglicerydy ≥ 1,70 mmolċl-1, sześciu miało HDL-C < 1,04ċmmol l-1, a trzech miało LDL-C ≥ 3,37 mmolċl-1 w 12 tygodniu. W sumie 13/24 pacjentów w grupie zwiększonego apetytu miało dyslipidemię po 12 tygodniach, podczas gdy u żadnego z pacjentów w grupie niezmienionego apetytu nie rozwinęła się dyslipidemia w okresie badania (Tabela 3).

Tabela 3 Dyslipidemia określona przez każdy pojedynczy pomiar wyniku w grupach zwiększonego i niezmienionego apetytu.
Szczytowy przyrost masy ciała osiągnięty 1 miesiąc po miesiącu zwiększenia apetytu
W grupie zwiększonego apetytu przeanalizowaliśmy średni przyrost masy ciała dla każdego pacjenta w czterech punktach czasowych: przed miesiącem czasu do zwiększenia apetytu (-1M), miesiąc czasu do zwiększenia apetytu (0M), jeden miesiąc po zwiększeniu apetytu (+1M) i dwa miesiące po zwiększeniu apetytu (+2M). W porównaniu z -1M, nastąpił wzrost przyrostu masy ciała w 0M, ale zmiana ta nie była istotna (-1M vs. 0M, 1,4 ± 1,2 kg vs. 3,1 ± 1,4 kg). Przyrost masy ciała wszedł w szczytowy okres wzrostu przy +1M, z 4,3 ± 2.4 kg wzrost. Weight Growth decelerated at +2M (p < 0.001) by 1.6 ± 1.5 kg. Przyrost masy ciała przy +2M zwolnił i ustabilizował się, a w porównaniu z -1M nie zaobserwowano istotnych różnic (rycina 3 i tabela uzupełniająca 6).
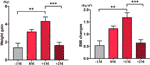
Rysunek 3 Średnia prędkość przyrostu masy ciała w grupie zwiększonego apetytu. Średni przyrost masy ciała dla każdego pacjenta na miesiąc w okresie badania analizowano w czterech punktach czasowych: przed miesiącem czasu zwiększonego apetytu (-1M), w miesiącu czasu zwiększonego apetytu (0M), 1 miesiąc po miesiącu czasu zwiększonego apetytu (+1M) i 2 miesiące po miesiącu czasu zwiększonego apetytu (+2M). ** wskazuje P < 0,01, *** wskazuje P < 0,001.
Earlier Increased Appetite Predicts More Weight Gain in 1 Month After the Month of Appetite Increase
We further compared the weight gain velocity of participants with increased appetite within 4 weeks (A) and participants with an increased appetite between 4 and 8 weeks (B). Przy 0M, prędkości przyrostu masy ciała między uczestnikami ze zwiększonym apetytem w ciągu 4 tygodni i uczestników ze zwiększonym apetytem między 4 i 8 tygodni nie były znacząco różne. Jednakże uczestnicy z wcześniejszym zwiększonym apetytem wykazywali istotnie większą prędkość przyrostu masy ciała przy +1M. Wyniki te wskazują, że wcześniejszy wzrost apetytu może prowadzić do większego przyrostu masy ciała w okresie obserwacji (ryc. 4). Podobne zmiany BMI obserwowano w czterech punktach czasowych (ryc. 3 i 4).
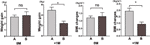
Rycina 4 Porównanie prędkości przyrostu masy ciała uczestników ze zwiększonym apetytem w różnych miesiącach. Porównaliśmy prędkość przyrostu masy ciała uczestników ze zwiększonym apetytem w ciągu 4 tygodni (A) i uczestników ze zwiększonym apetytem między 4 a 8 tygodniem (B) w miesiącu czasu do zwiększonego apetytu (0M) i 1 miesiąc po miesiącu czasu do zwiększonego apetytu (+1M). ns, oznacza nieistotne, * oznacza P < 0,05.
Appetite and Velocity of Metabolic Disturbance Changes
Szczegółowe dane opisowe zmian masy ciała, BMI, glukozy na czczo, insuliny, wskaźnika insulinooporności, triglicerydów, cholesterolu, HDL-C i LDL-C podsumowano w tabeli 2 Aby zbadać związek między zwiększonym apetytem a metabolizmem glukozy i lipidów, przeanalizowaliśmy zmiany tych wskaźników w czterech punktach czasowych w grupie zwiększonego apetytu. Nie zaobserwowano istotnych zmian prędkości dla glukozy, triglicerydów, HDL-C i LDL-C w żadnym punkcie czasowym. Istotny wzrost prędkości insuliny i wskaźnika insulinooporności zaobserwowano jedynie w punkcie +2M (ryc. 1 i tab. 6). Dalsze porównania sugerowały, że uczestnicy ze zwiększonym apetytem w ciągu 4 tygodni nie wykazywali istotnie zwiększonej prędkości insuliny i wskaźnika insulinooporności przy 0M i +1M w porównaniu z uczestnikami ze zwiększonym apetytem między 4 a 8 tygodniem (Rycina uzupełniająca 2).
Przewidywanie wpływu apetytu na indukowany olanzapiną przyrost masy ciała i zaburzenia metaboliczne
Przeprowadziliśmy analizę regresji liniowej, aby ocenić wpływ wzrostu apetytu na przyrost masy ciała, stężenie glukozy we krwi i lipidów. Po kontroli statystycznie istotnych zmiennych, takich jak płeć, wiek, wzrost i czas trwania, uwzględniliśmy przyrost masy ciała, BMI, glukozę na czczo, insulinę, wskaźnik insulinooporności, triglicerydy, cholesterol, HDL-C i LDL-C jako zmienne zależne oraz apetyt jako zmienną niezależną w analizie regresji. Wzrost apetytu był związany ze zmianami masy ciała (β = 0,67, p =0,0003), BMI (β = 0,63, p = 0,0004), insuliny (β = 0,49, p = 0,019), wskaźnika insulinooporności (β = 0,51, p = 0,0149) i LDL-C (β = 0.61, p = 0,0035) (Tabela uzupełniająca 7).
Po leczeniu olanzapiną obserwowano istotną poprawę objawów klinicznych (ocenianych za pomocą PANSS, p < 0,001) od punktu wyjściowego do końcowego. Nie zaobserwowano istotnej różnicy w PANSS pomiędzy grupami zwiększonego apetytu i niezmienionego apetytu (p > 0,05).
Działania niepożądane
Wśród wszystkich 31 pacjentów, którzy ukończyli badanie, dziewięciu (29.0%) pacjentów zgłosiło hipoaktywność, ośmiu (25,8%) pacjentów zgłosiło senność, czterech (12,9%) pacjentów miało nieprawidłowe wyniki testów wątrobowych, dwóch (6,5%) pacjentów zgłosiło akatyzję, czterech (12,9%) pacjentów miało zaparcia, jeden (3.2%) pacjentów miało biegunkę, a dwóch (6,5%) pacjentów odczuwało zawroty głowy, a 80,6% (25/31) pacjentów zwiększyło masę ciała o więcej niż 7% w okresie badania.
Dyskusja
W tym prospektywnym badaniu, główne ustalenia wykazały, że 77,4% pacjentów zwiększyło apetyt po leczeniu olanzapiną, a ci pacjenci, którzy zwiększyli apetyt, przybrali na wadze więcej niż pacjenci z niezmienionym apetytem (9,1 kg vs. 3,9 kg). Podobnie, więcej pacjentów w grupie zwiększonego apetytu zwiększyło początkową masę ciała o więcej niż 7 lub 10%, co sugeruje, że zwiększony apetyt wiąże się ze znacznym przyrostem masy ciała u pacjentów z rozpoznaniem schizofrenii w pierwszym okresie leczenia nieotrzymujących leków, leczonych olanzapiną. Co więcej, analiza regresji liniowej również potwierdziła, że zwiększenie apetytu było silnie związane z indukowanym przez olanzapinę przyrostem masy ciała. Wyniki te były zgodne z wcześniejszymi doniesieniami (Gothelf i wsp., 2002; Cope i wsp., 2005). Murashita i wsp. (2005) zaobserwowali zwiększony poziom pobudzającej apetyt greliny oraz procentową zawartość tłuszczu w organizmie u pacjentów ze schizofrenią leczonych olanzapiną. Wyniki randomizowanego badania z podwójnie ślepą próbą sugerowały, że olanzapina indukowała głód pokarmowy i nadmierne objadanie się w większym stopniu niż klozapina (Murashita i in., 2005; Kluge i in., 2007). Podobne wyniki uzyskano również u myszy leczonych olanzapiną (Cope i in., 2005). Działanie olanzapiny na wiele miejsc receptorowych, szczególnie na receptory D2 i 5H3, które modulują apetyt, znalazło również zastosowanie w leczeniu anorexia nervosa oraz nudności i wymiotów wywołanych chemioterapią (Kluge i wsp., 2007; Tan i wsp., 2009; Kafantaris i wsp., 2011).
Stwierdziliśmy również, że u 70,8% pacjentów apetyt zwiększył się w ciągu pierwszych 4 tygodni początkowego leczenia olanzapiną, ze średnią 20,3 dnia do zwiększenia apetytu. Niektórzy pacjenci nawet zwiększyli swój apetyt już w trzecim dniu po leczeniu olanzapiną. Co ciekawe, pacjenci, u których apetyt zwiększył się wcześniej, prawdopodobnie przybrali na wadze więcej niż pacjenci, u których apetyt zwiększył się później, a przyrost masy ciała osiągnął szczyt po 1 miesiącu od wystąpienia zwiększonego apetytu. Chociaż nie stwierdzono istotnej różnicy w indukowanym olanzapiną apetycie między mężczyznami a kobietami, pacjenci płci żeńskiej częściej przybierają na wadze (P < 0,001). Dlatego apetyt powinien być uważany za wskaźnik przewidywania indukowanego olanzapiną przyrostu masy ciała, szczególnie u pacjentów płci żeńskiej. W warunkach klinicznych lekarze powinni zwracać większą uwagę na pacjentów, u których apetyt wzrasta wcześnie po leczeniu olanzapiną i powinni rozpocząć plan zapobiegania przybieraniu na wadze.
Pacjenci leczeni olanzapiną wykazywali wzrost o ponad 7% początkowej masy ciała, co jest zgodne z wcześniejszymi ustaleniami (Gothelf i in., 2002; Wu i in., 2008). Oprócz znacznego przyrostu masy ciała, pacjenci leczeni olanzapiną mieli istotnie zaburzony metabolizm glukozy i lipidów po 12 tygodniach, co jest zgodne z wcześniej opublikowanymi obserwacjami u pacjentów ze schizofrenią (Correll et al., 2011). W porównaniu z pacjentami z grupy o niezmienionym apetycie, w grupie o zwiększonym apetycie występowały istotne nieprawidłowości lipidowe. Glukoza na czczo nie różniła się istotnie między tymi dwiema grupami. Uczestnicy z wczesnym zwiększonym apetytem nie wykazywali zwiększonej szybkości działania insuliny i wskaźnika insulinooporności w kolejnych miesiącach po zwiększeniu apetytu. Możliwe jest, że poziom glukozy jest niezależny od przyrostu masy ciała, ponieważ apetyt nie wpływał na poziom glukozy.
Niekorzystne fizyczne wyniki zdrowotne związane ze stosowaniem leków przeciwpsychotycznych, takie jak przyrost masy ciała, zaburzenia metaboliczne i związana z nimi zachorowalność, zostały już dawno rozpoznane (Wu i wsp., 2016). Wcześniejsze badania sugerowały, że apetyt może przewidywać indukowany olanzapiną przyrost masy ciała i niekorzystne efekty metaboliczne (Gothelf i in., 2002; Poyurovsky i in., 2007; Fountaine i in., 2010). Według naszej wiedzy, jest to pierwsze badanie oceniające związek między apetytem, przyrostem masy ciała i zaburzeniami metabolicznymi po leczeniu olanzapiną u nieaktywnych lekowo pacjentów z pierwszym epizodem schizofrenii. Niektóre ustalenia dają nam więcej dowodów na to, jak rozsądnie dobierać leki w pracy klinicznej i dają więcej korzyści w zapobieganiu wywołanego olanzapiną przyrostu masy ciała i zaburzeń metabolicznych.
Istnieje kilka ograniczeń naszego badania. Po pierwsze, badanie to nie mierzyło spożycia żywności, takich jak posiłki i przekąski, chociaż wszyscy pacjenci objęci badaniem otrzymali ten sam standaryzowany jadłospis. Wysokie spożycie tłuszczu i fruktozy może zmniejszać kontrolę apetytu poprzez wpływ na centralną regulację apetytu. Rzeczywiście, diety wysokofruktozowe mają niekorzystny wpływ na centralną sygnalizację apetytu i funkcje poznawcze (Lowette i in., 2015; Dalvi i in., 2017). Po drugie, nie badaliśmy poziomu leptyny i greliny w okresie badania. Wydzielane odpowiednio z tkanki tłuszczowej i żołądka, leptyna i grelina odgrywają kluczowe role w regulacji przyjmowania pokarmu i metabolizmu energetycznego (Cui i in., 2017). W kilku badaniach stwierdzono podwyższony poziom leptyny i obniżony poziom greliny w pierwszych kilku tygodniach po rozpoczęciu terapii olanzapiną (Basoglu i wsp., 2010; Stip i wsp., 2012; Lu i wsp., 2015). Wzrost poziomu leptyny utrzymuje się na stałym poziomie przez kilka tygodni, natomiast poziom greliny wzrasta w dłuższym okresie (Sentissi i in., 2008). Dalsze badania powinny monitorować odpowiedzi leptyny i greliny na wzrost apetytu, a także ich związki z parametrami metabolicznymi i efektami klinicznymi. Ponadto, nie monitorowaliśmy poziomu aktywności podczas okresu badania. Chociaż w niektórych badaniach odnotowano, że olanzapina zwiększała masę ciała wyłącznie poprzez zwiększenie apetytu i spożycia pokarmu, bez istotnych różnic w spoczynkowym wydatku energetycznym (Gothelf i in., 2002; Fountaine i in., 2010). W wielu badaniach odnotowano zmniejszenie aktywności fizycznej przy stosowaniu leków z olanzapiną (Perez-Cruzado et al., 2018). W naszym badaniu 29,0% pacjentów zgłaszało hipoaktywność i 25,8% pacjentów zgłaszało senność podczas 12-tygodniowego okresu leczenia olanzapiną. Hillebrand i wsp. (2005) stwierdzili, że leczenie olanzapiną zmniejszało aktywność fizyczną u szczurów narażonych na anoreksję opartą na aktywności. Leczenie olanzapiną zmniejszyło również poziom aktywności u pacjentek z anorexia nervosa, bez znaczących różnic w masie ciała i stężeniu leptyny w osoczu w porównaniu z pacjentkami nieleczonymi. W naszym poprzednim badaniu wykazaliśmy, że interwencje dotyczące stylu życia, które obejmowały programy psychoedukacyjne, dietetyczne i ćwiczenia fizyczne, mogą zmniejszyć indukowany lekami przeciwpsychotycznymi przyrost masy ciała (Wu i in., 2008). Co więcej, lepiej byłoby porównać większą liczbę pacjentów ze zdrowymi osobami z grupy kontrolnej w podobnym wieku, co może pomóc w interpretacji, czy indukowany olanzapiną wzrost apetytu i zmiany metaboliczne są związane z jej właściwościami farmakologicznymi. Dalsze badania powinny koncentrować się na mechanizmach zwiększonego apetytu po leczeniu olanzapiną (Koopmann i wsp., 2012; Sweeney i wsp., 2017; Mancuso i wsp., 2019). Układ nagrody w regionach prążkowia może być związany ze związanym z leczeniem przeciwpsychotycznym przyrostem masy ciała (Nielsen i wsp., 2016). Zmieniona aktywność w subgenitalnej przedniej korze zakrętu obręczy może również częściowo leżeć u podstaw zwiększonego apetytu po leczeniu olanzapiną (Pawlowski et al., 2018). Należy przeprowadzić badania obrazowe w celu zbadania modulacji przez olanzapinę powiązanej głębokiej aktywności mózgu związanej z apetytem.
Wnioski
W podsumowaniu, nasze badanie wykazało, że apetyt jest związany z indukowanym przez olanzapinę przyrostem masy ciała i dyslipidemią u pacjentów ze schizofrenią w pierwszej fazie leczenia (drug-naïve). Ocena zmian apetytu jest łatwym i praktycznym sposobem przewidywania przyrostu masy ciała, co daje klinicystom więcej czasu i możliwości dla strategii interwencyjnych. Wczesne wynalazki dietetyczne mające na celu zmniejszenie apetytu i zmniejszenie spożycia żywności mogą być pomocne w kontroli masy ciała u pacjentów ze schizofrenią leczonych olanzapiną.
Oświadczenie o dostępności danych
Zestawy danych wygenerowane dla tego badania są dostępne na żądanie do odpowiedniego autora.
Oświadczenie o etyce
Badanie to zostało przeprowadzone zgodnie z Deklaracją Helsińską (Stowarzyszenie G.A.o.t.W.M., 2013) i zatwierdzone przez Komisję Etyczną Drugiego Szpitala Xiangya, Central South University. Po pełnym opisie badania uczestnikom uzyskano świadomą zgodę przed udziałem w badaniu.
Author Contributions
JH przeanalizował i zinterpretował dane pacjentów i miał duży wkład w napisanie manuskryptu. G-RH głównie zaprojektowała i przeprowadziła badanie. YeY, C-CL, J-MX, Y-JL i X-JP pomagali w rekrutacji pacjentów, monitorowaniu jakości danych i dokumentowaniu zdarzeń niepożądanych związanych z leczeniem. YiY pomagał w korekcie manuskryptu. J-PZ kierował projektem badania. RR-W był odpowiedzialny za ogólną treść pracy. Wszyscy autorzy przeczytali i zatwierdzili ostateczną wersję manuskryptu.
Funding
Ta praca była wspierana przez Key R&D Program Projects, National Science Foundation of China (Grant No.2016YFC1306900) i National Nature Science Foundation of China (Grant No.81622018 and No. 81901401).
Konflikt interesów
Autorzy oświadczają, że badania zostały przeprowadzone przy braku jakichkolwiek komercyjnych lub finansowych relacji, które mogłyby być interpretowane jako potencjalny konflikt interesów.
Podziękowania
Chcielibyśmy wyrazić uznanie dla cennego wkładu uczestników i wsparcia ze strony ich lekarzy pierwszego kontaktu. Chcemy również podziękować kilku anonimowym recenzentom za ich cenne uwagi i sugestie, które poprawiły jakość pracy.
Materiały uzupełniające
Materiały uzupełniające do tego artykułu można znaleźć online pod adresem: https://www.frontiersin.org/articles/10.3389/fphar.2020.00739/full#supplementary-material
Suplement Figure 1 | Velocity of blood glucose and lipid changes in increased appetite group. Analizowano średnie wartości zmian dla każdego pacjenta w każdym miesiącu w okresie badania w czterech punktach czasowych: przed miesiącem zwiększonego apetytu (-1M), w miesiącu zwiększonego apetytu (0M), 1 miesiąc po miesiącu zwiększonego apetytu (+1M) i 2 miesiące po miesiącu zwiększonego apetytu (+2M).
Suplement Rycina 2 | Porównanie prędkości zmian insuliny i wskaźnika insulinooporności u uczestników ze zwiększonym apetytem w różnych miesiącach. Porównaliśmy prędkość uczestników ze zwiększonym apetytem w ciągu 4 tygodni (A) i uczestników ze zwiększonym apetytem między 4-8 tygodniem (B) w miesiącu czasu do zwiększonego apetytu (0M) i 1 miesiąc po miesiącu czasu do zwiększonego apetytu (+1M).
Suplement Table 1 | Liczba pacjentów, którzy zwiększyli początkową masę ciała o więcej niż 7% lub 10% w tygodniach 4, 8, i 12.
Suplement Table 2 | Liczba pacjentów, którzy zwiększyli początkową masę ciała o więcej niż 7% lub 10% w tygodniach 4, 8, i 12 u pacjentów ze zwiększonym apetytem.
Podsumowanie Tabela 3 | Liczba pacjentów, u których początkowa masa ciała zwiększyła się o więcej niż 7% lub 10% w tygodniach 4, 8 i 12 u pacjentów z niezmienionym apetytem.
Podsumowanie Tabela 4 | Porównanie liczby pacjentów, u których nastąpił 7% lub 10% przyrost masy ciała pomiędzy pacjentami ze zwiększonym apetytem a pacjentami z niezmienionym apetytem w tygodniach 4, 8 i 12.
Suplement Table 5 | Analiza prędkości średnich przyrostów masy ciała, glukozy i zmian lipidowych w grupie o zwiększonym apetycie w czterech punktach czasowych: przed miesiącem czasu do zwiększenia apetytu (-1M), miesiąc czasu do zwiększenia apetytu (0M), 1 miesiąc po miesiącu czasu do zwiększenia apetytu (+1M) i 2 miesiące po miesiącu czasu do zwiększenia apetytu (+2M). ns oznacza nieistotne, * oznacza p-value < 0.05, ** oznacza p-value < 0.01, *** oznacza p-value < 0.001.
Suplement Tabela 6 | Oszacowania wpływu apetytu na przyrost masy ciała i związane z metabolizmem miary wyników z ogólnego liniowego modelu mieszanego przy kontroli dla wieku, czasu trwania choroby i płci.
Suplement Tabela 7-1 | Zmiany masy ciała, BMI, insuliny, IRI i LDL-C na pacjenta w okresie leczenia w różnych grupach.
Suplement Tabela 7-2 | Oszacowanie wpływu apetytu na przyrost masy ciała i związane z metabolizmem wskaźniki wyników.
Skróty
SGAs, Second-generation antipsychotics; RCT, Randomized clinical trial; CAFÉ, The Comparison of Atypicals for First Episode; CATIE, The Clinical Antipsychotic Trials in Intervention Effectiveness; DSM-5, The Diagnostic and Statistical Manual of Mental Disorders-Fifth Edition; ECG, elektrokardiogram; PANSS, The Positive and Negative Syndrome Scale; TESS, Treatment Emergent Symptom Scale; ELISA, Enzyme-linked immunosorbent assays; BMI, Body mass index; HDL-C, High-density lipoprotein; LDL-C, Low-density lipoprotein.
Allison, D. B., Mentore, J. L., Heo, M., Chandler, L. P., Cappelleri, J. C., Infante, M. C., et al. (1999). Antipsychotic-induced weight gain: a comprehensive research synthesis. Am. J. Psychiatry 156, 1686-1696. doi: 10.1176/ajp.156.11.1686
PubMed Abstract | CrossRef Full Text | Google Scholar
Association, A.P. (2013). Diagnostic and statistical manual of mental disorders (DSM-5®) (Arlington, VA: American Psychiatric Pub).
Google Scholar
Basoglu, C., Oner, O., Gunes, C., Semiz, U. B., Ates, A. M., Algul, A., et al. (2010). poziom ghreliny, cholecystokininy, wisfatyny, leptyny i białka związanego z agouti podczas 6-tygodniowego leczenia olanzapiną u mężczyzn z psychozą w pierwszym epizodzie. Int. Clin. Psychopharmacol. 25, 165-171. doi: 10.1097/YIC.0b013e3283377850
PubMed Abstract | CrossRef Full Text | Google Scholar
Case, M., Treuer, T., Karagianis, J., Hoffmann, V. P. (2010). The potential role of appetite in predicting weight changes during treatment with olanzapine. BMC Psychiatry 10, 72. doi: 10.1186/1471-244X-10-72
PubMed Abstract | CrossRef Full Text | Google Scholar
Cope, M., Nagy, T., Fernandez, J., Geary, N., Casey, D., Allison, D. (2005). Antipsychotic drug-induced weight gain: development of an animal model. Int. J. Obes. 29, 607. doi: 10.1038/sj.ijo.0802928
CrossRef Full Text | Google Scholar
Correll, C. U., Manu, P., Olshanskiy, V., Napolitano, B., Kane, J. M., Malhotra, A. K. (2009). Cardiometabolic risk of second-generation antipsychotic medications during first-time use in children and adolescents. Jama 302, 1765-1773. doi: 10.1001/jama.2009.1549
PubMed Abstract | CrossRef Full Text | Google Scholar
Correll, C. U., Lencz, T., Malhotra, A. K. (2011). Leki przeciwpsychotyczne a otyłość. Trends Mol. Med. 17, 97-107. doi: 10.1016/j.molmed.2010.10.010
PubMed Abstract | CrossRef Full Text | Google Scholar
Cui, H., Lopez, M., Rahmouni, K. (2017). The cellular and molecular bases of leptin and ghrelin resistance in obesity. Nat. Rev. Endocrinol. 13, 338-351. doi: 10.1038/nrendo.2016.222
PubMed Abstract | CrossRef Full Text | Google Scholar
Dalvi, P. S., Chalmers, J. A., Luo, V., Han, D. Y., Wellhauser, L., Liu, Y., et al. (2017). High fat induces acute and chronic inflammation in the hypothalamus: effect of high-fat diet, palmitate and TNF-alpha on appetite-regulating NPY neurons. Int. J. Obes. (Lond) 41, 149-158. doi: 10.1038/ijo.2016.183
PubMed Abstract | CrossRef Full Text | Google Scholar
Das-Munshi, J., Chang, C.-K., Dutta, R., Morgan, C., Nazroo, J., Stewart, R., et al. (2017). Pochodzenie etniczne i nadmierna śmiertelność w ciężkich chorobach psychicznych: badanie kohortowe. Lancet Psychiatry 4, 389-399. doi: 10.1016/S2215-0366(17)30097-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Fekadu, A., Medhin, G., Kebede, D., Alem, A., Cleare, A. J., Prince, M., et al. (2015). Excess mortality in severe mental illness: 10-year population-based cohort study in rural Ethiopia. Br. J. Psychiatry 206, 289-296. doi: 10.1192/bjp.bp.114.149112
PubMed Abstract | CrossRef Full Text | Google Scholar
Fountaine, R. J., Taylor, A. E., Mancuso, J. P., Greenway, F. L., Byerley, L. O., Smith, S. R., et al. (2010). Increased food intake and energy expenditure following administration of olanzapine to healthy men. Obesity 18, 1646-1651. doi: 10.1038/oby.2010.6
PubMed Abstract | CrossRef Full Text | Google Scholar
Stowarzyszenie G.A.o.t.W.M. (2013). Deklaracja Helsińska Światowego Stowarzyszenia Medycznego: zasady etyczne dla badań medycznych z udziałem ludzi. JAMA 10 (20) 2191-2194. doi: 10.1001/jama.2013.281053
CrossRef Full Text | Google Scholar
Gothelf, D., Falk, B., Singer, P., Kairi, M., Phillip, M., Zigel, L., et al. (2002). Weight gain associated with increased food intake and low habitual activity levels in male adolescent schizophrenic inpatients treated with olanzapine. Am. J. Psychiatry 159, 1055-1057. doi: 10.1176/appi.ajp.159.6.1055
PubMed Abstract | CrossRef Full Text | Google Scholar
Henderson, D. C., Vincenzi, B., Andrea, N. V., Ulloa, M., Copeland, P. M. (2015). Patofizjologiczne mechanizmy zwiększonego ryzyka kardiometabolicznego u osób ze schizofrenią i innymi ciężkimi chorobami psychicznymi. Lancet Psychiatry 2, 452-464. doi: 10.1016/S2215-0366(15)00115-7
PubMed Abstract | CrossRef Full Text | Google Scholar
Hillebrand, J. J., van Elburg, A. A., Kas, M. J., van Engeland, H., Adan, R. A. (2005). Olanzapine reduces physical activity in rats exposed to activity-based anorexia: possible implications for treatment of anorexia nervosa? Biol. Psychiatry 58, 651-657.
PubMed Abstract | Google Scholar
Hu, D.-Y. (2017). Nowe wytyczne i dowody dotyczące zapobiegania i leczenia dyslipidemii i miażdżycowej choroby sercowo-naczyniowej w Chinach. Chronic Dis. Trans. Med. 3, 73. doi: 10.1016/j.cdtm.2016.11.001
CrossRef Full Text | Google Scholar
Huhn, M., Nikolakopoulou, A., Schneider-Thoma, J., Krause, M., Samara, M., Peter, N., et al. (2019). Comparative efficacy and tolerability of 32 oral antipsychotics for the acute treatment of adults with multi-episode schizophrenia: a systematic review and network meta-analysis. Lancet 394 (10202), 939-951. doi: 10.1016/S0140-6736(19)31135-3
PubMed Abstract | CrossRef Full Text | Google Scholar
Kafantaris, V., Leigh, E., Hertz, S., Berest, A., Schebendach, J., Sterling, W. M., et al. (2011). A placebo-controlled pilot study of adjunctive olanzapine for adolescents with anorexia nervosa. J. Child Adolesc. Psychopharmacol. 21, 207-212. doi: 10.1089/cap.2010.0139
PubMed Abstract | CrossRef Full Text | Google Scholar
Kanders, B., Forse, R., Blackburn, G. (1991). Metody w otyłości. Conn’s Current Therapy. Ed. Rakel, R. E. (Philadelphia: WB Saunders), 524-532.
Google Scholar
Kluge, M., Schuld, A., Himmerich, H., Dalal, M., Schacht, A., Wehmeier, P. M., et al. (2007). Clozapine and olanzapine are associated with food craving and binge eating: results from a randomized double-blind study. J. Clin. Psychopharmacol. 27, 662-666. doi: 10.1097/jcp.0b013e31815a8872
PubMed Abstract | CrossRef Full Text | Google Scholar
Koopmann, A., von der Goltz, C., Grosshans, M., Dinter, C., Vitale, M., Wiedemann, K., et al. (2012). The association of the appetitive peptide acetylated ghrelin with alcohol craving in early abstinent alcohol dependent individuals. Psychoneuroendocrinology 37, 980-986. doi: 10.1016/j.psyneuen.2011.11.005
PubMed Abstract | CrossRef Full Text | Google Scholar
Leucht, S., Corves, C., Arbter, D., Engel, R. R., Li, C., Davis, J. M. (2009). Second-generation versus first-generation antipsychotic drugs for schizophrenia: a meta-analysis. Lancet 373, 31-41. doi: 10.1016/S0140-6736(08)61764-X
PubMed Abstract | CrossRef Full Text | Google Scholar
Leucht, S., Cipriani, A., Spineli, L., Mavridis, D., Orey, D., Richter, F., et al. (2013). Comparative efficacy and tolerability of 15 antipsychotic drugs in schizophrenia: a multiple-treatments meta-analysis. Lancet 382, 951-962. doi: 10.1016/S0140-6736(13)60733-3
PubMed Abstract | CrossRef Full Text | Google Scholar
Lieberman, J. A., Stroup, T. S., McEvoy, J. P., Swartz, M. S., Rosenheck, R. A., Perkins, D. O., et al. (2005). Effectiveness of antipsychotic drugs in patients with chronic schizophrenia. New Engl. J. Med. 353, 1209-1223. doi: 10.1056/NEJMoa051688
CrossRef Full Text | Google Scholar
Lowette, K., Roosen, L., Tack, J., Vanden Berghe, P. (2015). Effects of high-fructose diets on central appetite signaling and cognitive function. Front. Nutr. 2, 5. doi: 10.3389/fnut.2015.00005
PubMed Abstract | CrossRef Full Text | Google Scholar
Lu, M. L., Wang, T. N., Lin, T. Y., Shao, W. C., Chang, S. H., Chou, J. Y., et al. (2015). Differential effects of olanzapine and clozapine on plasma levels of adipocytokines and total ghrelin. Prog. Neuropsychopharmacol. Biol. Psychiatry 58, 47-50.
PubMed Abstract | Google Scholar
Mancuso, C., Izquierdo, A., Slattery, M., Becker, K. R., Plessow, F., Thomas, J. J., et al. (2019). Changes in Appetite-Regulating Hormones Following Food Intake are Associated with Changes in Reported Appetite and a Measure of Hedonic Eating in Girls and Young Women with Anorexia Nervosa. Psychoneuroendocrinology 113, 104556. doi: 10.1016/j.psyneuen.2019.104556
PubMed Abstract | CrossRef Full Text | Google Scholar
McEvoy, J. P., Lieberman, J. A., Perkins, D. O., Hamer, R. M., Gu, H., Lazarus, A., et al. (2007). Efficacy and tolerability of olanzapine, quetiapine, and risperidone in the treatment of early psychosis: a randomized, double-blind 52-week comparison. Am. J. Psychiatry 164, 1050-1060. doi: 10.1176/ajp.2007.164.7.1050
PubMed Abstract | CrossRef Full Text | Google Scholar
Murashita, M., Kusumi, I., Inoue, T., Takahashi, Y., Hosoda, H., Kangawa, K., et al. (2005). Olanzapine increases plasma ghrelin level in patients with schizophrenia. Psychoneuroendocrinology 30, 106-110. doi: 10.1016/j.psyneuen.2004.05.008
PubMed Abstract | CrossRef Full Text | Google Scholar
Newcomer, J. W. (2006). Ryzyko medyczne u pacjentów z zaburzeniem dwubiegunowym i schizofrenią. J. Clin. Psychiatry 67, e16. doi: 10.4088/JCP.1106e16
PubMed Abstract | CrossRef Full Text | Google Scholar
Nielsen, M. Ø., Rostrup, E., Wulff, S., Glenthøj, B., Ebdrup, B. H. (2016). Striatal reward activity and antipsychotic-associated weight change in patients with schizophrenia undergoing initial treatment. JAMA Psychiatry 73, 121-128. doi: 10.1001/jamapsychiatry.2015.2582
PubMed Abstract | CrossRef Full Text | Google Scholar
Pawłowski, M., Abshir-Ahmed, Y., Beitinger, P., Steiger, A. (2018). S241. Investigation of Mechanism of Increased Appetite After Olanzapine by sLORETA During Sleep. Biol. Psychiatry 83, S441-S442.
Google Scholar
Perez-Cruzado, D., Cuesta-Vargas, A., Vera-Garcia, E., Mayoral-Cleries, F. (2018). Leki i aktywność fizyczna oraz sprawność fizyczna w ciężkich chorobach psychicznych. Psychiatry Res. 267, 19-24. doi: 10.1016/j.psychres.2018.05.055
PubMed Abstract | CrossRef Full Text | Google Scholar
Poyurovsky, M., Fuchs, C., Pashinian, A., Levi, A., Faragian, S., Maayan, R., et al. (2007). Attenuating effect of reboxetine on appetite and weight gain in olanzapine-treated schizophrenia patients: a double-blind placebo-controlled study. Psychopharmacology 192, 441-448. doi: 10.1007/s00213-007-0731-1
PubMed Abstrakt | CrossRef Full Text | Google Scholar
Roerig, J. L., Mitchell, J. E., de Zwaan, M., Crosby, R. D., Gosnell, B. A., Steffen, K. J., et al. (2005). A comparison of the effects of olanzapine and risperidone versus placebo on eating behaviors. J. Clin. Psychopharmacol. 25, 413-418. doi: 10.1097/01.jcp.0000177549.36585.29
PubMed Abstract | CrossRef Full Text | Google Scholar
Sentissi, O., Epelbaum, J., Olie, J. P., Poirier, M. F. (2008). Leptin and ghrelin levels in patients with schizophrenia during different antipsychotics treatment: a review. Schizophr. Bull. 34, 1189-1199. doi: 10.1093/schbul/sbm141
PubMed Abstract | CrossRef Full Text | Google Scholar
Stip, E., Lungu, O. V., Anselmo, K., Letourneau, G., Mendrek, A., Stip, B., et al. (2012). Zmiany neuronalne związane z przetwarzaniem informacji o apetycie u chorych na schizofrenię po 16 tygodniach leczenia olanzapiną. Transl. Psychiatry 2, e128. doi: 10.1038/tp.2012.53
PubMed Abstract | CrossRef Full Text | Google Scholar
Sweeney, P., Li, C., Yang, Y. (2017). Appetite suppressive role of medial septal glutamatergic neurons. Proc. Natl. Acad. Sci. 114, 13816-13821. doi: 10.1073/pnas.1707228114
CrossRef Full Text | Google Scholar
Tan, L., Liu, J., Liu, X., Chen, J., Yan, Z., Yang, H., et al. (2009). Clinical research of Olanzapine for prevention of chemotherapy-induced nausea and vomiting. J. Exp. Clin. Cancer Res. 28, 131. doi: 10.1186/1756-9966-28-131
PubMed Abstract | CrossRef Full Text | Google Scholar
Wu, R.-R., Zhao, J.-P., Jin, H., Shao, P., Fang, M.-S., Guo, X.-F., et al. (2008). Lifestyle intervention and metformin for treatment of antipsychotic-induced weight gain: a randomized controlled trial. Jama 299, 185-193. doi: 10.1001/jama.2007.56-b
PubMed Abstract | CrossRef Full Text | Google Scholar
Wu, R., Zhang, F., Gao, K., Ou, J., Shao, P., Jin, H., et al. (2016). Metformin treatment of antipsychotic-induced dyslipidemia: an analysis of two randomized, placebo-controlled trials. Mol. Psychiatry 21, 1537. doi: 10.1038/mp.2015.221
PubMed Abstract | CrossRef Full Text | Google Scholar
.




