Inhibicja enzymów
Enzymy są wymagane dla większości, jeśli nie wszystkich, procesów niezbędnych do życia. Enzymy katalizują reakcję poprzez zmniejszenie energii aktywacji potrzebnej do zajścia reakcji. Jednakże, enzymy muszą być ściśle regulowane, aby zapewnić, że poziom produktu nie wzrośnie do niepożądanego poziomu. Osiąga się to poprzez hamowanie enzymów.
Typy inhibicji
Odwracalne i nieodwracalne inhibitory są substancjami chemicznymi, które wiążą się z enzymem w celu zahamowania jego aktywności. Jedną z metod osiągnięcia tego celu jest prawie trwałe związanie się z enzymem. Te rodzaje inhibitorów nazywane są nieodwracalnymi. Jednakże inne substancje chemiczne mogą wiązać się z enzymem przejściowo. Są one nazywane odwracalnymi. Inhibitory odwracalne albo wiążą się z miejscem aktywnym (inhibitory kompetycyjne), albo z innym miejscem na enzymie (inhibitory niekompetycyjne).
 Rys. 1 – Schemat przedstawiający działanie kompetycyjnych i niekompetycyjnych inhibitorów enzymu.
Rys. 1 – Schemat przedstawiający działanie kompetycyjnych i niekompetycyjnych inhibitorów enzymu.Inhibitory kompetycyjne
Inhibitory kompetycyjne konkurują z substratem w miejscu aktywnym i dlatego zwiększają Km (stałą Michaelisa-Mentena). Jednakże Vmax pozostaje niezmieniona, ponieważ przy wystarczającym stężeniu substratu reakcja nadal może się zakończyć. Wykres aktywności enzymu względem stężenia substratu byłby przesunięty w prawo z powodu zwiększenia Km, podczas gdy wykres Lineweavera-Burke’a byłby bardziej stromy w porównaniu z wykresem bez inhibitora.
Inhibitory niekonkurencyjne
Inhibitory niekonkurencyjne wiążą się z innym miejscem na enzymie i jako takie zmniejszają VMAX. Jednakże KM pozostaje niezmieniona. Świadczy o tym niższe maksimum na wykresie aktywności enzymu względem stężenia substratu oraz wyższy punkt y na wykresie Lineweavera-Burke’a w porównaniu z brakiem inhibitora.
| Kompetytywne | Niekompetytywne | |
| Gdzie działają? | Aktywne miejsce | Alternatywne miejsce |
| Zmiana Km | Zwiększenie | Bez zmian |
| Zmiana Vmax | Niezmieniony | Zmniejszenie |
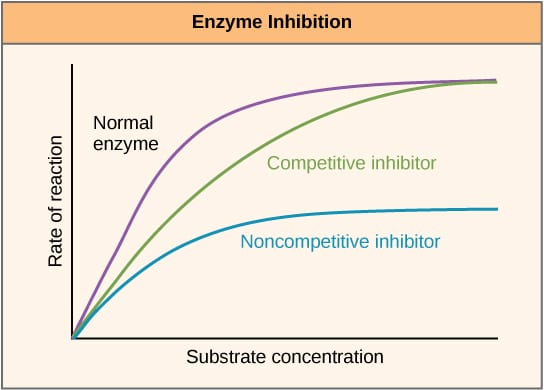 Rys. 2 -. Schemat przedstawiający wpływ inhibitorów enzymów na szybkość reakcji i jej zmianę w zależności od stężenia substratu.
Rys. 2 -. Schemat przedstawiający wpływ inhibitorów enzymów na szybkość reakcji i jej zmianę w zależności od stężenia substratu.Inhibicja allosteryczna
Allosteryczne enzymy wyświetlają krzywą sigmoidalną w przeciwieństwie do krzywej hiperbolicznej wyświetlanej przez enzymy Michaelisa-Mentena. Dzieje się tak dlatego, że większość enzymów allosterycznych zawiera wiele podjednostek, które mogą wpływać na siebie nawzajem, gdy substrat wiąże się z enzymem. Inhibicja może wpływać na K0,5, czyli stężenie substratu dla połowicznego nasycenia, Vmax lub na oba te parametry. Powoduje to przesunięcie krzywej w prawo, a w przypadku zmniejszenia Vmax, przesuwa krzywą w dół.
Allosteryczne enzymy mają dwa stany: stan o niskim powinowactwie dubbingowany stan „T” i stan o wysokim powinowactwie „R”. Inhibitory działają poprzez preferencyjne wiązanie się ze stanem T enzymu allosterycznego, powodując, że enzym utrzymuje ten stan niskiego powinowactwa.
Jest to niezwykle przydatne do ograniczania ilości produktu enzymu, ponieważ produkt może następnie przejść do hamowania tego samego typu enzymu, aby zapewnić, że ilość produktu nie jest nadmierna. Jest to znane jako hamowanie zwrotne. Na przykład, ATP allosterycznie hamuje kinazę pirogronianową, aby zapobiec zwiększonemu tworzeniu pirogronianu, więc ostatecznie powstaje mniej ATP. Ponadto, fosfofruktokinaza jest allosterycznie hamowana przez cytrynian, substancję pośrednią cyklu Kreb’a. Oznacza to, że glikoliza będzie przebiegać w sposób niekontrolowany. Oznacza to, że glikoliza będzie ograniczona, gdy wytwarzanie ATP z cyklu Kreb’a jest wysokie.
 Rys. 3 – Schemat przedstawiający mechanizm zarówno allosterycznej inhibicji, jak i aktywacji.
Rys. 3 – Schemat przedstawiający mechanizm zarówno allosterycznej inhibicji, jak i aktywacji.Fosforylacja
Fosforylacja zapewnia inny mechanizm, za pomocą którego enzymy mogą być hamowane. Zazwyczaj dzieje się to poprzez działanie enzymów kinazowych, które mogą albo hamować, albo aktywować enzym w zależności od sytuacji. Enzymy kinazowe odrywają grupę fosforanową od ATP i wiążą ją z enzymem. W sytuacjach, w których powoduje to wzrost aktywności enzymu, tworzy to reakcję kaskadową, pozwalając na wygenerowanie dużej odpowiedzi z małego bodźca.
Zymogeny
Enzymy mogą być również wydzielane w stanie nieaktywnym, które są nazywane zymogenami. Zymogeny są użytecznym mechanizmem, który pozwala na bezpieczny transport enzymów do różnych miejsc, bez uaktywniania się enzymu i wykonywania jego funkcji po drodze. Pozostają one nieaktywne ze względu na dodatek aminokwasów w białku. Dlatego, aby aktywować zymogen, inny enzym musi odł±czyć te dodatkowe aminokwasy. Na przykład, chymotrypsynogen jest syntetyzowany przez trzustkę, ale jest nieaktywny i nie może funkcjonować. Po przejściu do jelit, inny enzym (trypsyna) rozszczepia dodatkowe aminokwasy, aby wytworzyć aktywowaną formę, chymotrypsynę.
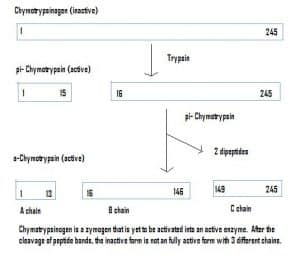 Rys. 4 – Schemat przedstawiający aktywację chymotrypsynogenu w układzie pokarmowym i enzymy zaangażowane na każdym etapie.
Rys. 4 – Schemat przedstawiający aktywację chymotrypsynogenu w układzie pokarmowym i enzymy zaangażowane na każdym etapie.Clinical Relevance – Pharmacokinetics
Najważniejszym klinicznym zastosowaniem inhibicji enzymów jest stosowanie leków farmaceutycznych. Inhibitory ACE są powszechnie stosowane w leczeniu nadciśnienia tętniczego. Angiotensyna I jest przekształcana w angiotensynę II w wyniku działania enzymu konwertującego angiotensynę (ACE). Angiotensyna II wywołuje jednak liczne efekty, które wiążą się ze wzrostem ciśnienia krwi. Dlatego inhibitory ACE zostały zaprojektowane w celu konkurencyjnego hamowania działania ACE, co skutkuje mniejszym powstawaniem angiotensyny II i niższym ciśnieniem krwi.
Alternatywnie, penicylina nieodwracalnie wiąże się z miejscem aktywnym enzymu zwanego DD-transpeptydazą. DD-transpeptydaza jest odpowiedzialna za ostatni etap syntezy ściany komórkowej bakterii. Poprzez hamowanie tego enzymu, bakterie nie mogą syntetyzować ściany komórkowej i dlatego nie mogą podtrzymywać życia.
Wreszcie, cyjanek jest przykładem inhibitora niekompetycyjnego. Cyjanek wiąże się z końcowym enzymem w łańcuchu transportu elektronów, i zapobiega temu enzymowi od katalizowania reakcji z tlenu do wody. To zapobiega przepływowi elektronów w dół łańcucha transportu elektronów i nie może być generowany ATP, co powoduje śmierć.
.




