Jaka jest różnica między wiązaniami jonowymi i kowalencyjnymi
Każdy kawałek materii wokół ciebie jest trzymany razem przez wiązania chemiczne. Czasami wiązania chemiczne są zrywane, na przykład podczas reakcji chemicznej, tylko po to, aby atomy ponownie się połączyły, tworząc inne cząsteczki. Energia jest zawsze uwalniana w celu wytworzenia wiązań i podobnie, energia jest zawsze wymagana do zerwania wiązań.
Są dwa główne typy wiązań chemicznych: jonowe i kowalencyjne.
Co to są wiązania jonowe i kowalencyjne?
Atomy łączą się w związki, ponieważ w ten sposób osiągają niższe energie niż te, które posiadają jako pojedyncze atomy, stając się bardziej stabilne w tym procesie. Zgodnie z prawem zachowania energii, kiedy tworzy się nowe wiązanie chemiczne, reakcja chemiczna uwalnia ilość energii (zwykle w postaci ciepła) prawie równą różnicy w ilości zmagazynowanej energii chemicznej pomiędzy produktami i reagentami. Ta zmagazynowana energia chemiczna układu, lub zawartość ciepła, jest znana jako jego entalpia.
Wiązanie jonowe tworzy się, gdy dwa jony o przeciwnych ładunkach wymieniają między sobą elektrony, gdzie jon jest atomem, który stracił lub zyskał elektron. Jony, które tracą jeden lub więcej elektronów mają więcej protonów niż elektronów, co oznacza, że mają ładunek dodatni. Takie jony nazywane są kationami (metalami). Z drugiej strony, uzyskanie elektronów nadaje jonom ładunek ujemny. Chemicy odnoszą się do takich jonów jako anionów (niemetali).
Związki jonowe są zazwyczaj neutralne. Dlatego jony łączą się w sposób, który neutralizuje ich ładunki.
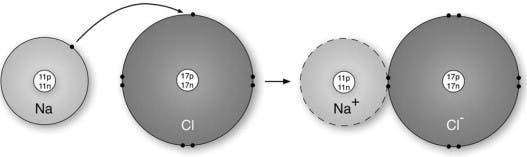
Podręcznikowym przykładem związku jonowego jest chlorek sodu, znany również jako sól kuchenna. Pojedynczy atom sodu ma 11 protonów i 11 elektronów, ale tylko jeden elektron w swojej zewnętrznej powłoce (lub powłoce walencyjnej). Chlor składa się z 17 protonów i 17 elektronów, a w jego zewnętrznej powłoce znajduje się 7 elektronów. Kiedy te dwa atomy reagują, sód (elektroujemny) traci swój elektron walencyjny na rzecz chloru (elektronoegatywnego). Teraz, w powstałej strukturze kryształu, każdy jon sodu jest otoczony przez sześć jonów chlorkowych, a każdy jon chlorkowy jest otoczony przez sześć jonów sodu. Co więcej, każdy jon ma kompletną powłokę elektronową, która odpowiada najbliższemu gazowi obojętnemu; neonowi dla jonu sodowego, argonowi dla jonu chlorkowego
Wiązania kowalencyjne tworzą się, gdy atomy lub jony dzielą się elektronami w taki sposób, że ich zewnętrzne powłoki stają się zajęte. Wiązania kowalencyjne, zwane również wiązaniami molekularnymi, tworzą się tylko między atomami niemetali o identycznej lub stosunkowo bliskiej wartości elektronegatywności. Elektronegatywność, oznaczana symbolem χ, jest właściwością chemiczną, która opisuje tendencję atomu do przyciągania wspólnej pary elektronów (lub gęstości elektronowej) do siebie.
Liczba wiązań kowalencyjnych, które atom może utworzyć, nazywana jest walencyjnością atomu. Właściwość ta reprezentuje elektrony atomu, które mogą uczestniczyć w tworzeniu wiązań chemicznych z innymi atomami. Są one najdalej elektrony od jądra.
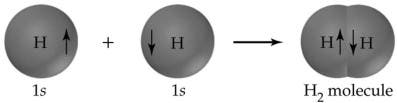
Pierwszym przykładem wiązania kowalencyjnego jest cząsteczka wodoru, który tworzy się z dwóch atomów wodoru, każdy z jednym elektronem w ich zewnętrznej powłoki. Tworzenie wiązania uwalnia ciepło, dlatego jest egzotermiczne. W przypadku cząsteczki wodoru, ciepło wydzielone podczas jej tworzenia, znane również jako standardowa zmiana entalpii (ΔH°), wynosi -435 kJ na mol. Proces odwrotny, rozerwanie wiązania H-H, wymaga 435 kJ na mol, co jest wielkością zwaną siłą wiązania.
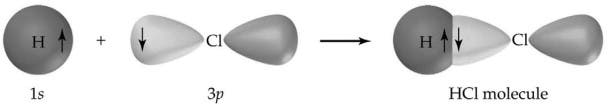
Innym klasycznym przykładem wiązania kowalencyjnego jest chlorek wodoru (HCl), który jest halogenkiem wodoru. Atom chloru ma 7 atomów w swojej zewnętrznej powłoce, podczas gdy wodór ma 1 elektron w swojej zewnętrznej powłoce. Oba łączą się idealnie, więc każdy atom wypełnia swoją powłokę walencyjną, tworząc bardzo stabilną cząsteczkę. Teraz, cząsteczka HCl nie będzie dalej reagować z innymi atomami chloru lub wodoru.
Różnice między wiązaniami jonowymi i kowalencyjnymi
- Wiązania kowalencyjne są znacznie bardziej powszechne w chemii organicznej niż wiązania jonowe.
- W wiązaniach kowalencyjnych atomy dzielą się elektronami, podczas gdy w wiązaniach jonowych atomy przekazują elektrony.
- Składniki reakcji w wiązaniach kowalencyjnych są elektrycznie obojętne, podczas gdy w wiązaniach jonowych oba są naładowane. To wyjaśnia, dlaczego chlorek sodu (sól) przewodzi prąd po rozpuszczeniu – jego składniki są naładowane.
- Wiązania jonowe są znacznie silniejsze niż wiązania kowalencyjne.
- Wiązania kowalencyjne są znacznie bardziej powszechne w przyrodzie niż wiązania jonowe. Większość cząsteczek w żywych istotach są kowalencyjnie związane, na przykład.
- Wiązania kowalencyjne mogą tworzyć się między atomami tych samych elementów (np. H2). Jednak wiązania jonowe nie mogą tego zrobić.
- Wiązania kowalencyjne tworzą się między dwoma niemetalami, podczas gdy wiązania jonowe tworzą się między metalem a niemetalem.
- Cząsteczki utworzone przez wiązania kowalencyjne mają niską temperaturę topnienia, podczas gdy te z wiązaniami jonowymi mają wysoką temperaturę topnienia. Ta sama zależność istnieje dla temperatury wrzenia.
- W temperaturze pokojowej cząsteczki z wiązaniami kowalencyjnymi są w zdecydowanej większości przypadków cieczami lub gazami, podczas gdy związki jonowe są ciałami stałymi.
Podobieństwa między wiązaniami jonowymi i kowalencyjnymi
- Oba rodzaje wiązań prowadzą do powstania trwałych związków chemicznych.
- Do utworzenia wiązań jonowych i kowalencyjnych potrzebne są reakcje egzotermiczne (tzn. takie, które uwalniają ciepło).
- Elektrony walencyjne biorą udział w obu procesach wiązania.
- Nie ma znaczenia, czy cząsteczka powstaje w wyniku wiązania jonowego czy kowalencyjnego, jeśli chodzi o jej ładunek elektryczny: wynik jest zawsze elektrycznie obojętny.
.




