Poliester
Syntezę poliestrów uzyskuje się na ogół w wyniku reakcji polikondensacji. Patrz „reakcje kondensacji w chemii polimerów”.Ogólne równanie reakcji diolu z kwasem diazowym jest następujące :
(n+1) R(OH)2 + n R´(COOH)2 → HOnROH + 2n H2O. W tej klasycznej metodzie, alkohol i kwas karboksylowy reagują w celu utworzenia estru karboksylowego.Aby utworzyć polimer, woda powstała w wyniku reakcji musi być stale usuwana poprzez destylację azeotropową. Gdy temperatury topnienia monomerów są wystarczająco niskie, poliester może być utworzony poprzez bezpośrednią estryfikację przy jednoczesnym usuwaniu wody powstałej w wyniku reakcji poprzez próżnię. Bezpośrednia estryfikacja w wysokich temperaturach (150 – 290 °C) jest dobrze dostosowana i stosowana na skalę przemysłową do produkcji poliestrów alifatycznych, nienasyconych poliestrów i poliestrów aromatyczno-alifatycznych. Monomery zawierające fenolowe lub trzeciorzędowe grupy hydroksylowe wykazują niską reaktywność z kwasami karboksylowymi i nie mogą być polimeryzowane w procesie bezpośredniej poliestryfikacji opartej na kwaśnych alkoholach. Jednak w przypadku produkcji PET proces bezpośredni ma kilka zalet, w szczególności większą szybkość reakcji, większy osiągalny ciężar cząsteczkowy, uwalnianie wody zamiast metanolu i niższe koszty przechowywania kwasu w porównaniu z estrem ze względu na mniejszy ciężar. Transestryfikacja: Oligomer zakończony alkoholem i oligomer zakończony estrem ulegają kondensacji, tworząc wiązanie estrowe, z utratą alkoholu. R i R’ są dwoma łańcuchami oligomeru, R” jest jednostką ofiarną, taką jak grupa metylowa (metanol jest produktem ubocznym reakcji estryfikacji). Termin transestryfikacja jest zwykle stosowany do opisu reakcji wymiany hydroksy-ester, karboksy-ester i ester-ester. Reakcja wymiany hydroksy-estrów charakteryzuje się największą szybkością reakcji i jest stosowana do produkcji wielu aromatyczno-alifatycznych i całkowicie aromatycznych poliestrów. Synteza oparta na transestryfikacji jest szczególnie przydatna w przypadku stosowania wysokotopliwych i słabo rozpuszczalnych kwasów dikarboksylowych. Ponadto, alkohole jako produkty kondensacji są bardziej lotne i tym samym łatwiejsze do usunięcia niż woda. Wysokotemperaturowa synteza topnienia między dwuoctanami bisfenolu i aromatycznymi kwasami dikarboksylowymi lub odwrotnie między bisfenolami i estrami difenylowymi aromatycznych kwasów dikarboksylowych (prowadzona w temperaturze 220 do 320 °C po uwolnieniu kwasu octowego) jest, oprócz syntezy opartej na chlorku acylu, preferowaną drogą do całkowicie aromatycznych poliestrów. W acylowaniu, kwas zaczyna się jako chlorek kwasu, a zatem polikondensacja przebiega z wydzielaniem kwasu solnego (HCl) zamiast wody. Reakcja między chlorkami diacylowymi a alkoholami lub związkami fenolowymi znalazła szerokie zastosowanie w syntezie poliestrów i była przedmiotem licznych przeglądów i rozdziałów książkowych. Reakcję prowadzi się w niższych temperaturach niż metodami równowagowymi; możliwe typy to wysokotemperaturowa kondensacja w roztworze, reakcje katalizowane aminami i reakcje międzyfazowe. Ponadto, zastosowanie czynników aktywujących jest zaliczane do metod nieekwilibracyjnych. Stałe równowagi dla kondensacji na bazie chlorku acylu, w wyniku której otrzymuje się arylany i poliarylany, są rzeczywiście bardzo wysokie i wynoszą odpowiednio 4,3 × 103 i 4,7 × 103. Reakcja ta jest zatem często określana jako poliestryfikacja „nierównowagowa”. Mimo że synteza oparta na chlorku acylu jest również przedmiotem doniesień w literaturze patentowej, jest mało prawdopodobne, aby reakcja ta była wykorzystywana na skalę produkcyjną. Metoda ta jest ograniczona przez wysoki koszt dichlorków kwasu, wrażliwość na hydrolizę i występowanie reakcji ubocznych. Wysokotemperaturowa reakcja (100 do > 300 °C) chlorku diacylu z dialkoholem daje poliester i chlorowodór. W tych stosunkowo wysokich temperaturach reakcja przebiega szybko bez katalizatora: Przemiana reakcji może być śledzona przez miareczkowanie wydzielającego się chlorowodoru. Opisano szeroką gamę rozpuszczalników, w tym chlorowane benzeny (np. dichlorobenzen), chlorowane naftaleny lub difenyle, jak również niechlorowane aromaty, takie jak terfenyle, benzofenony lub dibenzylobenzeny. Reakcję tę zastosowano również z powodzeniem do otrzymywania wysokokrystalicznych i słabo rozpuszczalnych polimerów, które wymagają wysokiej temperatury do utrzymania w roztworze (przynajmniej do czasu osiągnięcia wystarczająco dużej masy cząsteczkowej). W reakcji międzyfazowej opartej na chlorku acylowym, alkohol (zazwyczaj w rzeczywistości fenol) rozpuszcza się w postaci alkoksydu w wodnym roztworze wodorotlenku sodu, chlorek acylowy w rozpuszczalniku organicznym niemieszającym się z wodą, takim jak dichlorometan, chlorobenzen lub heksan, reakcja zachodzi na granicy faz pod szybkim mieszaniem w temperaturze pokojowej. Procedura ta jest stosowana do produkcji poliarylanów (poliestrów na bazie bisfenoli), poliamidów, poliwęglanów, poli(tiowęglanów) i innych. Ponieważ ciężar cząsteczkowy produktu otrzymanego w wyniku syntezy wysokotemperaturowej może być poważnie ograniczony przez reakcje uboczne, problem ten jest omijany dzięki łagodnym temperaturom polikondensacji międzyfazowej. Procedura ta jest stosowana do komercyjnej produkcji poliarylatów na bazie bisfenolu A, takich jak U-Polimer firmy Unitika. W niektórych przypadkach woda może być zastąpiona niemieszającym się rozpuszczalnikiem organicznym (np. w układzie adiponitryl/tetrachlorek węgla). Procedura ta jest mało przydatna w produkcji poliestrów na bazie dioli alifatycznych, które mają wyższe wartości pKa niż fenole i dlatego nie tworzą jonów alkoholanowych w roztworach wodnych. Katalizowana zasadą reakcja chlorku acylu z alkoholem może być również prowadzona w jednej fazie przy użyciu amin trzeciorzędowych (np. trietyloaminy, Et3N) lub pirydyny jako akceptorów kwasu: Podstawione poliestryfikacje na bazie chlorku acylu przebiegają bardzo powoli w temperaturze pokojowej bez katalizatora, ale amina przyspiesza reakcję na kilka możliwych sposobów, chociaż mechanizm nie jest w pełni poznany. Wiadomo jednak, że aminy trzeciorzędowe mogą powodować reakcje uboczne, takie jak tworzenie się ketenów i dimerów ketenowych. Metoda sililowa W tym wariancie metody HCl, chlorek kwasu karboksylowego przekształca się z eterem trimetylosililowym składnika alkoholowego i otrzymuje się chlorek trimetylosililowy Metoda octanu sililu Poliestry alifatyczne można tworzyć z laktonów w bardzo łagodnych warunkach, Katalizowana anionowo, kationowo, metaloorganicznie lub enzymatycznie Szereg katalitycznych metod kopolimeryzacji epoksydów z cyklicznymi bezwodnikami również zostało ostatnio przedstawionych w celu uzyskania szerokiej gamy funkcjonalizowanych poliestrów, zarówno nasyconych jak i nienasyconych. Polimeryzacja z otwarciem pierścienia laktonów i laktydów jest również stosowana na skalę przemysłową. Do syntezy wybranych poliestrów zgłoszono wiele innych reakcji, ale są one ograniczone do syntez na skalę laboratoryjną z zastosowaniem określonych warunków, na przykład z zastosowaniem soli kwasu dikarboksylowego i halogenków dialkilowych lub reakcji między bisketenami i diolami. Zamiast chlorków acylowych można stosować tak zwane czynniki aktywujące, takie jak 1,1′-karbonyldiimidazol, dicykloheksylokarbodiimid lub bezwodnik trioksyuorooctowy. Polikondensacja przebiega poprzez konwersję in situ kwasu karboksylowego do bardziej reaktywnego półproduktu, podczas gdy czynniki aktywujące są zużywane. Reakcja przebiega, na przykład, poprzez pośredni N-acylimidazol, który reaguje z katalitycznie działającym alkoksydem sodu: Zastosowanie czynników aktywujących do produkcji wysokotopliwych aromatycznych poliestrów i poliamidów w łagodnych warunkach jest przedmiotem intensywnych badań akademickich od lat osiemdziesiątych, ale reakcje te nie zyskały akceptacji handlowej, ponieważ podobne wyniki można uzyskać przy użyciu tańszych reagentów. Poliestryfikacje są grupowane przez niektórych autorów w dwie główne kategorie: a) poliestryfikacje równowagowe (głównie reakcje alkohol-kwas, reakcje wymiany alkohol-ester i kwas-ester, prowadzone masowo w wysokich temperaturach) oraz b) poliestryfikacje nierównowagowe, wykorzystujące silnie reaktywne monomery (na przykład chlorki kwasów lub aktywowane kwasy karboksylowe, prowadzone najczęściej w niższych temperaturach w roztworze). Poliestrowanie na bazie kwasu i alkoholu jest jednym z przykładów reakcji równowagowej. Stosunek między tworzącą polimer grupą estrową (-C(O)O-) i produktem kondensacji wodą (H2O) w stosunku do monomerów na bazie kwasu (-C(O)OH) i alkoholu (-OH) opisuje stała równowagi KC. K C = {{displaystyle K_{C}={}{}}} Stała równowagi poliestryfikacji opartej na kwasie i alkoholu wynosi zwykle KC ≤ 10, co nie jest wystarczająco wysokie, aby uzyskać polimery o dużym ciężarze cząsteczkowym (DPn ≥ 100), ponieważ średni liczbowy stopień polimeryzacji (DPn) można obliczyć ze stałej równowagi KC. D P n = K C 2 + 1 {{displaystyle DP_{n}~=~{sqrt{K_{C}}}+1} W reakcjach równowagowych konieczne jest zatem ciągłe i wydajne usuwanie produktu kondensacji z ośrodka reakcyjnego, aby doprowadzić do równowagi w kierunku polimeru. Produkt kondensacji usuwa się zatem pod zmniejszonym ciśnieniem i w wysokiej temperaturze (150-320 °C, w zależności od monomerów), aby zapobiec reakcji zwrotnej. Wraz z postępem reakcji zmniejsza się stężenie aktywnych końców łańcucha i zwiększa się lepkość stopu lub roztworu. W celu zwiększenia szybkości reakcji, reakcję prowadzi się przy wysokim stężeniu grup końcowych (najlepiej w masie), czemu sprzyja podwyższona temperatura. Stałe równowagi o wielkości KC ≥ 104 uzyskuje się stosując reaktywne reagenty (chlorki kwasów lub bezwodniki kwasów) lub czynniki aktywujące, takie jak 1,1′-karbonyldiimidazol. Używając tych reagentów, masy cząsteczkowe wymagane do zastosowań technicznych mogą być osiągnięte nawet bez aktywnego usuwania produktu kondensacji.
Estryfikacja azeotropowaEdit
Estryfikacja topliwaEdit
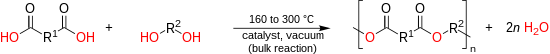
Transestryfikacja alkoholowaEdit

AcylowanieEdit


![]()
Metoda octanowa (estryfikacja)EDIT

Polimeryzacja z otwarciem pierścieniaEdit

Inne metodyEdit

Termodynamika reakcji polikondensacjiEdit






