CHEM 245 – Inibição enzimática
TÓPICOS BIOCEMISTRIA
Inibição enzimática
Tipos de inibidores e inibição. inibidores reversíveis e irreversíveis e inibição. Modelos para e efeitos cinéticos da inibição competitiva e não competitiva. Inibição mista. Exemplos de inibição enzimática.
A especificidade das enzimas não está estritamente limitada aos substratos. Muitas vezes, a atividade de uma enzima é reduzida por interações específicas com moléculas denominadas inibidoras. A inibição enzimática é um dos fenómenos mais importantes da bioquímica. Por exemplo, muitos medicamentos, antibióticos e toxinas exercem os seus efeitos pela sua capacidade de inibir uma enzima. Os inibidores que são estruturalmente semelhantes ao substrato são frequentemente inibidores competitivos, uma vez que competem pela ligação no local ativo. A inibição enzimática pode ser reversível (como geralmente acontece quando um inibidor se liga à enzima via interações não-verbais) ou irreversível (como ocorre em inúmeros casos onde os inibidores atuam via modificações covalentes na enzima, talvez visando um resíduo crítico para a catálise).
Podemos imaginar vários modelos simples de inibição reversível. O mais simples deles é a oclusão direta do local ativo pelo inibidor. Isto seria visto no caso de uma molécula com alguma semelhança estrutural com o substrato. A ligação do substrato e do inibidor são mutuamente exclusivos neste modelo para inibição competitiva.
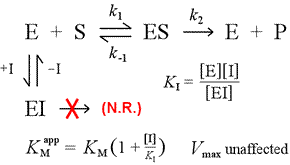
à direita é mostrado um modelo mecanicista simples para inibição competitiva. O inibidor, I, liga-se apenas à enzima livre E, com uma constante de dissociação KI , e bloqueia a ligação do substrato (S). Ao amarrar parte da enzima no complexo inativo EI, menos dela está disponível em uma determinada concentração de substrato para combinar com substrato e formar ES e então potencialmente converter em produtos. Será observado um aumento necessário para atingir ½Vmax, daí que o valor aparente do KM aumente.
Ao aumentar para níveis cada vez maiores, o substrato pode sobrecarregar o inibidor, ultrapassando-o para a enzima livre, na medida em que o verdadeiro Vmax ainda pode ser abordado.
Podemos facilmente imaginar que uma molécula que se assemelha ao substrato em certas características estruturais chave poderia competir com o substrato para ligar o no local ativo. Isto é chamado de substrato análogo, e eles fornecem exemplos comuns de inibidores competitivos de enzimas. Se a forma como as enzimas aumentam as taxas de reacção é através da estabilização selectiva do estado de transição da reacção, então se pudermos encontrar uma molécula que se assemelha ao estado de transição (em estrutura e polaridade ou carga), tal estado de transição análogo deve ser um inibidor competitivo muito bom.
Contrastaremos o modelo de inibição competitiva com inibição não competitiva, em que o inibidor se liga apenas ao complexo enzimático-substrato. Pode-se imaginar isto ocorrendo como resultado de uma interação enzima-substrato do tipo induzido, no qual um local de ligação para um inibidor está disponível exclusivamente na conformação induzida do ES.
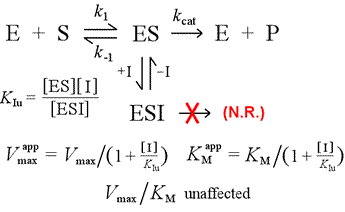
Esquerda: Um modelo mecanicista para inibição não competitiva. Neste modelo, o inibidor liga apenas o complexo ES, e não a enzima livre. O complexo ternário, ESI, não procede aos produtos. Isto tem o efeito de baixar o Vmax aparente. A constante de dissociação inibidora do ESI é designada por KIu. Em um efeito explicado pelo Princípio de Le Châtelier, o KM aparente é menor, pois a ligação inibidora remove parte do produto (ES) do “equilíbrio” da formação do ES.
Um modelo de inibição no qual o inibidor liga tanto a enzima livre quanto o complexo enzimático-substrato é inibição mista. A constante de dissociação do inibidor pode diferir entre E e ES (i.e. KI ≠ KIu). O caso especial em que KI = KIu é o nome de inibição não-competitiva. Note que, neste caso, KM não é afetado, enquanto Vmax é diminuído.
Tipos de inibição reversível da enzima – um resumo
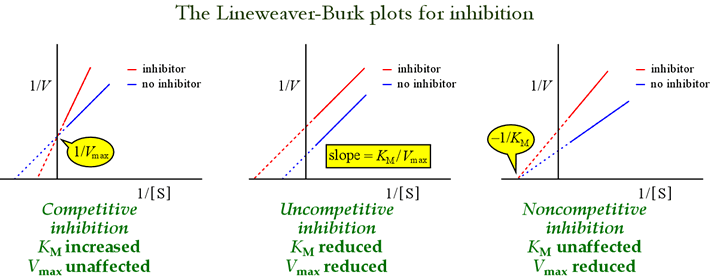
Vimos que os diferentes modelos de inibição reversível podem ser distinguidos de acordo com os efeitos sobre os parâmetros cinéticos. A tabela abaixo resume os tipos de inibição e seus efeitos sobre esses parâmetros.

Os gráficos de Lineweaver-Burk, ou Duplo-reciprocal são úteis para identificar os padrões de inibição. A figura abaixo mostra os diferentes tipos de inibição que afetam o gráfico.
Exemplos de inibição enzimática
O primeiro e mais usado fármaco, acetilsalicilato (salicilato = ortohidroxibenzoato), comumente conhecido como aspirina, é um analgésico eficaz (analgésico analgésico), antipirético (redutor de febre), e anti-inflamatório. As propriedades medicinais da casca do salgueiro eram conhecidas em algumas culturas há séculos. No século XIX, o ingrediente ativo foi encontrado como uma combinação de álcool salicílico e álcool salicílico. Com base nestas e outras observações, bem como nos avanços da síntese química, a aspirina tornou-se disponível em meados do século XIX, tendo sido preparada por Hoffman, um químico empregado pela Bayer. Investigações mais modernas estabeleceram que as propriedades medicinais da aspirina derivam em grande parte de sua capacidade de inibir irreversivelmente uma enzima conhecida como ciclo-oxigenase, que é necessária para a síntese de prostaglandinas e tromboxanos.
As ciclo-oxigenases catalisam o primeiro passo na conversão do aracidonato em precursor das prostaglandinas e tromboxanos, a prostaglandina G2 (PGG2, estruturas e reação). A reação utiliza duas moléculas de O2 e converte o ácido graxo C20:4 em uma molécula peroxidada contendo um anel ciclopentano (PGG2 – PG significa “prostaglandina”). A enzima ciclo-oxigenase também possui uma atividade hidroperoxidase que converte o PGG2 em PGH2. Assim, a “ciclo-oxigenase” (COX) seria designada com mais precisão como endoperóxido de prostaglandina H sintetase (PGHS). A inibição da actividade da ciclo-oxigenase pela aspirina deve-se à sua capacidade de modificar quimicamente um resíduo sereno (Ser530) da enzima. O resíduo de serina adquire um grupo acetil da aspirina, uma modificação irreversível. Assim, a aspirina é um exemplo de um inibidor irreversível. Existem na verdade duas isozimas COX: uma forma constitutiva, COX-1 (PGHS-1), e uma forma induzida (sob condições de inflamação), COX-2 (PGHS-2). Os anti-inflamatórios não-esteróides (AINEs) como a aspirina, o ibuprofeno e o naproxeno geralmente inibem ambas as isoformas. Consequentemente, estes medicamentos produzem efeitos secundários indesejados, por exemplo, irritação gastrointestinal. Assim, um objectivo actual da investigação farmacológica é desenvolver inibidores específicos para o COX-2, um efeito que se pensa poder mediar a maioria dos efeitos analgésicos e anti-inflamatórios dos AINEs.
Páginas de tópicos relacionados:
- cinética química indutora
- enzimologia indutora
- cinética enzimática
- equação de Michaelis-Menten




