Cloreto de sódio, NaCl
O caso clássico da ligação iónica, a molécula de cloreto de sódio forma-se pela ionização dos átomos de sódio e cloro e pela atracção dos iões resultantes.
Um átomo de sódio tem um electrão de 3s fora de uma casca fechada, e são necessários apenas 5,14 volts de electrões de energia para remover esse electrão. O cloro não tem um electrão para encher uma casca, e liberta 3,62 eV quando adquire esse electrão (a afinidade dos electrões é 3,62 eV).Isto significa que é necessário apenas 1,52 eV de energia para doar um dos electrões de sódio ao cloro quando estes estão afastados. Quando os iões resultantes são aproximados, a sua energia potencial eléctrica torna-se cada vez mais negativa, atingindo -1,52 eV a cerca de 0,94 nm de separação. Isto significa que se os átomos de sódio e cloro neutros se encontrarem mais próximos de 0,94 nm, seria energeticamente favorável transferir um electrão de Na para Cl e formar a ligação iónica.
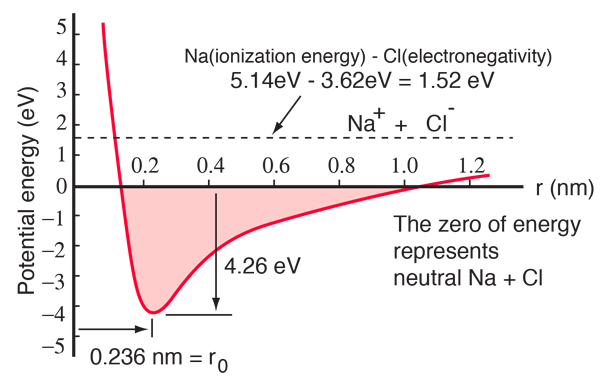
A curva de energia potencial mostra que existe um mínimo a 0,236 nm de separação e depois um aumento acentuado do potencial que representa uma força repulsiva. Esta força repulsiva é mais do que uma simples repulsão electrostática entre as nuvens de electrões dos dois átomos. Ela tem um caráter mecânico quântico enraizado no princípio de exclusão Pauli, e é freqüentemente chamada apenas de “repulsão do princípio de exclusão”. Quando os iões estão amplamente separados, as funções de onda dos seus electrões nucleares não se sobrepõem significativamente e podem ter números quânticos idênticos. À medida que se aproximam, a sobreposição crescente das funções das ondas faz com que alguns sejam forçados a entrar em estados energéticos mais elevados. Dois elétrons não podem ocupar o mesmo estado, de modo que um novo conjunto de estados de energia é formado para o sistema composto de dois núcleos, os estados de energia inferior são preenchidos e alguns dos elétrons são empurrados para estados superiores. Isto requer energia e é experimentado como uma repulsão, impedindo que os íons se aproximem um do outro.
O diagrama de potencial acima é para NaCl gasoso, e o ambiente é diferente no estado sólido normal onde o cloreto de sódio (sal comum de mesa) forma cristais cúbicos. A separação iónica é de 0,28 nm, um pouco maior que a do estado gasoso.
Uma parte importante do estudo da estrutura molecular é a descrição das ligações químicas que são formadas entre os átomos. Os estudos clássicos são os extremos de ligação iônica em cloreto de sódio e ligação covalente na molécula de hidrogênio.
>
| Ligações químicas | Repulsão pauli em ligações iônicas |
Exemplo de energia de ligação




