Frontiers in Oncology
Introduction
Glioblastoma e Astrocitoma Anaplásico (ANA) são dois dos tumores cerebrais primários mais comuns em adultos (1). Há um verdadeiro aumento nas taxas de incidência, especialmente em idosos (1-3). Na prática clínica, é difícil diferenciar os pacientes com glioblastoma daqueles com ANA antes da cirurgia ou biópsia, pois os sintomas e sinais dos dois tumores são relativamente uniformes e não específicos (4, 5). Entretanto, o tratamento para eles é diferente, como o protocolo de quimioterapia, dosagem e modo de administração (6). Por exemplo, para pacientes com ANA (OMS grau III), é recomendado receber radioterapia ou TMZ após ressecção ou biópsia; enquanto para pacientes recém-diagnosticados com glioblastoma (OMS grau IV), é radioterapia mais TMZ concomitante, seguida por TMZ adjuvante. De acordo com estudos anteriores, o glioblastoma e o ANA crescem por invasão em tecido cerebral normal, espalham-se através do líquido cefalorraquidiano (LCR), e estendem-se além de uma única distribuição carotídea ou artéria vertebral, assim ambos têm uma resposta ruim ao tratamento médico e tornam-se causas principais de morte relacionada ao câncer em adultos (7, 8). Além disso, o prognóstico do glioblastoma e do ANA é diferente. Na população idosa, não há diferença significativa no prognóstico entre glioblastoma e ANA, mas a diferença pode existir na população mais jovem (9). Portanto, é difícil, mas crucial, distinguir o glioblastoma do ANA.
Ressonância Magnética (RM) é a melhor neuroimagem no diagnóstico pré-operatório do glioblastoma e do ANA por sua capacidade multiplanar e contraste superior dos tecidos moles. Embora alguns estudos tenham demonstrado que a presença de realce e necrose em forma de anel sugere glioblastoma, na maioria dos casos, tanto o glioblastoma quanto o ANA aparecem como formas irregulares nas imagens de RM (hiperdenso na seqüência T2 e hipodenso na seqüência T1) com vários graus de realce e edema de contraste baseados em Gd, dos quais as diferenças geralmente eram imperceptíveis ao olho humano (10-12).
Recentemente, a análise de textura (TA), também conhecida como radiômica, tem sido amplamente aplicada em diferentes campos. Pesquisadores constataram que a AT foi um método viável e promissor para facilitar o diagnóstico diferencial, pois permitiu a aquisição de informações quantitativas adicionais de imagens de RM que eram invisíveis para a avaliação humana (13-15). A AT descreve a distribuição de freqüência e a organização espacial do valor de voxel para revelar as possíveis diferenças no tecido tumoral (16). Estudos anteriores exploraram a viabilidade da aplicação da AT no diagnóstico diferencial, classificação de subtipos de tumores e detecção da heterogeneidade do tecido tumoral (17-19). Para nosso reconhecimento, a aplicação da AT no diagnóstico diferencial entre glioblastoma e ANA ainda não foi relatada. O objetivo deste estudo foi avaliar a capacidade discriminatória da análise de textura da RM usando algoritmos de aprendizado de máquina para diferenciar glioblastoma e ANA.
Materiais e Métodos
Seleção Paciente
Visitamos retrospectivamente nossa base de dados da instituição e examinamos todos os pacientes histopatologicamente diagnosticados como glioblastoma ou ANA, no período de janeiro de 2015 a dezembro de 2018. Os critérios de elegibilidade para os pacientes qualificados foram: (1) diagnóstico histopatológico conclusivo do glioblastoma ou ANA; (2) elaboração de prontuários médicos eletrônicos, especialmente material patológico; (3) exame de RM de diagnóstico em nossa instituição antes da ressecção cirúrgica. Os critérios de exclusão foram: (1) história de doença intracraniana (por exemplo, trauma cerebral, infecção intracraniana ou outros tipos de tumor cerebral), considerando a interferência do tecido cicatricial na intensidade das imagens; (2) presença de artefato de movimento na RM; (3) história de tratamentos antes da RM (por exemplo, cirurgia, quimioterapia ou radioterapia); (4) pacientes que não alcançaram os critérios para o diagnóstico de glioblastoma ou ANA de acordo com o sistema de classificação da OMS de 2016. Um neuropatologista sénior com 10 anos de experiência avaliou se o paciente preenchia os critérios (o sistema de classificação da OMS de 2016) para glioblastoma ou ANA. O conselho de revisão institucional aprovou este estudo retrospectivo. O consentimento livre e esclarecido por escrito foi obtido dos participantes inscritos neste estudo. O Comitê de Ética da Universidade de Sichuan e o departamento de radiologia da nossa instituição aprovaram a utilização da estatística para este estudo.
MR Aquisição de Imagem
Para todos os pacientes incluídos neste estudo, foram disponibilizadas sequências ponderadas em T1 com contraste e obtidas no 3.0T Siemens Trio Scanner com os seguintes parâmetros: TR/TE/TI = 1900/2,26/900 ms, ângulo de viragem = 9°, 20 fatias axiais com espessura = 5 mm, FOV axial = 25,6 × 25,6 cm2 e matriz de dados = 256 × 256. A imagem com contraste T1 usado gadopentetate dimeglumine (0,1 mmol/Kg) foi o agente de contraste para imagem com contraste, e dados multidirecionais de RM com contraste foram coletados durante o tempo de intervalo contínuo de 90-250 s.
Exploração de textura
Em nosso estudo, o pacote LifeX (http://www.lifexsoft.org) foi usado para extrair características de textura. Imagens pós-contraste T1 (T1C) foram selecionadas para análise posterior devido à clara representação da localização e borda do tumor (20). A região de interesse (ROI) foi desenhada manualmente, fatiado a fatias, no plano axial ao longo das lesões em imagens contrastadas para obter características de textura. Dois neurocirurgiões experientes, cegos aos prontuários dos pacientes e ao diagnóstico histopatológico, desenharam o ROI seguido de edição por um radiologista e um neurocirurgião sénior. As discordâncias foram abordadas discutindo e consultando o radiologista sênior e o neurocirurgião sênior. Um total de 40 características de textura foram extraídas das imagens de RM, incluindo minValue, meanValue, maxValue, stdValue e parâmetros derivados de seis matrizes: Matriz baseada em histograma (HISTO), Forma, matriz de co-ocorrência de nível de cinza (GLCM), matriz de comprimento de faixa de cinza (GLRLM), matriz de comprimento de faixa de cinza (GLZLM), e matriz de dependência de nível de cinza da vizinhança (NGLDM).
Seleção de características
Existiram 40 características de textura no total derivadas de seis matrizes selecionadas. A explicação das 40 características de textura foram mostradas na Tabela Complementar 1. As estatísticas destas características de textura foram mostradas na Tabela Complementar 2. A selecção dos elementos foi feita para determinar os elementos relevantes e, assim, evitar o seu sobreajustamento. Além disso, o algoritmo de aprendizagem da máquina aplicado neste estudo não pôde levar todos os 40 elementos de textura para análise. Foram utilizados três métodos independentes de selecção de características para seleccionar características de textura óptimas, incluindo a correlação à distância, a menor retracção absoluta e o operador de selecção (LASSO) e a árvore de decisão de correlação de gradientes (GBDT). Três subconjuntos de características de textura foram assim formados e constituíram três conjuntos de dados diferentes.
Classificação
Análise linear discriminante (LDA) é um método de classificação robusto para separar duas classes através da busca da combinação linear de preditores que maximiza a separação entre os grupos. Neste estudo, três modelos de classificação foram estabelecidos com base no algoritmo LDA: Correlação à distância + LDA, LASSO + LDA, e GBDT + LDA. Os conjuntos de dados foram alimentados no algoritmo LDA, respectivamente, e independentemente. Cada conjunto de dados foi dividido aleatoriamente em grupo de treinamento e validação na proporção de 4:1. O modelo treinado por grupo de treinamento foi então aplicado ao grupo de validação independente para avaliar seu desempenho. Para avaliar a robustez do algoritmo LDA, o procedimento foi repetido durante 100 ciclos com atribuição de casos diferentes, aleatórios e independentes. Uma matriz de confusão foi determinada usando a verdadeira atribuição da histopatologia e as previsões do algoritmo LDA. A sensibilidade padrão, a especificidade, as áreas sob curva característica operacional do receptor (AUC) e a precisão foram calculadas tanto para o grupo de treinamento quanto para o grupo de validação para revelar a capacidade discriminatória dos modelos. A comparação de três modelos (Distance Correlation + LDA, LASSO + LDA e GBDT + LDA) foi realizada para determinar o modelo discriminativo ótimo para glioblastoma e ANA. O fluxograma da classificação da RM por características de textura é mostrado na Figura 1.
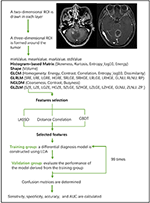
Figura 1. Fluxograma de classificação da ressonância magnética por características de textura. ANA, astrocitoma anaplástico; LDA, análise linear discriminante; MRI, Ressonância magnética; LASSO, operador de menor retração absoluta e seleção; GBDT, árvore de decisão de correlação de gradientes; HISTO, matriz baseada em histograma; GLCM, matriz de co-ocorrência de nível de cinza; GLRLM, matriz de comprimento de faixa de cinza; GLZLM, matriz de comprimento de faixa de cinza; NGLDM, matriz de dependência de nível de cinza da vizinhança; AUC, área sob a curva característica de operação do receptor.
Resultados
Características dos pacientes
Um total de 133 pacientes com glioblastoma (n = 76) ou ANA (n = 57) preencheram os critérios de inclusão. Todos os pacientes com glioblastoma foram incluídos neste estudo, enquanto 10 pacientes com ANA foram excluídos de acordo com os critérios de exclusão. Finalmente, 76 pacientes com glioblastoma e 46 pacientes com ANA foram incluídos neste estudo. As idades médias dos pacientes foram de 46,9 (15-67) e 40,0 (7-69), respectivamente. Todos os pacientes foram submetidos à ressecção cirúrgica de tumores em nosso departamento de neurocirurgia no período de 2015 a 2018. A Figura 2 mostra dois casos do plano axial de imagens contrastadas em pacientes com glioblastoma e ANA.
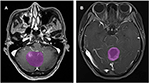
Figura 2. Exemplos de dois casos de imagens de RM com contraste em pacientes com glioblastoma e ANA. (A) Imagens contrastadas com ANA, (B) imagens contrastadas com glioblastoma. ANA, astrocitoma anaplásico.
Glioblastoma vs. ANA
Existiram três modelos analisados neste estudo, incluindo Correlação à distância + LDA, LASSO + LDA, GBDT + LDA. As características de textura utilizadas para classificação nestes modelos foram mostradas na Tabela Complementar 3. O desempenho de cada modelo foi apresentado na Tabela 1 (incluindo sensibilidade, especificidade, precisão e AUC do treinamento e do grupo de validação). O LASSO + LDA obteve o melhor desempenho com os AUCs mais elevados tanto no grupo de treinamento como no grupo de validação. A sensibilidade, especificidade, precisão e AUC do seu grupo de treinamento foram 0,989, 0,993, 0,996 e 0,997, respectivamente; e para o grupo de validação, foram 0,927, 0,989, 0,968 e 0,974, respectivamente. Além disso, a Distance Correlation + LDA e GBDT + LDA também mostrou capacidade promissora de discriminar o glioblastoma da ANA, com AUC ≥0.95 tanto para grupos de treinamento quanto para grupos de validação.

Tabela 1. Discriminação entre glioblastoma e ANA.
Figure 3 mostra a relação entre as funções discriminatórias canônicas dos modelos LASSO + LDA para os grupos glioblastoma e ANA (triângulos e círculos) e para o grupo centroides (quadrados). Nesta figura foi observada uma sobreposição mínima. Qualitativamente, a análise dos dados selecionados pelo LASSO poderia separar o glioblastoma do ANA. A Figura 4 mostra a distribuição da função direta LDA determinada para o glioblastoma e ANA para um dos 100 ciclos de treinamento independentes na análise de dados para ilustrar o desempenho do modelo LASSO + LDA. Houve mudanças claras dos valores da função LDA, com deslocamento esquerdo para ANA e deslocamento direito para glioblastoma.
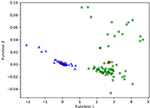
Figura 3. Relação entre as funções discriminatórias canônicas dos modelos LASSO + LDA para os grupos glioblastoma e ANA (triângulos e círculos) e para os centróides do grupo (quadrados). Nesta figura foi observada uma sobreposição mínima. Qualitativamente, a análise dos dados selecionados pelo LASSO poderia separar o glioblastoma do ANA. LASSO, operador de menor retração absoluta e seleção; LDA, análise linear discriminante; ANA, astrocitoma anaplástico.
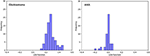
Figura 4. Distribuição da função direta LDA determinada para o glioblastoma e ANA para um dos 100 ciclos de treinamento independentes na análise dos dados para ilustrar o desempenho do modelo LASSO + LDA. Houve mudanças claras dos valores da função LDA, com turno esquerdo para o ANA e turno direito para o glioblastoma. Observa-se uma sobreposição mínima entre os dois grupos e uma forte semelhança qualitativa entre as parcelas para ciclos e triângulos. LDA, análise linear discriminante; ANA, astrocitoma anaplásico; LASSO, operador de menor retração absoluta e seleção.
Discussão
O diagnóstico diferencial pré-tratamento entre glioblastoma e ANA é importante considerando a diferença significativa na estratégia de tratamento e no prognóstico do paciente. A RM, o principal exame radiológico pré-operatório para tumores cerebrais, é altamente recomendada como a boa sensibilidade na detecção de lesões. Entretanto, o diagnóstico preciso antes da operação ainda é um desafio, pois ambos os tumores apresentam características semelhantes em imagens de RM convencionais que estão além da avaliação a olho nu humana (4, 5). Neste estudo, extraímos características de textura fazendo uma descrição quantitativa das imagens para maximizar a utilização do exame de RM, com o qual foram estabelecidos três modelos baseados em LDA. Os resultados demonstraram que a análise de textura baseada em RM combinando com o algoritmo LDA poderia permitir a diferenciação viável entre glioblastoma e ANA.
TA é uma abordagem matemática para caracterizar a heterogeneidade do valor de voxel nas imagens. Ele poderia visualizar a heterogeneidade histológica espacial que é invisível à avaliação do olho humano (21). Teoricamente, as características das imagens das lesões poderiam ser analisadas quantitativamente como características de textura, devido aos seus diferentes padrões aprimorados nas imagens de RM (22). Além disso, estudos anteriores sugeriram que as características das texturas poderiam refletir uma série de processos patológicos anormais do tumor como edema, derrame e necrose, fornecendo um mecanismo potencial para características de textura na discriminação do glioblastoma de ANA (23, 24).
A inteligência artificial tem sido amplamente explorada em pesquisas recentes. Combinado com características de textura extraídas das imagens, foi relatado para auxiliar na classificação do tumor, diagnóstico clínico e predição de resultados. Um estudo com o objetivo de avaliar o desempenho diagnóstico de algoritmos de aprendizagem de máquina baseados em TA em diferenciar o PCNSL do glioblastoma apresentou desempenho ótimo com a AUC média de 0,921, enquanto a AUC de três leitores foram todos <0,8. Assim, os pesquisadores concluíram que a performance diagnóstica dos algoritmos de aprendizagem de máquinas baseados em TA foi superior à dos leitores humanos (25). Outros estudos com propósito semelhante também demonstraram resultados semelhantes com CUA superiores a 0,85 (18, 26). Além disso, pesquisadores com o objetivo de aplicar a aprendizagem de máquinas na graduação de astrocitomas também relataram capacidade promissora em discriminação (27). Em nosso estudo, os modelos de classificação foram estabelecidos com base em algoritmos de LDA. O LDA é o classificador estatístico que combina parâmetros inseridos em uma função discriminante para classificar casos em diferentes grupos (28). Nossos resultados demonstraram que o modelo baseado em LDA representou um desempenho promissor no diagnóstico preciso entre glioblastoma e ANA.
A adoção de características ótimas para algoritmos de aprendizagem de máquinas foi desafiadora, mas foi necessária em relação ao desempenho diagnóstico. Estudos prévios realizam a seleção de características com métodos variados: Teste Mann-Whitney U com AUC de ROC, teste t de Student com eliminação recursiva de características, floresta aleatória e discretização baseada em entropia, respectivamente (18, 25, 29, 30). Com base nos resultados desses estudos, podemos concluir que o método de seleção adequado tem um papel fundamental no desempenho do classificador. Quanto ao nosso estudo, um número relativamente grande de parâmetros foi extraído de diferentes matrizes, aumentando a chance na seleção das características ótimas, mas também aumentando a dificuldade na seleção. Portanto, três métodos de seleção de características (Distance Correlation, LASSO e GBDT) foram avaliados para selecionar aquele com melhor desempenho. Os resultados deste estudo demonstraram que o LASSO+LDA foi o modelo discriminativo adequado para o glioblastoma de ANA com maior AUC no grupo de teste de 0,997. O LASSO foi proposto como um método não-linear de seleção de variáveis para rede neural em estudo anterior com vantagem em minimizar a soma comum de erros quadráticos. Ele poderia produzir modelos interpretáveis (semelhantes à seleção do subconjunto) ao exibir simultaneamente a estabilidade da regressão da crista. O estudo anterior mostrou que ele representava desempenho superior a outros métodos de seleção de variáveis de última geração (31). Contudo, devemos interpretar cuidadosamente os resultados de que o ganho adicional de informação resultante da comparação de diferentes técnicas de aprendizagem de máquinas é bastante limitado, especificamente dado que todos os métodos de selecção de classificadores/características investigados parecem ter um desempenho bastante comparável e a variância na AUC pode ser parcialmente atribuída devido ao grupo estatístico. Portanto, nosso estudo só poderia ser considerado como geração de hipóteses para estudos futuros, maiores.
Existiram algumas limitações do nosso estudo. Em primeiro lugar, como um estudo retrospectivo monocêntrico, o viés na seleção de pacientes era inevitável. Segundo, o número de pacientes incluídos foi relativamente pequeno, sendo necessário um número maior de pacientes em estudos posteriores para validar os resultados. Terceiro, a ANA está agora dividida em três categorias de acordo com a Classificação de Tumores do Sistema Nervoso Central da Organização Mundial da Saúde de 2016: IDH-mutante, IDH- tipo selvagem, e NOS (32). A capacidade de aprendizagem de máquinas em subtipos discriminantes de ANA foi exigida para ser explorada em estudos futuros. Em quarto lugar, os modelos de aprendizagem de máquinas em nosso estudo não foram validados em outros conjuntos de dados. Nós não adotamos outros conjuntos de dados de outras instituições porque essas características de textura poderiam ser diferentes quando extraídas de imagens adquiridas com vários scanners ou protocolos. Isto poderia ser considerado como uma espada de dois gumes. Por um lado, um conjunto de variáveis controladas poderia ser fornecido; por outro lado, os resultados não poderiam ser amplamente aplicados. O protocolo de análise e o procedimento de processamento de imagens foram pacotes de código aberto e são necessários estudos com grande população para validar e reproduzir nossos resultados.
Conclusão
Neste trabalho, extraímos parâmetros quantitativos de imagens de MR com contraste e usamos três métodos de seleção de características para selecionar os parâmetros mais discriminantes. Em seguida, aplicamos algoritmo LDA para analisar os parâmetros selecionados. Nosso estudo mostra que as características de textura têm a capacidade promissora de discriminar o glioblastoma de ANA. Estudos multicêntricos com maior número de pacientes são justificados para confirmar este resultado preliminar.
Data Availability
Temos o prazer de compartilhar nossos dados com qualquer pesquisador qualificado sem reservas indevidas. Por favor, entre em contato com o autor correspondente se houver alguma necessidade.
Declaração de Ética
Os estudos envolvendo participantes humanos foram revisados e aprovados pelo Comitê de Ética da Universidade de Sichuan. O consentimento informado por escrito para participar deste estudo foi fornecido pelo tutor legal/próximo parente dos participantes. O consentimento livre e esclarecido por escrito foi obtido do(s) indivíduo(s) e do(s) parente(s) menor(es), para a publicação de quaisquer imagens ou dados potencialmente identificáveis incluídos neste artigo.
Contribuições do Autor
ZT, CC, JX e XM contribuíram com a concepção e desenho do estudo. CC e XO inscreveram pacientes elegíveis e obtiveram registros médicos e imagens de ressonância magnética de cada paciente. YF e ZT fizeram análise de textura. JW estabeleceu os modelos e realizou outras análises estatísticas. ZT escreveu o primeiro rascunho do manuscrito. CC escreveu as seções do manuscrito. Todos os autores contribuíram para a revisão do manuscrito, leram e aprovaram a versão submetida.
Conflict of Interest Statement
Os autores declaram que a pesquisa foi realizada na ausência de qualquer relação comercial ou financeira que pudesse ser interpretada como um potencial conflito de interesse.
Material Suplementar
O Material Suplementar para este artigo pode ser encontrado online em: https://www.frontiersin.org/articles/10.3389/fonc.2019.00876/full#supplementary-material
A abreviaturas
ANA, Astrocitoma Anaplástico; LDA, análise linear discriminante; MRI, Ressonância Magnética; MR, Ressonância Magnética; LASSO, Operador de Menor Retracção Absoluta e Selecção; GBDT, Árvore de Decisão Gradiente de Correlação; CSF, Líquido Cerebrospinal; TA, Análise de textura; ROI, Regiões de interesse; HISTO, Matriz baseada em histograma; GLCM, Matriz de co-ocorrência de nível de cinza; GLRLM, Matriz de comprimento de corrida de nível de cinza; GLZLM, Matriz de comprimento de zona de nível de cinza; NGLDM, Matriz de dependência de nível de cinza da vizinhança; AUC, Área sob a curva característica operacional do receptor; PCNSL, Linfoma primário do sistema nervoso central; MLP, Percetrão multicamadas; IDH, Isocitrato desidrogenase.
1. Torre LA, Bray F, Siegel RL, Ferlay J, Lortet-Tieulent J, Jemal A. Estatísticas globais de câncer, 2012. Clínica de Câncer CA J. (2015) 65:87-108. doi: 10.3322/caac.21262
PubMed Abstract | CrossRef Full Text | Google Scholar
2. Chen W, Zheng R, Baade PD, Zhang S, Zeng H, Bray F, et al. Estatísticas de câncer na China, 2015. Clínica de Câncer CA J. (2016) 66:115-32. doi: 10.3322/caac.21338
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Wen PY, Kesari S. Malignant gliomas in adults. N Engl J Med. (2008) 359:492-507. doi: 10.1056/NEJMra0708126
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Grimm SA, Chamberlain CM. Astrocitoma Anaplásico. CNS Oncol. (2016) 5:145-57. doi: 10.2217/cns-2016-0002
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Batash R, Asna N, Schaffer P, Francis N, Schaffer M. Glioblastoma multiforme, diagnóstico e tratamento; revisão recente da literatura. Curr Med Chem. (2017) 24:3002-9. doi: 10.2174/0929867324666170516123206
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Weller M, van den Bent M, Hopkins K, Tonn JC, Stupp R, Falini AE, et al. Diretriz EANO para o diagnóstico e tratamento de gliomas anaplásicos e glioblastoma. Lancet Oncol. (2014) 15:e395-403. doi: 10.1016/s1470-2045(14)70011-7
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Souhami L, Seiferheld W, Brachman D, Podgorsak EB, Werner-Wasik M, Lustig R, et al. Randomized comparison of stereotactic radiosurgery followed by conventional radiotherapy with carmustine to conventional radiotherapy with carmustine for patients with glioblastoma multiforme: report of Radiation Therapy Oncology Group 93-05 protocol. Int J Radiat Oncol Biol Phys. (2004) 60:853-60. doi: 10.1016/j.ijrobp.2004.04.011
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Burger PC, Heinz ER, Shibata T, Kleihues P. Anatomia topográfica e correlações de TC no glioblastoma multiforme não tratado. J Neurocirurgia. (1988) 68:698-704. doi: 10.3171/jns.1988.68.5.0698
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Wick W, Platten M, Meisner C, Felsberg J, Tabatabai G, Simon M, et al. Quimioterapia temozolomida isolada versus radioterapia isolada para astrocitoma maligno em idosos: o ensaio NOA-08 randomizado, fase 3. Lancet Oncol. (2012) 13:707-15. doi: 10.1016/s1470-2045(12)70164-x
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Chen W, Silverman HD. Avanços na avaliação de tumores cerebrais primários. Semin Nucl Med. (2008) 38:240-50. doi: 10.1053/j.semnuclmed.2008.02.005
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Burger PC, Vogel FS, Green SB, Strike AT. Glioblastoma multiforme e astrocitoma anaplásico. Critérios patológicos e implicações prognósticas. Câncer. (1985) 56:1106-11.
PubMed Abstract | Google Scholar
12. Omuro A, DeAngelis ML. Glioblastoma e outros gliomas malignos: uma revisão clínica. JAMA. (2013) 310:1842-50. doi: 10.1001/jama.2013.280319
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Lakhman Y, Veeraraghavan H, Chaim J, Feier D, Goldman DA, Moskowitz CS, et al. Differentiation of uterine leiomyosarcoma from atypical leiomyoma: diagnostic accuracy of qualitative MR imaging features and feasibility of texture analysis. Eur Radiol. (2017) 27:2903-15. doi: 10.1007/s00330-016-4623-9
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Skogen K, Schulz A, Dormagen JB, Ganeshan B, Helseth E, Server A. Desempenho diagnóstico da análise de textura na RM na classificação de gliomas cerebrais. Eur J Radiol. (2016) 85:824-9. doi: 10.1016/j.ejrad.2016.01.013
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Gibbs P, Turnbull WL. Análise textural de imagens de RM com contraste da mama. Magn Reson Med. (2003) 50:92-8. doi: 10.1002/mrm.10496
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Castellano G, Bonilha L, Li LM, Cendes F. Análise textual de imagens médicas. Clin Radiol. (2004) 59:1061-9. doi: 10.1016/j.crad.2004.07.008
PubMed Abstract | CrossRef Full Text | Google Scholar
17. Davnall F, Yip CS, Ljungqvist G, Selmi M, Ng F, Sanghera B, et al. Avaliação da heterogeneidade tumoral: uma ferramenta emergente de imagem para a prática clínica? Insights Imaging. (2012) 3:573-89. doi: 10.1007/s13244-012-0196-6
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Xiao DD, Yan PF, Wang YX, Osman MS, Zhao YH. Glioblastoma e linfoma primário do sistema nervoso central: diferenciação pré-operatória através da análise de textura 3D baseada em RM. Clin Neurol Neurocirurgia. (2018) 173:84-90. doi: 10.1016/j.clineuro.2018.08.004
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Itakura H, Achrol AS, Mitchell LA, Loya JJ, Liu T, Westbroek EM, et al. Características da imagem de ressonância magnética identificam subtipos fenotípicos de glioblastoma com atividades de rotas moleculares distintas. Sci Transl Med. (2015) 7:303ra138. doi: 10.1126/scitranslmed.aaaa7582
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Nioche C, Orlhac F, Boughdad S, Reuze S, Goya-Outi J, Robert C, et al. LIFEx: um freeware para o cálculo de características radiômicas em imagens de multimodalidade para acelerar os avanços na caracterização da heterogeneidade tumoral. Cancer Res. (2018) 78:4786-9. doi: 10.1158/0008-5472.Can-18-0125
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Hu LS, Ning S, Eschbacher JM, Gaw N, Dueck AC, Smith KA, et al. Multi-parametric MRI e análise de textura para visualizar a heterogeneidade histológica espacial e a extensão tumoral no glioblastoma. PLoS UM. (2015) 10:e0141506. doi: 10.1371/journal.pone.0141506
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Florez E, Nichols T, Parker EE, Lirertte ST, Howard CM, Fatemi A. Ressonância magnética multiparamétrica na avaliação de tumores cerebrais primários através de características radiométricas: uma métrica para o planejamento do tratamento com radiação guiada. Cureus. (2018) 10:e3426. doi: 10.7759/cureus.3426
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Mahmoud-Ghoneim D, Alkaabi MK, de Certaines JD, Goettsche MF. O impacto da gama dinâmica da imagem na classificação da textura da matéria branca do cérebro. BMC Med Imaging. (2008) 8:18. doi: 10.1186/1471-2342-8-18
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Ahn SY, Park CM, Park SJ, Kim HJ, Song C, Lee SM, et al. Valor prognóstico das características de textura da tomografia computadorizada em cânceres de pulmão de células não pequenas tratados com quimioradioterapia concomitante definitiva. Invest Radiol. (2015) 50:719-25. doi: 10.1097/rli.0000000000000174
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Suh HB, Choi YS, Bae S, Ahn SS, Chang JH, Kang SG, et al. Linfoma primário do sistema nervoso central e glioblastoma atípico: Diferenciação através da abordagem radiômica. Eur Radiol. (2018) 28:3832-9. doi: 10.1007/s00330-018-5368-4
PubMed Abstract | CrossRef Full Text | Google Scholar
26. Mouthuy N, Cosnard G, Abarca-Quinones J, Michoux N. Ressonância magnética multiparamétrica para diferenciar gliomas de alto grau e metástases cerebrais. J Neuroradiol. (2012) 39:301-7. doi: 10.1016/j.neurad.2011.11.002
PubMed Abstract | CrossRef Full Text | Google Scholar
27. Glotsos D, Spyridonos P, Cavouras D, Ravazoula P, Dadioti PA, Nikiforidis G. Um sistema de análise de imagem baseado em máquinas vetoriais de suporte para o diagnóstico automático de astrocitomas de tumor cerebral na rotina clínica. Med Informar Med. Internet. (2005) 30:179-93. doi: 10.1080/14639230500077444
PubMed Abstract | CrossRef Full Text | Google Scholar
28. Dellacasa Bellingegni A, Gruppioni E, Colazzo G, Davalli A, Sacchetti R, Guglielmelli E, et al. NLR, MLP, SVM, e LDA: uma análise comparativa dos dados EMG de pessoas com amputação trans-radial. J Neuroeng Rehabil. (2017) 14:82. doi: 10.1186/s12984-017-0290-6
PubMed Abstract | CrossRef Full Text | Google Scholar
29. Ion-Margineanu A, Van Cauter S, Sima DM, Maes F, Sunaert S, Himmelreich U, et al. Classificando formas de seguimento multiforme de glioblastoma progressivo vs. responsivo usando características multi-paramétricas de ressonância magnética. Neurociências frontais. (2016) 10:615. doi: 10.3389/fnins.2016.00615
PubMed Abstract | CrossRef Full Text | Google Scholar
30. Fetit AE, Novak J, Peet AC, Arvanitits NT. As características texturais tridimensionais da RM convencional melhoram a classificação diagnóstica dos tumores cerebrais infantis. RNM Biomed. (2015) 28:1174-84. doi: 10.1002/nbm.3353
PubMed Abstract | CrossRef Full Text | Google Scholar
31. Sun K, Huang SH, Wong DS, Jang SS. Projeto e aplicação de um método de seleção variável para redes neurais de perceptron multicamadas com LASSO. IEEE Trans Neural Netw Learn Syst. (2017) 28:1386-96. doi: 10.1109/tnnls.2016.2542866
PubMed Abstract | CrossRef Full Text | Google Scholar
32. Louis DN, Perry A, Reifenberger G, von Deimling A, Figarella-Branger D, Cavenee WK, et al. A classificação dos tumores do sistema nervoso central da Organização Mundial de Saúde em 2016: um resumo. Acta Neuropathol. (2016) 131:803-20. doi: 10.1007/s00401-016-1545-1
PubMed Abstract | CrossRef Full Text | Google Scholar




