Frontiers in Pharmacology
Introdução
Olanzapina é um dos antipsicóticos de segunda geração (SGAs) mais usados para esquizofrenia, distúrbio bipolar, e sintomas psicóticos. Além de melhorar os principais sintomas da psicose, a olanzapina mostra grande aceitação, diminui a descontinuação de todas as causas e previne recaídas futuras (Leucht et al., 2009). Muitos ensaios clínicos randomizados (ECR) e metanálises têm sugerido que a olanzapina é um dos medicamentos antipsicóticos mais eficazes em pacientes com esquizofrenia (Leucht et al., 2013; Huhn et al., 2019).
Os efeitos adversos mais comuns da olanzapina é o ganho de peso (Allison et al., 1999). A olanzapina é o ganho de peso mais comum dos SGAs. A comparação de Atypicals for First Episode (CAFE) trial demonstrou que 80% dos pacientes tratados com olanzapina ganharam mais de 7% do seu peso corporal inicial na semana 52 (McEvoy et al., 2007). A taxa de descontinuação da olanzapina devido ao ganho de peso ou efeitos metabólicos acompanhantes foi 2-8 vezes maior do que outros antipsicóticos no ensaio Clinical Antipsychotic Trials in Intervention Effectiveness (CATIE) (Lieberman et al., 2005). Além de estar associado a uma menor adesão ao tratamento medicamentoso, o ganho de peso também está associado a uma morbidade e mortalidade médicas substanciais. Considerando a alta taxa de obesidade em pacientes com esquizofrenia (42%), o risco potencial de ganho de peso induzido por olanzapina deve ser avaliado cuidadosamente (Newcomer, 2006). Alguns estudos de ensaios clínicos aleatórios (ECR) descobriram que pacientes com doenças mentais morrem até 30 anos antes da população geral (Das-Munshi et al., 2017). A principal causa de morte nesta população é a doença cardíaca. Um importante fator de risco para doença cardíaca e morte prematura nesses pacientes é o ganho de peso (Fekadu et al., 2015).
Os mecanismos subjacentes ao ganho de peso induzido por antipsicóticos e efeitos metabólicos adversos não são bem compreendidos (Correll et al., 2011). A olanzapina está associada a um apetite e ingestão alimentar elevados e a uma diminuição da actividade ou diminuição da regulação metabólica (Roerig et al., 2005; Henderson et al., 2015). Fountaine et al. reportaram que, em homens saudáveis, a olanzapina aumentou o peso corporal através do aumento da ingestão de alimentos, sem evidências de diminuição da atividade ou dos níveis de gastos (Fountaine et al., 2010). Esta observação está de acordo com as observações de homens adolescentes internados com esquizofrenia (Gothelf et al., 2002). Os pacientes aumentaram significativamente o índice de massa corporal devido ao aumento da ingestão calórica após 4 semanas de tratamento com olanzapina (Gothelf et al., 2002). Entretanto, as evidências atuais sobre a associação do apetite com o ganho de peso são inconclusivas (Poyurovsky et al., 2007; Case et al., 2010). Case et al. reportaram que as mudanças precoces de apetite não foram consistentemente correlacionadas com a mudança global de peso em quatro estudos diferentes (Case et al., 2010). Além disso, nenhum estudo relatou o momento exato do aumento do apetite, comparou a velocidade de ganho de peso em relação ao momento do aumento do apetite, ou avaliou diferenças no ganho de peso e efeitos metabólicos entre pacientes com apetite aumentado ou inalterado. Portanto, avaliamos a associação entre o aumento do apetite e as mudanças de peso induzidas pela olanzapina e os efeitos metabólicos acompanhantes em pacientes com primeiro episódio de esquizofrenia por drogas.
Materiais e Métodos
Participantes
Este estudo foi realizado no Instituto de Saúde Mental do Segundo Hospital de Xiangya, Universidade Central do Sul, China, entre dezembro de 2016 e abril de 2019. Os participantes foram avaliados para esquizofrenia de acordo com os critérios definidos pelo Diagnostic and Statistical Manual of Mental Disorders-Fifth Edition (DSM-5) (A.P. Association, 2013). Como os pacientes com antipsicóticos/návegas/primeiro episódio parecem ganhar mais peso após o tratamento com olanzapina (Correll et al, 2011), incluímos neste estudo pacientes com esquizofrenia do primeiro episódio de 18-50 anos de idade.
Os critérios de exclusão incluíram (i) achados clinicamente anormais de exames físicos, exames laboratoriais ou resultados de eletrocardiograma (ECG); (ii) desordens como incapacidade intelectual, desordem por uso de substâncias ou álcool, um diagnóstico de outras doenças sistêmicas específicas de acordo com os critérios do DSM-5; (iii) doenças cardiovasculares e metabólicas, como diabetes melito, dislipidemia e hipertensão arterial; (iv) histórico de distúrbios alimentares; (v) dieta rigorosa no mês anterior à triagem ou durante o estudo; e (vi) gravidez ou lactação.
Intervenção
Estudos anteriores sugeriram que a taxa de ganho de peso induzido pela olanzapina foi mais rápida durante as primeiras 12 semanas de tratamento (Correll et al, 2009). Portanto, os participantes foram tratados com olanzapina (15-20 mg/dia às 20:00 horas) durante 12 semanas. A dose inicial de olanzapina foi de 5 mg/dia e depois ajustada para 15-20 mg/dia na primeira semana.
Avaliação
Avaliações de linha de base incluíram demografia, histórico médico completo, medidas antropométricas (peso e altura), apetite, exame físico e análise laboratorial. O apetite foi avaliado diariamente, 30 minutos antes do almoço, com quatro perguntas padronizadas: Fome, Sentir-se cheio, Pensar na comida, e Comer demais. As respostas foram classificadas em uma escala de 0 a 10, onde 0 = “nada” e 10 = “extremamente”. O aumento do apetite foi definido como um >10% de aumento na pontuação de apetite inicial. A diminuição do apetite foi definida como uma diminuição de >10% nas pontuações da linha de base do apetite. A Escala de Síndrome Positiva e Negativa (PANSS) foi usada para avaliar a gravidade dos sintomas de esquizofrenia. Os efeitos adversos foram avaliados pela Escala de Sintomas Emergentes de Tratamento (TESS). A cada visita de acompanhamento, todas as avaliações de linha de base (incluindo exame físico, medidas antropométricas, apetite e TESS) foram repetidas, exceto a Escala de Sintomas Emergentes (PANSS). A PANSS foi reavaliada na semana 12.
Prior ao tratamento e no estado de jejum, peso e altura foram medidos após os participantes removerem sapatos com roupas leves de interior. O apetite foi avaliado antes do almoço e foi baseado no julgamento do médico avaliador no dia do exame. O trabalho laboratorial, incluindo glicose plasmática, fígado e função renal, foi avaliado usando procedimentos enzimáticos com o analisador químico automático Boehringer Mannheim/Hitachi 714. A insulina foi medida com um imunoensaio enzimático de fase sólida (ELISA).
Os resultados primários foram a percentagem de pacientes que tinham aumentado o apetite e o período de tempo entre o tratamento com olanzapina e o aumento do apetite. Os resultados secundários incluíram alterações no peso, índice de massa corporal (IMC), glicose em jejum, índice de insulina e resistência à insulina em jejum, perfis lipídicos que incluíram triglicérides, colesterol, lipoproteínas de alta densidade (HDL-C) e lipoproteínas de baixa densidade (LDL-C), e escore PANSS. O IMC foi calculado de acordo com os critérios do Grupo de Trabalho sobre Obesidade na China: peso saudável (18,5 ≤ IMC <25 kg/m2), sobrepeso (25 ≤ IMC ≤ 28 kg/m2), e obesidade (IMC > 28 kg/m2). A dislipidemia foi definida como colesterol ≥ 5.18 mmolċl-1, triglicérides ≥ 1.70 mmolċl-1, HDL-C < 1.04 mmolċl-1, ou LDL-C ≥ 3.37 mmolċl-1 baseado nas diretrizes chinesas para dislipidemia (Hu, 2017). Uma análise da proporção de pacientes que ganharam mais de 7% do seu peso corporal basal após 12 semanas, que é o corte para o ganho de peso clinicamente significativo, também foi incluída (Kanders et al., 1991).
Análise estatística
Statistical Package for Social Sciences, versão 25.0 (SPSS v25.0) foi empregada para análise estatística. As variáveis contínuas e categóricas são descritas utilizando estatísticas resumidas (médias e desvios padrão) ou frequências e percentagens, respectivamente. O teste t de Student e a análise do qui-quadrado foram utilizados para analisar as diferenças entre os grupos nas alterações de peso corporal, IMC, glicose e insulina em jejum, índice de resistência à insulina, triglicérides, colesterol, colesterol HDL e LDL-C desde a linha de base até cada ponto de tempo. Investigamos a associação entre peso, IMC, índice de resistência à insulina, colesterol LDL e apetite através da análise de regressão linear. Um valor de P (p) < 0,05 foi considerado estatisticamente significativo.
Resultados
No total, 33 pacientes internados com esquizofrenia (média de idade, 23,5 anos; variação de 18-36 anos) foram incluídos no estudo. Houve uma proporção maior de pacientes do sexo feminino (63,6%, 21/33). Todos os pacientes estavam na faixa de IMC normal (IMC médio, 21,3 ± 1,7 kg/m2). A duração média da esquizofrenia foi de 11,2 ± 3,7 (variação de 5-18) meses. Dois pacientes do sexo feminino abandonaram o estudo após 4 semanas devido ao aumento do apetite; os restantes 31 (93,9%) participantes completaram o estudo (Tabela 1).
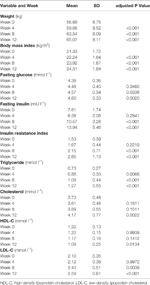
Tabela 1 Resumo das medidas de peso e metabólicas por estudo.
Aumento do apetite após tratamento com olanzapina
Após 12 semanas de tratamento com olanzapina, 77,4% (24/31) pacientes tinham apetite aumentado e 22,6% (7/31) pacientes tinham apetite inalterado. Como mostrado na Figura 1, para os 24 pacientes que tiveram apetite aumentado, o aumento do apetite começou nas primeiras 8 semanas de tratamento com olanzapina e durou até o final do tratamento. O tempo médio desde o início do tratamento com olanzapina até o aumento do apetite foi de 20,3 dias (DP = 14,4), e 25,0% (6/24) e 70,8% (17/24) aumentaram o apetite dentro de 1 semana e 4 semanas, respectivamente. Dois pacientes aumentaram o apetite no 3º dia após o tratamento com olanzapina. Não foi encontrada diferença significativa no apetite induzido pela olanzapina entre diferentes gêneros usando análise bidirecional ANOVA.
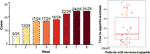
Figure 1 Número de pacientes com apetite aumentado durante períodos de 8 semanas de tratamento com olanzapina.
Alterações do peso corporal e IMC após tratamento com olanzapina
Aumentos significativos no peso e IMC foram observados após o tratamento com olanzapina (Tabela 1). O ganho médio de peso foi de 7,9 kg durante o período de 12 semanas de tratamento com olanzapina, com os pacientes ganhando 2,4, 4,0 e 1,5 kg no primeiro, segundo e terceiro períodos de 4 semanas, respectivamente. Os pacientes do sexo feminino foram mais propensos a ganhar peso (P< 0,001), com um ganho médio de 9,19 kg durante o período de estudo, comparado com um ganho de 5,90 kg em pacientes do sexo masculino. Do total de pacientes, 80,6% (25/31) e 61,3% (19/31) aumentaram seu peso corporal inicial em mais de 7% e 10%, respectivamente, durante as 12 semanas de tratamento com olanzapina (Tabela Suplementar 1). Após 12 semanas, 51,6% (16/31) dos pacientes apresentaram excesso de peso (IMC>25 kg/m2).
Alterações das perturbações metabólicas após o tratamento com olanzapina
Aumentos significativos na glicose de jejum, insulina de jejum, índice de resistência à insulina, triglicérides, colesterol e colesterol LDL e diminuições no colesterol HDL foram observados às 12 semanas (Tabela 1). Nenhum paciente incluído no estudo teve dislipidemia na linha de base. Com base nas diretrizes chinesas para dislipidemia, 38,7% (12/31) dos pacientes tiveram dislipidemia após 12 semanas de tratamento com olanzapina.
Aumento do apetite e ganho de peso induzido pela olanzapina
A fim de detectar o efeito do aumento do apetite no ganho de peso induzido pela olanzapina, dividimos os pacientes em dois grupos (grupo de apetite aumentado e grupo de apetite inalterado) com base se o apetite aumentou ou não após 12 semanas de tratamento com olanzapina.
Comparado com o grupo de apetite inalterado, houve aumentos significativos no peso e níveis de IMC no grupo de aumento de apetite após 12 semanas de tratamento com olanzapina (Tabela 2). A Figura 2 mostrou a comparação do ganho de peso e dos resultados metabólicos entre os grupos de apetite aumentado e inalterado. Análises detalhadas foram apresentadas na Tabela Complementar 2. O ganho de peso entre dois grupos foi significativo (P = 0,01) usando a análise bidirecional ANOVA. O peso médio aumentou em 9,1 kg (DP = 4,1) no grupo de apetite aumentado e 3,9 kg (DP = 2,0) no grupo de apetite inalterado com diferença significativa entre os dois grupos durante o período de 12 semanas de tratamento com olanzapina. Uma maior percentagem de pacientes (91,7%) no grupo de apetite aumentado ganhou mais de 7% do seu peso corporal inicial após 12 semanas quando comparado com os pacientes do grupo de apetite inalterado (42,9%; χ2 = 8,27, df = 1, p = 0,004). Da mesma forma, mais pacientes no grupo de apetite aumentado (19/24, 79,2%) ganharam mais de 10% do peso corporal inicial após 12 semanas, quando comparado com pacientes no grupo de apetite inalterado (0,0%; χ2 = 14,32, df = 1, p < 0,001) (Tabelas Suplementares 3-5). Após 12 semanas de tratamento com olanzapina, 58,3% dos pacientes ficaram com excesso de peso no grupo com apetite aumentado em comparação com 28,6% dos pacientes no grupo com apetite inalterado. O aumento do apetite media fortemente o ganho de peso induzido pela olanzapina com efeito mediador 66,2%.

Tabela 2 Estatísticas descritivas de medidas de resultados entre grupos de apetite aumentado e inalterado na linha de base, e semanas 4, 8, e 12.
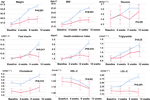
Figure 2 Comparação do peso corporal, IMC, glicose e lipídios entre os grupos de apetite aumentado e inalterado. A linha azul indica pacientes com apetite aumentado; a linha vermelha indica pacientes com apetite inalterado.
Aumento do Apetite e Perturbações Metabólicas Induzidas por Olanzapina
Existiram diferenças significativas em insulina (p = 0,017), índice de resistência à insulina (p = 0,015) e LDL-C (p = 0,001) entre o aumento do apetite e os grupos inalterados após 12 semanas (Figura 2 e Tabela 2). Quatro pacientes no grupo de apetite aumentado tinham colesterol ≥ 5,18 mmolċl-1, nove tinham triglicérides ≥ 1,70 mmolċl-1, seis tinham HDL-C < 1,04ċmmol l-1, e três tinham LDL-C ≥ 3,37 mmolċl-1 na semana 12. No total, 13/24 pacientes do grupo de apetite aumentado tiveram dislipidemia após 12 semanas, enquanto nenhum dos pacientes do grupo de apetite inalterado desenvolveu dislipidemia durante o período de estudo (Tabela 3).

Tábua 3 Dislipidemia definida por cada medida de resultado único no grupo de apetite aumentado e inalterado.
O pico de ganho de peso alcançado 1 mês após o mês de aumento do apetite
No grupo de aumento do apetite, analisamos o ganho médio de peso para cada paciente em quatro pontos de tempo: antes do mês de aumento do apetite (-1M), o mês de aumento do apetite (0M), um mês após o aumento do apetite (+1M), e dois meses após o aumento do apetite (+2M). Em comparação com -1M, houve um aumento de peso a 0M, mas esta alteração não foi significativa (-1M vs. 0M, 1,4 ± 1,2 kg vs. 3,1 ± 1,4 kg). O ganho de peso entrou no pico de crescimento a +1M, com um 4,3 ± 2.Aumento de 4 kg. O crescimento do peso desacelerou a +2M (p < 0,001) em 1,6 ± 1,5 kg. O ganho de peso a +2M desacelerou e estabilizou, e não foram observadas diferenças significativas quando comparado com -1M (Figura 3 e Tabela Complementar 6).
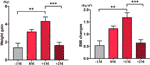
Figure 3 Velocidade média de ganho de peso no grupo de apetite aumentado. A média de ganho de peso de cada paciente por mês durante o período de estudo foi analisada em quatro pontos de tempo: antes do mês de aumento do apetite (-1M), o mês de aumento do apetite (0M), 1 mês após o mês de aumento do apetite (+1M) e 2 meses após o mês de aumento do apetite (+2M). ** indica P < 0.01, *** indica P < 0.001.
Aumento do Apetite Prevê Mais Ganho de Peso em 1 Mês Após o Mês do Aumento do Apetite
Comparamos ainda a velocidade de ganho de peso dos participantes com aumento de apetite dentro de 4 semanas (A) e dos participantes com aumento de apetite entre 4 e 8 semanas (B). A 0M, as velocidades de ganho de peso entre participantes com apetite aumentado dentro de 4 semanas e participantes com apetite aumentado entre 4 e 8 semanas não foram significativamente diferentes. No entanto, os participantes com apetite aumentado anteriormente mostraram um aumento significativo da velocidade de ganho de peso a +1M. Estes resultados demonstraram que um apetite aumentado mais cedo poderia levar a mais ganho de peso durante o período de acompanhamento (Figura 4). Mudanças similares no IMC foram observadas durante os quatro pontos de tempo (Figuras 3 e 4).
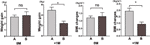
Figura 4 Comparação da velocidade de ganho de peso dos participantes com aumento de apetite em diferentes meses. Comparamos a velocidade de ganho de peso dos participantes com apetite aumentado em 4 semanas (A) e dos participantes com apetite aumentado entre 4 e 8 semanas (B) no mês de tempo para aumentar o apetite (0M) e 1 mês após o mês de tempo para aumentar o apetite (+1M). ns, indica não significativo, * indica P < 0.05.
Apetite e Velocidade das Alterações da Perturbação Metabólica
Dados descritivos detalhados das alterações de peso, IMC, glicose de jejum, insulina, índice de resistência à insulina, triglicérides, colesterol, colesterol HDL e colesterol LDL estão resumidos na Tabela 2. Para investigar a associação entre aumento do apetite e glicose e metabolismo lipídico, analisamos as alterações desses indicadores em quatro pontos do grupo de aumento do apetite. Não foram observadas mudanças significativas de velocidade para glicose, triglicérides, colesterol HDL e colesterol LDL em nenhum ponto do tempo. Aumentos significativos nas velocidades de insulina e no índice de resistência à insulina só foram observados a +2M (Figura 1 e Tabela 6 Suplementar). Outras comparações sugeriram que os participantes com apetite aumentado em 4 semanas não apresentaram aumento significativo da velocidade de insulina e do índice de resistência à insulina em 0M e +1M em comparação aos participantes com apetite aumentado entre 4 e 8 semanas (Figura Suplementar 2).
A Predição do Apetite em Ganho de Peso Induzido por Olanzapina e Perturbações Metabólicas
Conduzimos análise de regressão linear para avaliar o efeito do aumento do apetite no ganho de peso, glicemia e níveis lipídicos. Após controle para variáveis estatisticamente significativas como sexo, idade, altura e duração, incluímos o ganho de peso, IMC, glicose em jejum, insulina, índice de resistência à insulina, triglicérides, colesterol, colesterol HDL e LDL-C como variáveis dependentes e o apetite como a variável independente na análise de regressão. O aumento do apetite esteve associado a alterações no peso (β = 0,67, p = 0,0003), IMC (β = 0,63, p = 0,0004), insulina (β = 0,49, p = 0,019), índice de resistência à insulina (β = 0,51, p = 0,0149), e LDL-C (β = 0.61, p = 0,0035) (Tabela Complementar 7).
Significantes melhorias dos sintomas clínicos de baselina a ponta (avaliados pelo PANSS, p < 0,001) foram observadas após o tratamento com olanzapina. Não foi observada diferença significativa no PANSS entre os grupos de apetite aumentado e os de apetite inalterado (p > 0,05).
Adverse Effects
Em todos os 31 pacientes que completaram o estudo, nove (29.0%) pacientes reportaram hipoactividade, oito (25,8%) pacientes reportaram sonolência, quatro (12,9%) pacientes apresentaram teste hepático anormal, dois (6,5%) pacientes reportaram acatisia, quatro (12,9%) pacientes tiveram obstipação, um (3).2%) pacientes apresentaram diarréia, e dois (6,5%) pacientes sentiram tontura, e 80,6% (25/31) pacientes aumentaram seu peso corporal em mais de 7% durante o período do estudo.
Discussão
Neste estudo prospectivo, os principais achados mostraram que 77,4% dos pacientes aumentaram seu apetite após o tratamento com olanzapina, e estes pacientes que aumentaram seu apetite ganharam mais peso do que aqueles pacientes com apetite inalterado (9,1 kg vs. 3,9 kg). Da mesma forma, mais pacientes no grupo de apetite aumentado aumentaram seu peso corporal inicial em mais de 7 ou 10%, sugerindo que o aumento do apetite está associado ao ganho substancial de peso em pacientes com esquizofrenia do primeiro episódio de esquizofrenia, tratados com olanzapina. Além disso, a análise de regressão linear também apoiou que o aumento do apetite estava fortemente relacionado com o ganho de peso induzido pela olanzapina. Esses achados estavam de acordo com relatórios anteriores (Gothelf et al., 2002; Cope et al., 2005). Murashita et al. (2005) observaram aumento dos níveis de grelin estimulantes do apetite e do percentual de gordura corporal em pacientes esquizofrênicos tratados com olanzapina. Os resultados de um estudo randomizado duplo-cego sugerem que a olanzapina induziu o apetite e o binge eating em maior extensão do que a clozapina (Murashita et al., 2005; Kluge et al., 2007). Resultados similares também foram relatados em ratos tratados com olanzapina (Cope et al., 2005). A ação da olanzapina em múltiplos locais receptores, especialmente os receptores D2 e 5H3, que modulam o apetite, também tem sido aplicada no tratamento de anorexia nervosa e náuseas e vômitos induzidos por quimioterapia (Kluge et al., 2007; Tan et al., 2009; Kafantaris et al., 2011).
Também constatamos que 70,8% dos pacientes aumentaram o apetite nas primeiras 4 semanas do tratamento inicial com olanzapina, com média de 20,3 dias para aumentar. Alguns pacientes até aumentaram o apetite logo no terceiro dia após o tratamento com olanzapina. Interessante, os pacientes cujos apetites aumentaram mais cedo no tempo provavelmente ganhariam mais peso do que os pacientes cujos apetites aumentaram mais tarde no tempo, e o ganho de peso atingiu o seu pico um mês após a ocorrência do aumento do apetite. Embora não tenha sido encontrada diferença significativa no apetite induzido por olanzapina entre homens e mulheres, os pacientes do sexo feminino tinham maior probabilidade de ganhar peso (P < 0,001). Portanto, o apetite deve ser considerado como um indicador para prever o ganho de peso induzido pela olanzapina, especialmente em pacientes do sexo feminino. Em ambientes clínicos, os médicos devem prestar mais atenção aos pacientes cujo apetite aumenta precocemente após o tratamento com olanzapina e devem iniciar um plano de prevenção de peso.
Os pacientes tratados com olanzapina apresentaram um aumento de mais de 7% do peso corporal inicial, o que é consistente com os achados anteriores (Gothelf et al., 2002; Wu et al., 2008). Além do ganho de peso significativo, os pacientes com tratamento com olanzapina tiveram uma perturbação significativa do metabolismo da glicose e dos lipídios após 12 semanas, o que é consistente com observações publicadas anteriormente em pacientes com esquizofrenia (Correll et al., 2011). Comparado aos pacientes do grupo de apetite inalterado, o grupo de apetite aumentado apresentava anormalidades lipídicas significativas. O jejum glicêmico não foi significativamente diferente entre os dois grupos. Os participantes com aumento precoce do apetite não apresentaram aumento da velocidade da insulina e do índice de resistência à insulina nos meses seguintes, após o aumento do apetite. É possível que os níveis de glicose sejam independentes do ganho de peso, já que o apetite não afetou os níveis de glicose.
Os resultados de saúde física associados aos antipsicóticos, tais como ganho de peso, distúrbios metabólicos e morbidade relacionada, há muito foram reconhecidos (Wu et al., 2016). Estudos anteriores sugeriram que o apetite pode prever o ganho de peso induzido por olanzapina e efeitos metabólicos adversos (Gothelf et al., 2002; Poyurovsky et al., 2007; Fountaine et al., 2010). Para nosso conhecimento, este é o primeiro estudo para avaliar a associação entre apetite, ganho de peso e distúrbios metabólicos após o tratamento com olanzapina em pacientes com esquizofrenia do primeiro episódio de esquizofrenia induzida por drogas. Alguns achados nos dão mais evidências sobre como escolher razoavelmente a medicação no trabalho clínico e dão mais benefícios para prevenir o ganho de peso induzido pela olanzapina e distúrbios metabólicos.
Existem várias limitações ao nosso estudo. Primeiro, este estudo não mediu a ingestão de alimentos, como refeições e lanches, embora todos os pacientes incluídos tenham recebido o mesmo menu alimentar padronizado. O consumo elevado de gordura e frutose pode diminuir o controlo do apetite, afectando a regulação central do apetite. De facto, as dietas com alto teor de frutose têm efeitos adversos na sinalização do apetite central e na função cognitiva (Lowette et al., 2015; Dalvi et al., 2017). Em segundo lugar, não examinamos os níveis de leptina e ghrelin durante o período do estudo. Secretos do tecido adiposo e do estômago, respectivamente, a leptina e a grelina desempenham papéis cruciais na regulação da ingestão alimentar e do metabolismo energético (Cui et al., 2017). Vários estudos encontraram um aumento do nível de leptina e uma diminuição do nível de ghrelin nas primeiras semanas após o início da terapia com olanzapina (Basoglu et al., 2010; Stip et al., 2012; Lu et al., 2015). O aumento do nível de leptina permanece estável por várias semanas, mas o nível de grelina aumenta no período mais longo (Sentissi et al., 2008). Outras pesquisas devem monitorar as respostas de leptina e ghrelin ao aumento do apetite, assim como suas relações com parâmetros metabólicos e efeitos clínicos. Além disso, não monitoramos os níveis de atividade durante o período do estudo. Embora alguns estudos tenham relatado que a olanzapina aumentou o peso corporal apenas pelo aumento do apetite e da ingestão de alimentos, sem diferenças significativas no gasto de energia em repouso (Gothelf et al., 2002; Fountaine et al., 2010). Alguns estudos relataram redução das atividades físicas com medicamentos para olanzapina (Perez-Cruzado et al., 2018). Em nosso estudo, 29,0% dos pacientes relataram hipoactividade e 25,8% dos pacientes relataram sonolência durante as 12 semanas de tratamento com olanzapina. Hillebrand et al. (2005) constataram que o tratamento com olanzapina reduziu a atividade física em ratos expostos a anorexia baseada em atividade. O tratamento com olanzapina também reduziu os níveis de atividade de pacientes com anorexia nervosa, sem diferenças significativas no peso corporal e nos níveis de leptina plasmática em comparação com pacientes não tratados. Nosso estudo anterior demonstrou intervenções no estilo de vida, que incluíram programas psico-educacionais, dietéticos e de exercícios, podem reduzir o ganho de peso induzido por antipsicóticos (Wu et al., 2008). Além disso, seria melhor comparar mais pacientes com controles saudáveis de idade semelhante, o que pode ajudar a interpretar o aumento do apetite induzido pela olanzapina e as alterações metabólicas estão especificamente relacionadas às suas propriedades farmacológicas. Outros estudos devem focar os mecanismos do aumento do apetite após o tratamento com olanzapina (Koopmann et al., 2012; Sweeney et al., 2017; Mancuso et al., 2019). O sistema de recompensa nas regiões striatais pode estar associado ao ganho de peso associado ao anti-psicótico (Nielsen et al., 2016). A actividade alterada no córtex cingulado anterior subgenual pode também estar parcialmente subjacente ao aumento do apetite após o tratamento com olanzapina (Pawlowski et al., 2018). Estudos de imagem devem ser realizados para investigar a modulação da atividade cerebral profunda relacionada à olanzapina.
Conclusões
Em conclusão, nosso estudo mostrou que o apetite está relacionado ao ganho de peso induzido pela olanzapina e à dislipidemia em pacientes com primeiro episódio de esquizofrenia induzida por drogas. A avaliação das mudanças de apetite é uma forma fácil e prática de prever o ganho de peso, o que proporciona aos clínicos mais tempo e opções para estratégias de intervenção. As invenções dietéticas precoces destinadas a diminuir o apetite e reduzir a ingestão de alimentos podem ser úteis para o controle de peso em pacientes esquizofrênicos tratados com olanzapina.
Data Availability Statement
Os conjuntos de dados gerados para este estudo estão disponíveis mediante solicitação ao autor correspondente.
Declaração de Ética
Este estudo foi realizado de acordo com a Declaração de Helsinque (G.A.o.t.W.M. Association, 2013), e aprovado pelo Comitê de Ética do Segundo Hospital de Xiangya, Central South University. Após uma descrição completa do estudo aos participantes, foi obtido o consentimento informado antes da participação no estudo.
Contribuições dos autores
JH analisou e interpretou os dados dos pacientes e foi um dos principais colaboradores na elaboração do manuscrito. G-RH desenhou e realizou principalmente o estudo. YeY, C-CL, J-MX, Y-JL e X-JP ajudaram no recrutamento de pacientes, monitoraram a qualidade dos dados e documentaram os eventos adversos emergentes do tratamento. YiY ajudou a revisar o manuscrito. J-PZ orientou o desenho do estudo. A RR-W foi responsável pelo conteúdo geral. Todos os autores leram e aprovaram o manuscrito final.
Funding
Este trabalho foi apoiado pela Key R&D Program Projects, National Science Foundation of China (Grant No.2016YFC1306900) e a National Nature Science Foundation of China (Grant No.81622018 e nº 81901401).
Conflito de interesses
Os autores declaram que a pesquisa foi conduzida na ausência de quaisquer relações comerciais ou financeiras que pudessem ser interpretadas como um potencial conflito de interesses.
Conhecimentos
Gostaríamos de agradecer a valiosa contribuição dos participantes e o apoio de seus clínicos gerais. Queremos também agradecer a vários revisores anónimos pelos seus valiosos comentários e sugestões para melhorar a qualidade do artigo.
Material Suplementar
O Material Suplementar para este artigo pode ser encontrado online em https://www.frontiersin.org/articles/10.3389/fphar.2020.00739/full#supplementary-material
Suplemento Figura 1 | Velocidade da glicemia e alterações lipídicas no grupo de apetite aumentado. Os valores médios de mudança para cada paciente por mês durante o período de estudo foram analisados em quatro momentos: antes do mês de aumento do apetite (-1M), o mês de aumento do apetite (0M), 1 mês após o mês de aumento do apetite (+1M), e 2 meses após o mês de aumento do apetite (+2M).
Suplemento Figura 2 | Comparação das velocidades de mudança do índice de insulina e de resistência à insulina dos participantes com aumento do apetite em diferentes meses. Comparamos a velocidade dos participantes com apetite aumentado em 4 semanas (A) e dos participantes com apetite aumentado entre 4-8 semanas (B) no mês de tempo para aumentar o apetite (0M) e 1 mês após o mês de tempo para aumentar o apetite (+1M).
Tabela de Suplementos 2 | Número de pacientes que aumentaram o peso corporal inicial em mais de 7% ou 10% nas semanas 4, 8, e 12 nos pacientes com apetite aumentado.
>
Suplemento Tabela 3 | Número de pacientes que aumentaram o peso corporal inicial em mais de 7% ou 10% nas semanas 4, 8 e 12, em pacientes com apetite inalterado.
>
Suplemento Tabela 4 | Comparação dos números de 7% ou 10% de ganho de peso entre pacientes com apetite aumentado e pacientes com apetite inalterado nas semanas 4, 8 e 12.
Suplemento Tabela 5 |A análise da velocidade do ganho médio de peso, glicose e alterações lipídicas no apetite aumentou o grupo em quatro pontos de tempo: antes do mês do aumento do apetite (-1M), o mês do aumento do apetite (0M), 1 mês após o mês do aumento do apetite (+1M), e 2 meses após o mês do aumento do apetite (+2M). ns indica não significativo, * indica p< 0,05, ** indica p< 0,01, *** indica p< 0,001.
Suplemento Tabela 6 | Estimativas dos efeitos do apetite sobre o ganho de peso e medidas de resultados metabólicos a partir do modelo linear misto geral, enquanto controla para idade, duração da doença e sexo.
Tabela 7-2 |Estimativas dos efeitos do apetite sobre o ganho de peso e medidas de resultados metabólicos relacionados.
A abreviações
SGAs, Antipsicóticos de segunda geração; RCT, Ensaio clínico aleatório; CAFÉ, A Comparação de Atípicos para o Primeiro Episódio; CATIE, Os Ensaios Clínicos Antipsicóticos na Eficácia da Intervenção; DSM-5, O Manual de Diagnóstico e Estatística dos Transtornos Mentais – 5ª Edição; ECG, Eletrocardiograma; PANSS, The Positive and Negative Syndrome Scale; TESS, Treatment Emergent Symptom Scale; ELISA, Enzyme-linked immunosorbent assays; BMI, Body mass index; HDL-C, High-density lipoprotein; LDL-C, Low-density lipoprotein.
Allison, D. B.., Mentore, J. L., Heo, M., Chandler, L. P., Cappelleri, J. C., Infante, M. C., et al. (1999). Antipsychotic-induced weight gain: a comprehensive research synthesis. Am. J. Psychiatry 156, 1686-1696. doi: 10.1176/ajp.156.11.1686
PubMed Abstract | CrossRef Full Text | Google Scholar
Association, A.P. (2013). Manual de diagnóstico e estatística de distúrbios mentais (DSM-5®) (Arlington, VA: American Psychiatric Pub).
Google Scholar
Basoglu, C., Oner, O., Gunes, C., Semiz, U. B., Ates, A. M., Algul, A., et al. (2010). ghrelin, colecystokinin, visfatina, leptina e níveis de proteína relacionada com agouti durante 6 semanas de tratamento com olanzapina em pacientes masculinos com psicose do primeiro episódio. Int. Clin. Psicofarmacol. 25, 165-171. doi: 10.1097/YIC.0b013e3283377850
PubMed Abstract | CrossRef Full Text | Google Scholar
Case, M., Treuer, T., Karagianis, J., Hoffmann, V. P. (2010). O papel potencial do apetite na previsão de mudanças de peso durante o tratamento com olanzapina. BMC Psychiatry 10, 72. doi: 10.1186/1471-244X-10-72
PubMed Abstract | CrossRef Full Text | Google Scholar
Cope, M., Nagy, T., Fernandez, J., Geary, N., Casey, D., Allison, D. (2005). Ganho de peso induzido por drogas antipsicóticas: desenvolvimento de um modelo animal. Int. J. Obes. 29, 607. doi: 10.1038/sj.ijo.0802928
CrossRef Full Text | Google Scholar
Correll, C. U., Manu, P., Olshanskiy, V., Napolitano, B., Kane, J. M., Malhotra, A. K. (2009). Risco cardiometabólico de medicações antipsicóticas de segunda geração durante a primeira utilização em crianças e adolescentes. Jama 302, 1765-1773. doi: 10.1001/jama.2009.1549
PubMed Abstract | CrossRef Full Text | Google Scholar
Correll, C. U., Lencz, T., Malhotra, A. K. (2011). Drogas antipsicóticas e obesidade. Tendências Mol. Med. 17, 97-107. doi: 10.1016/j.molmed.2010.10.010
PubMed Abstract | CrossRef Full Text | Google Scholar
Cui, H., Lopez, M., Rahmouni, K. (2017). As bases celulares e moleculares da resistência à leptina e ghrelin na obesidade. Nat. Rev. Endocrinol. 13, 338-351. doi: 10.1038/nrendo.2016.222
PubMed Abstract | CrossRef Full Text | Google Scholar
Dalvi, P. S., Chalmers, J. A., Luo, V., Han, D. Y., Wellhauser, L., Liu, Y., et al. (2017). A gordura alta induz inflamação aguda e crônica no hipotálamo: efeito da dieta rica em gordura, palmitato e TNF-alfa sobre os neurônios NPY reguladores do apetite. Int. J. Obes. (Lond) 41, 149-158. doi: 10.1038/ijo.2016.183
PubMed Abstract | CrossRef Full Text | Google Scholar
Das-Munshi, J., Chang, C.-K., Dutta, R., Morgan, C., Nazroo, J., Stewart, R., et al. (2017). Etnicidade e excesso de mortalidade em doenças mentais graves: um estudo de coorte. Lancet Psychiatry 4, 389-399. doi: 10.1016/S2215-0366(17)30097-4
PubMed Abstract | CrossRef Full Text | Google Scholar
Fekadu, A., Medhin, G., Kebede, D., Alem, A., Cleare, A. J., Prince, M., et al. (2015). Excesso de mortalidade em doenças mentais graves: estudo de coorte de 10 anos de base populacional na Etiópia rural. Br. J. Psychiatry 206, 289-296. doi: 10.1192/bjp.bp.114.149112
PubMed Abstract | CrossRef Full Text | Google Scholar
Fountaine, R. J., Taylor, A. E., Mancuso, J. P., Greenway, F. L., Byerley, L. O., Smith, S. R., et al. (2010). Aumento da ingestão alimentar e do gasto energético após a administração de olanzapina a homens saudáveis. Obesidade 18, 1646-1651. doi: 10.1038/oby.2010.6
PubMed Abstract | CrossRef Full Text | Google Scholar
G.A.o.t.W.M. Association (2013). Declaração da Associação Médica Mundial de Helsinque: princípios éticos para a pesquisa médica envolvendo seres humanos. JAMA 10 (20) 2191-2194. doi: 10.1001/jama.2013.281053
CrossRef Full Text | Google Scholar
Gothelf, D., Falk, B., Singer, P., Kairi, M., Phillip, M., Zigel, L., et al. (2002). Ganho de peso associado ao aumento da ingestão de alimentos e baixos níveis de atividade habitual em pacientes adolescentes do sexo masculino esquizofrênico tratados com olanzapina. Am. J. Psychiatry 159, 1055-1057. doi: 10.1176/appi.ajp.159.6.1055
PubMed Abstract | CrossRef Full Text | Google Scholar
Henderson, D. C., Vincenzi, B., Andrea, N. V., Ulloa, M., Copeland, P. M. (2015). Mecanismos fisiopatológicos de risco cardiometabólico aumentado em pessoas com esquizofrenia e outras doenças mentais graves. Lancet Psychiatry 2, 452-464. doi: 10.1016/S2215-0366(15)00115-7
PubMed Abstract | CrossRef Full Text | Google Scholar
Hillebrand, J. J., van Elburg, A. A., Kas, M. J., van Engeland, H., Adan, R. A. (2005). Olanzapine reduz a atividade física em ratos expostos à anorexia baseada em atividade: possíveis implicações para o tratamento da anorexia nervosa? Biol. Psychiatry 58, 651-657.
PubMed Abstract | Google Scholar
Hu, D.-Y. (2017). Novas diretrizes e evidências para prevenção e tratamento de dislipidemia e doença cardiovascular aterosclerótica na China. Dis. crónica. Trans. Med. 3, 73. doi: 10.1016/j.cdtm.2016.11.001
CrossRef Full Text | Google Scholar
Huhn, M., Nikolakopoulou, A., Schneider-Thoma, J., Krause, M., Samara, M., Peter, N., et al. (2019). Eficácia comparativa e tolerabilidade de 32 antipsicóticos orais para o tratamento agudo de adultos com esquizofrenia multiepisódica: uma revisão sistemática e uma meta-análise em rede. Lancet 394 (10202), 939-951. doi: 10.1016/S0140-6736(19)31135-3
PubMed Abstract | CrossRef Full Text | Google Scholar
Kafantaris, V., Leigh, E., Hertz, S., Berest, A., Schebendach, J., Sterling, W. M., et al. (2011). Um estudo piloto controlado por placebo de olanzapina adjuntiva para adolescentes com anorexia nervosa. J. Criança Adolescente. Psicofarmacol. 21, 207-212. doi: 10.1089/cap.2010.0139
PubMed Abstract | CrossRef Full Text | Google Scholar
Kanders, B., Forse, R., Blackburn, G. (1991). Métodos em obesidade. Conn “s Current Therapy (Terapia atual da Conn). Ed. Rakel, R. E. (Philadelphia: WB Saunders), 524-532.
Google Scholar
Kluge, M., Schuld, A., Himmerich, H., Dalal, M., Schacht, A., Wehmeier, P. M., et al. (2007). A clozapina e a olanzapina estão associadas ao desejo de comer e de comer em excesso: resultados de um estudo randomizado duplo-cego. J. Clin. Psicofarmacol. 27, 662-666. doi: 10.1097/jcp.0b013e31815a8872
PubMed Abstract | CrossRef Full Text | Google Scholar
Koopmann, A., von der Goltz, C., Grosshans, M., Dinter, C., Vitale, M., Wiedemann, K., et al. (2012). A associação do peptídeo apetrechado acetilado ghrelin com o desejo de abstinência precoce de indivíduos dependentes de álcool. Psychoneuroendocrinology 37, 980-986. doi: 10.1016/j.psyneuen.2011.11.005
PubMed Abstract | CrossRef Full Text | Google Scholar
Leucht, S., Corves, C., Arbter, D., Engel, R. R., Li, C., Davis, J. M. (2009). Segunda geração versus antipsicóticos de primeira geração para a esquizofrenia: uma meta-análise. Lancet 373, 31-41. doi: 10.1016/S0140-6736(08)61764-X
PubMed Abstract | CrossRef Full Text | Google Scholar
Leucht, S., Cipriani, A., Spineli, L., Mavridis, D., Orey, D., Richter, F., et al. (2013). Eficácia comparativa e tolerabilidade de 15 medicamentos antipsicóticos na esquizofrenia: uma meta-análise de múltiplos tratamentos. Lancet 382, 951-962. doi: 10.1016/S0140-6736(13)60733-3
PubMed Abstract | CrossRef Full Text | Google Scholar
Lieberman, J. A., Stroup, T. S., McEvoy, J. P., Swartz, M. S., Rosenheck, R. A., Perkins, D. O., et al. (2005). Effectiveness of antipsychotic drugs in patients with chronic schizophrenia. Novo Engl. J. Med. 353, 1209-1223. doi: 10.1056/NEJMoa051688
CrossRef Full Text | Google Scholar
Lowette, K., Roosen, L., Tack, J., Vanden Berghe, P. (2015). Efeitos das dietas de alta frutose na sinalização do apetite central e na função cognitiva. Frente. Nutr. 2, 5. doi: 10.3389/fnut.2015.00005
PubMed Abstract | CrossRef Full Text | Google Scholar
Lu, M. L., Wang, T. N., Lin, T. Y., Shao, W. C., Chang, S. H., Chou, J. Y., et al. (2015). Efeitos diferenciais da olanzapina e da clozapina nos níveis plasmáticos de adipocitocitocinas e de ghrelin total. Prog. Neuropsicofarmacol. Biol. Psychiatry 58, 47-50.
PubMed Abstract | Google Scholar
Mancuso, C., Izquierdo, A., Slattery, M., Becker, K. R., Plessow, F., Thomas, J. J., et al. (2019). Mudanças nas Hormonas Reguladoras do Apetite Após a Ingestão de Alimentos estão Associadas a Mudanças no Apetite Reportado e a uma Medida de Alimentação Hedônica em Meninas e Mulheres Jovens com Anorexia Nervosa. Psychoneuroendocrinology 113, 104556. doi: 10.1016/j.psyneuen.2019.104556
PubMed Abstract | CrossRef Full Text | Google Scholar
McEvoy, J. P., Lieberman, J. A., Perkins, D. O., Hamer, R. M., Gu, H., Lazarus, A., et al. (2007). Eficácia e tolerabilidade da olanzapina, quetiapina e risperidona no tratamento de psicose precoce: uma comparação aleatória, duplo-cego de 52 semanas. Am. J. Psychiatry 164, 1050-1060. doi: 10.1176/ajp.2007.164.7.1050
PubMed Abstract | CrossRef Full Text | Google Scholar
Murashita, M., Kusumi, I., Inoue, T., Takahashi, Y., Hosoda, H., Kangawa, K., et al. (2005). Olanzapina aumenta o nível de ghrelin no plasma em pacientes com esquizofrenia. Psychoneuroendocrinology 30, 106-110. doi: 10.1016/j.psyneuen.2004.05.008
PubMed Abstract | CrossRef Full Text | Google Scholar
Newcomer, J. W. (2006). Risco médico em pacientes com transtorno bipolar e esquizofrenia. J. Clin. Psychiatry 67, e16. doi: 10.4088/JCP.1106e16
PubMed Abstract | CrossRef Full Text | Google Scholar
Nielsen, M. Ø., Rostrup, E., Wulff, S., Glenthøj, B., Ebdrup, B. H. (2016). Actividade de recompensa Striatal e alteração de peso associada a anti-psicótico em doentes com esquizofrenia submetidos a tratamento inicial. JAMA Psychiatry 73, 121-128. doi: 10.1001/jamapsychiatry.2015.2582
PubMed Abstract | CrossRef Full Text | Google Scholar
Pawlowski, M., Abshir-Ahmed, Y., Beitinger, P., Steiger, A. (2018). S241. Investigação do Mecanismo de Aumento do Apetite após Olanzapine por sLORETA durante o Sono. Biol. Psychiatry 83, S441-S442.
Google Scholar
Perez-Cruzado, D., Cuesta-Vargas, A., Vera-Garcia, E., Mayoral-Cleries, F. (2018). Medicação e atividade física e aptidão física em doenças mentais graves. Res. 267, 19-24. doi: 10.1016/j.psychres.2018.05.055
PubMed Abstract | CrossRef Full Text | Google Scholar
Poyurovsky, M., Fuchs, C., Pashinian, A., Levi, A., Faragian, S., Maayan, R., et al. (2007). Attenuating effect of reboxetine on appetite and weight gain in olanzapinetreated schizophrenia patients: a double-blind placebo-controlled study. Psicofarmacology 192, 441-448. doi: 10.1007/s00213-007-0731-1
PubMed Abstract | CrossRef Full Text | Google Scholar
Roerig, J. L., Mitchell, J. E., de Zwaan, M., Crosby, R. D., Gosnell, B. A., Steffen, K. J., et al. (2005). A comparison of the effects of olanzapine and risperidone versus placebo on eating behaviors. J. Clin. Psicofarmacol. 25, 413-418. doi: 10.1097/01.jcp.0000177549.36585.29
PubMed Abstract | CrossRef Full Text | Google Scholar
Sentissi, O., Epelbaum, J., Olie, J. P., Poirier, M. F. (2008). Níveis de leptina e ghrelin em pacientes com esquizofrenia durante diferentes tratamentos antipsicóticos: uma revisão. Esquizofrenia. Bull. 34, 1189-1199. doi: 10.1093/schbul/sbm141
PubMed Abstract | CrossRef Full Text | Google Scholar
Stip, E., Lungu, O. V., Anselmo, K., Letourneau, G., Mendrek, A., Stip, B., et al. (2012). Alterações neurais associadas ao processamento de informações sobre o apetite em pacientes esquizofrênicos após 16 semanas de tratamento com olanzapina. Transl. Psychiatry 2, e128. doi: 10.1038/tp.2012.53
PubMed Abstract | CrossRef Full Text | Google Scholar
Sweeney, P., Li, C., Yang, Y. (2017). Papel supressor do apetite dos neurônios glutamatérricos septal medial. Proc. Natl. Acad. Sci. 114, 13816-13821. doi: 10.1073/pnas.1707228114
CrossRef Full Text | Google Scholar
Tan, L., Liu, J., Liu, X., Chen, J., Yan, Z., Yang, H., et al. (2009). Pesquisa clínica de Olanzapine para prevenção de náuseas e vômitos induzidos por quimioterápicos. J. Exp. Clin. Cancer Res. 28, 131. doi: 10.1186/1756-9966-28-131
PubMed Abstract | CrossRef Full Text | Google Scholar
Wu, R.-R., Zhao, J.-P., Jin, H., Shao, P., Fang, M.-S., Guo, X.-F., et al. (2008). Lifestyle intervention and metformin for treatment of antipsychotic-induced weight gain: a randomized controlled trial. Jama 299, 185-193. doi: 10.1001/jama.2007.56-b
PubMed Abstract | CrossRef Full Text | Google Scholar
Wu, R., Zhang, F., Gao, K., Ou, J., Shao, P., Jin, H., et al. (2016). Tratamento com metformina da dislipidemia induzida por antipsicóticos: análise de dois ensaios aleatórios, controlados por placebo. Mol. Psychiatry 21, 1537. doi: 10.1038/mp.2015.221
PubMed Abstract | CrossRef Full Text | Google Scholar




