Inibição enzimática
Enzimas são necessárias para a maioria, se não para todos, os processos necessários para a vida. As enzimas catalisam uma reação reduzindo a energia de ativação necessária para que a reação ocorra. No entanto, as enzimas precisam ser reguladas de forma rigorosa para garantir que os níveis do produto não subam a níveis indesejáveis. Isto é conseguido pela inibição enzimática.
Tipos de Inibição
Inibidores reversíveis e irreversíveis são produtos químicos que se ligam a uma enzima para suprimir a sua actividade. Um método para conseguir isto é ligar-se quase permanentemente a uma enzima. Estes tipos de inibidores são chamados irreversíveis. Contudo, outros produtos químicos podem ligar-se transitoriamente a uma enzima. Estes são chamados de reversíveis. Os inibidores reversíveis ligam-se a um local ativo (inibidores competitivos), ou a outro local na enzima (inibidores não competitivos).
 Fig 1 – Diagrama para mostrar o efeito de inibidores competitivos e não competitivos da enzima.
Fig 1 – Diagrama para mostrar o efeito de inibidores competitivos e não competitivos da enzima.Inibidores competitivos
Inibidores competitivos competem com o substrato no local ativo, e portanto aumentam Km (a constante de Michaelis-Menten). No entanto, Vmax não se altera porque, com suficiente concentração do substrato, a reação ainda pode se completar. O gráfico da atividade enzimática contra a concentração do substrato seria deslocado para a direita devido ao aumento do Km, enquanto o gráfico Lineweaver-Burke seria mais inclinado quando comparado com nenhum inibidor.
Inibidores não-competitivos
Inibidores não-competitivos se ligam a outro local na enzima e como tal diminuem o VMAX. No entanto, o KM permanece inalterado. Isto é demonstrado por um máximo inferior em um gráfico plotting de atividade enzimática contra a concentração do substrato e um maior y-intercepção em um plotting de Lineweaver-Burke quando comparado com nenhum inibidor.
| Competitivo | Não-Competitivo | |
| Onde ele atua? | Active Site | Alternativo site |
| Mudança de Km | Increase | Não-Mudança |
| Mudança de Vmax | Não trocado | Diminuir |
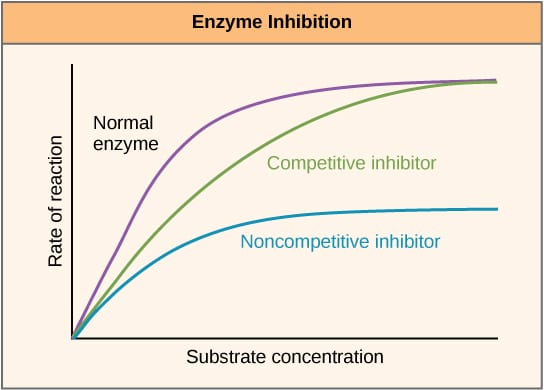 Fig 2 – Diagrama para mostrar o efeito dos inibidores enzimáticos na taxa de reacção e como esta varia com a concentração do substrato.
Fig 2 – Diagrama para mostrar o efeito dos inibidores enzimáticos na taxa de reacção e como esta varia com a concentração do substrato.Inibição alostérica
Enzimas alostéricas mostram uma curva sigmoidal em contraste com a curva hiperbólica exibida pelas Enzimas de Michaelis-Menten. Isto porque a maioria das enzimas alostóricas contém múltiplas subunidades que podem afetar umas às outras quando o substrato se liga à enzima. A inibição pode afectar quer o K0.5, que é a concentração do substrato para meia-saturação, Vmax ou ambos. Isto resulta em um deslocamento da curva para a direita, e no caso da redução de Vmax, desloca a curva para baixo.
As enzimas alostáticas têm dois estados: um estado de baixa afinidade dublado o estado “T” e o estado de alta afinidade “R”. Os inibidores funcionam ligando-se preferencialmente ao estado “T” de uma enzima alostérica, fazendo com que a enzima mantenha este estado de baixa afinidade.
Isso é extremamente útil para limitar a quantidade do produto de uma enzima, pois o produto pode então inibir o mesmo tipo de enzima para garantir que a quantidade do produto não seja excessiva. Isto é conhecido como inibição de feedback. Por exemplo, o ATP inibe alostericamente a kinase piruvada para evitar o aumento da formação de piruvato, de modo que menos ATP é eventualmente formado. Além disso, a fosfofructoquinase é inibida alostericamente pelo citrato, um intermediário do ciclo do Kreb. Isto significa que a glicólise será limitada quando houver alta geração de ATP do ciclo de Kreb.
 Fig 3 – Diagrama para mostrar o mecanismo tanto da inibição alostérica quanto da ativação.
Fig 3 – Diagrama para mostrar o mecanismo tanto da inibição alostérica quanto da ativação.Fosforilação
Fosforilação fornece outro mecanismo pelo qual as enzimas podem ser inibidas. Isto ocorre tipicamente através da acção das enzimas cinase, que podem inibir ou activar uma enzima, dependendo da situação. As enzimas cinase clivam um grupo fosfato de ATP e ligam-no à enzima. Em situações em que isso resulta em um aumento na atividade enzimática ela cria uma reação em cascata, permitindo que uma grande resposta seja gerada a partir de um pequeno estímulo.
Zymogens
Enzimas também podem ser secretadas em um estado inativo, que são chamadas de zymogens. Os zymogens são um mecanismo útil que permite que as enzimas sejam transportadas com segurança para diferentes locais, sem que a enzima se torne activa e desempenhe a sua função ao longo do caminho. Eles permanecem inativos devido a uma adição de aminoácidos na proteína. Portanto, para ativar um zimogênio, outra enzima deve clivar esses aminoácidos adicionais. Por exemplo, o quimotripsinogênio é sintetizado pelo pâncreas, mas é inativado e não consegue funcionar. Ao viajar para o intestino, outra enzima (tripsina) cliva os aminoácidos adicionais para produzir a forma ativada, chymotripsin.
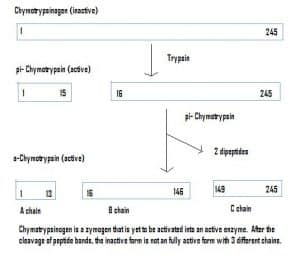 Fig 4 – Diagrama para mostrar a ativação do quimotripsinogênio dentro do sistema gastrointestinal e as enzimas envolvidas em cada estágio.
Fig 4 – Diagrama para mostrar a ativação do quimotripsinogênio dentro do sistema gastrointestinal e as enzimas envolvidas em cada estágio.Relevância Clínica – Farmacocinética
O uso clínico mais importante da inibição enzimática é o uso de drogas farmacêuticas. Os inibidores da ECA são um tratamento comum para a hipertensão. A Angiotensina I é convertida em Angiotensina II pela ação da enzima conversora de Angiotensina (ECA). No entanto, a Angiotensina II causa numerosos efeitos relacionados com um aumento da pressão arterial. Portanto, os inibidores da ECA foram projetados para inibir competitivamente a ação da ECA, o que resulta em menos formação de Angiotensina II e pressão arterial mais baixa.
Alternativamente, a Penicilina se liga irreversivelmente ao local ativo de uma enzima chamada DD-transpeptidase. A DD-transpeptidase é responsável pela etapa final da síntese da parede celular bacteriana. Ao inibir esta enzima, a bactéria não pode sintetizar uma parede celular e, portanto, não pode sustentar a vida.
Finalmente, o cianeto é um exemplo de um inibidor não competitivo. O cianeto liga-se à enzima final na cadeia de transporte de electrões e evita que esta enzima catalise a reacção do oxigénio à água. Isto impede o fluxo de electrões ao longo da cadeia de transporte de electrões e não pode ser gerado ATP, o que resulta em morte.




