3.3: Particule subatomice – Electroni, protoni și neutroni
Identificarea și localizarea particulelor subatomice
În 1897, fizicianul britanic J. J. Thomson (1856-1940) a demonstrat că atomii nu sunt cea mai elementară formă de materie. Experimentele sale au implicat utilizarea tuburilor catodice (CRT). Într-un mediu vidat, aceste dispozitive produc raze invizibile care pornesc de la un electrod negativ (catod) și continuă spre un electrod pozitiv (anod). În cadrul acestor experimente, Thomson a demonstrat că razele catodice pot fi deviate, sau îndoite, de câmpuri magnetice sau electrice, ceea ce indică faptul că razele catodice sunt formate din particule încărcate . Mai important, prin măsurarea gradului de deviere a razelor catodice în câmpuri magnetice sau electrice de diferite intensități, Thomson a putut calcula raportul dintre masa și sarcina particulelor. Deoarece sarcinile asemănătoare se resping între ele, iar sarcinile opuse se atrag, Thomson a concluzionat că particulele aveau o sarcină negativă netă; aceste particule se numesc acum electroni. Cel mai relevant pentru domeniul chimiei, Thomson a descoperit că raportul masă-încărcare a razelor catodice este independent de natura electrozilor metalici sau a gazului, ceea ce sugerează că electronii sunt componente fundamentale ale tuturor atomilor.
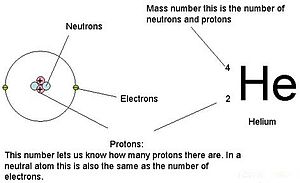
În anii 1910, experimentele cu raze X au dus la această concluzie utilă: magnitudinea sarcinii pozitive din nucleul fiecărui atom al unui anumit element este aceeași. Cu alte cuvinte, toți atomii aceluiași element au același număr de protoni. În plus, diferite elemente au un număr diferit de protoni în nucleul lor, astfel încât numărul de protoni din nucleul unui atom este caracteristic unui anumit element. Această descoperire a fost atât de importantă pentru înțelegerea noastră despre atomi, încât numărul de protoni din nucleul unui atom este numit număr atomic. Aceste experimente au fost efectuate de Ernest Rutherford. Lui i se atribuie meritul de a fi definit o locație centrală a atomului care a fost numită acum nucleu.
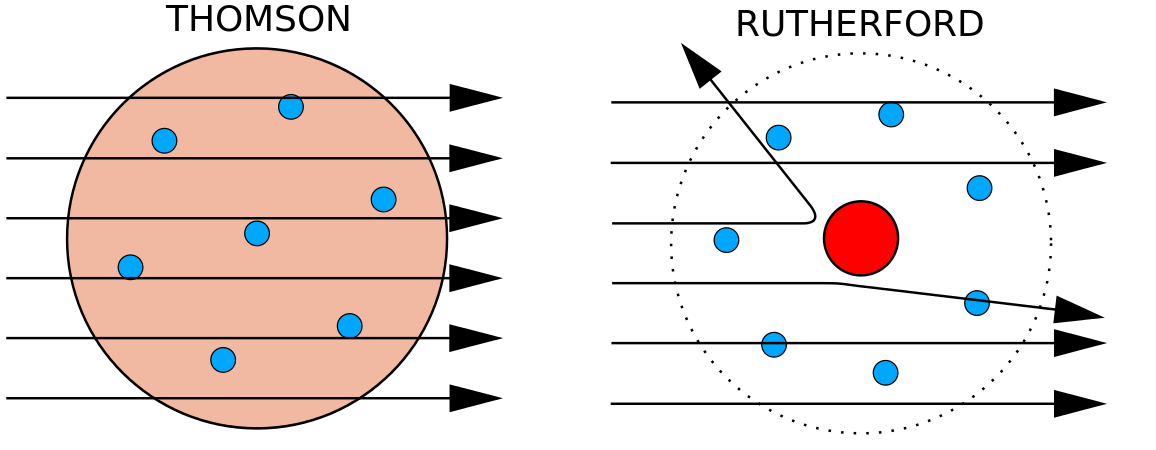
Rutherford era conștient de faptul că protonii se aflau în interiorul acestei regiuni. Unul dintre colegii lui Ernest Rutherford, James Chadwick, a efectuat și studiat reacțiile radioactive ale beriliului. La lovirea unui nucleu de beriliu cu particule alfa, a fost emisă o particulă de neutroni. În 1932, James Chadwick a anunțat existența unei a treia particule subatomice, neutronul. Această particulă are o masă de 1 unitate de masă atomică, dar nu are nicio sarcină. După această descoperire, știința și tehnologia nucleară au început imediat.
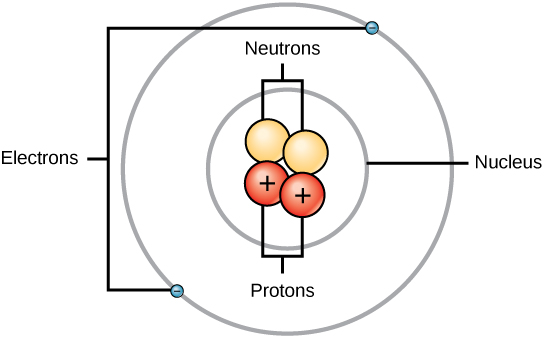
Masele pentru cele trei particule subatomice pot fi exprimate în amu (unități de masă atomică) sau grame. Pentru simplitate, vom folosi unitatea amu pentru cele trei subatomice. Atât neutronilor, cât și protonilor li se atribuie mase de 1 amu fiecare. În schimb, electronul are o masă neglijabilă de 0,0005 amu. Masa acestui subatomic nu este reprezentată în masa zecimală care este afișată în tabelul periodic. Doar protonii și neutronii contribuie la valoarea masei unui atom.
ro:User:Materialscientist)
Pentru atomi (specii neutre), numărul de electroni este echivalent cu numărul de protoni. Ca urmare, toți atomii au o sarcină totală egală cu zero. Pentru discuții despre ioni (atomi care câștigă sau pierd electroni), consultați ultima parte a acestui capitol. Atomii care diferă în valorile neutronilor și ale masei față de cele din tabel se numesc izotopi. Aceste specii particulare pot fi văzute în următoarea secțiune a textului.
| Particulă subatomică | Simbol | Carga relativă | Localizare | Masa AMU |
|---|---|---|---|---|
| Proton | p | +1 | în interiorul nucleului | 1 |
| Neutron | n | 0 | în interiorul nucleului | 1 |
| Electron | e- | -1 | în afara nucleului | 0.0005 (~0) |
Exemplu \(\PageIndex{1}\)
Ce este adevărat?
- Nucleul conține protoni și electroni.
- Masa unui electron este inclusă în masa atomului
- Pentru un atom, numărul de protoni = numărul de electroni.
Soluție
- Fals, nucleul conține protoni și neutroni. Electronii se află în afara nucleului.
- Fals, electronii nu contribuie la numărul de masă al unui atom.
- adevărat, toți atomii sunt neutri și trebuie să aibă același număr de protoni ca și de electroni.
.




