Care este diferența dintre legăturile ionice și covalente
Care bucățică de materie din jurul tău este ținută împreună de legături chimice. Uneori, legăturile chimice sunt rupte, cum ar fi în timpul unei reacții chimice, doar pentru ca atomii să se lege din nou pentru a forma molecule diferite. Energia este întotdeauna eliberată pentru a genera legături și, la fel, energia este întotdeauna necesară pentru a rupe legăturile.
Există două tipuri principale de legături chimice: ionice și covalente.
Ce sunt legăturile ionice și covalente?
Atomii se leagă între ei pentru a forma compuși deoarece, în acest fel, ei ating energii mai mici decât cele pe care le posedă ca atomi individuali, devenind mai stabili în acest proces. Prin legea conservării energiei, atunci când se formează o nouă legătură chimică, reacția chimică eliberează o cantitate de energie (de obicei sub formă de căldură) aproape egală cu diferența dintre cantitățile de energie chimică înmagazinată între produse și reactanți. Această energie chimică înmagazinată a sistemului, sau conținutul de căldură, este cunoscută sub numele de entalpia acestuia.
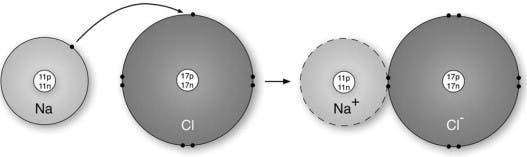
O legătură ionică se formează atunci când doi ioni cu sarcini opuse schimbă electroni între ei, unde un ion este un atom care a pierdut sau a câștigat un electron. Ionii care pierd unul sau mai mulți electroni au mai mulți protoni decât electroni, ceea ce înseamnă că au o sarcină pozitivă. Astfel de ioni se numesc cationi (metale). Pe de altă parte, câștigarea de electroni îi conferă ionului o sarcină negativă. Chimiștii se referă la astfel de ioni ca fiind anioni (nemetale).
Compușii ionici sunt de obicei neutri. Prin urmare, ionii se combină în moduri care le neutralizează sarcinile.
Un exemplu de manual al unui compus ionic este clorura de sodiu, cunoscută și sub numele de sare de masă. Un singur atom de sodiu are 11 protoni și 11 electroni, dar numai un singur electron în învelișul său exterior (sau învelișul de valență). Clorul este alcătuit din 17 protoni și 17 electroni și are 7 electroni în învelișul său exterior. Atunci când cei doi atomi reacționează, sodiul (electropozitiv) își pierde electronul de valență în favoarea clorului (electronegativ). Acum, în structura cristalină rezultată, fiecare ion de sodiu este înconjurat de șase ioni de clorură și fiecare ion de clorură este înconjurat de șase ioni de sodiu. Mai mult, fiecare ion are un înveliș electronic complet care corespunde celui mai apropiat gaz inert; neon pentru un ion de sodiu, argon pentru un ion de clorură
Legăturile covalente se formează atunci când atomii sau ionii împart electroni astfel încât învelișurile lor exterioare devin ocupate. Legăturile covalente, numite și legături moleculare, se formează numai între atomi nemetalici cu valoare de electronegativitate identică sau relativ apropiată. Electronegativitatea, notată cu simbolul χ, este o proprietate chimică ce descrie tendința unui atom de a atrage spre el o pereche de electroni comuni (sau densitatea de electroni).
Numărul de legături covalente pe care le poate forma un atom se numește valența atomului. Această proprietate reprezintă numărul de electroni ai unui atom care pot participa la formarea de legături chimice cu alți atomi. Aceștia sunt electronii cei mai îndepărtați de nucleu.
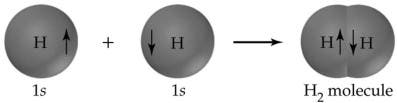
Un prim exemplu de legătură covalentă este molecula de hidrogen, care se formează din doi atomi de hidrogen, fiecare cu câte un electron în învelișul exterior. Formarea legăturii degajă căldură; prin urmare, este exotermă. Pentru molecula de hidrogen, căldura eliberată în timpul formării sale, cunoscută și sub numele de variația standard de entalpie (ΔH°), este de -435 kJ pe mol. Procesul invers, ruperea legăturii H-H, necesită 435 kJ pe mol, o cantitate numită rezistența legăturii.
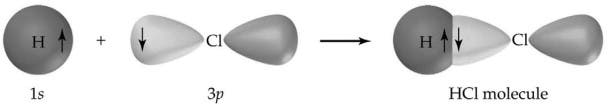
Un alt exemplu clasic de legătură covalentă este clorura de hidrogen (HCl), care este o halogenură de hidrogen. Atomul de clor are 7 atomi în învelișul său exterior, în timp ce hidrogenul are 1 electron în învelișul său exterior. Ambele se combină perfect, astfel încât fiecare atom își umple învelișurile de valență, formând o moleculă foarte stabilă. Acum, molecula de HCl nu va mai reacționa în continuare cu alți atomi de clor sau hidrogen.
Diferențe între legăturile ionice și covalente
- Legăturile covalente sunt mult mai frecvente în chimia organică decât legăturile ionice.
- În legăturile covalente, atomii împart electroni, în timp ce în legăturile ionice atomii transferă electroni.
- Componenții de reacție ai legăturilor covalente sunt neutri din punct de vedere electric, în timp ce pentru legăturile ionice sunt amândoi încărcați. Acest lucru explică de ce clorura de sodiu (sarea) conduce electricitatea atunci când este dizolvată – componentele sale sunt încărcate.
- Legăturile ionice sunt mult mai puternice decât legăturile covalente.
- Legăturile covalente sunt mult mai frecvente în natură decât legăturile ionice. De exemplu, majoritatea moleculelor din ființele vii sunt legate covalent.
- Legăturile covalente se pot forma între atomii acelorași elemente (de exemplu, H2). Cu toate acestea, legăturile ionice nu pot face acest lucru.
- Legăturile covalente se formează între două nemetale, în timp ce legăturile ionice se formează între un metal și un nemetal.
- Moleculele formate prin legături covalente au un punct de topire scăzut, în timp ce cele cu legături ionice au un punct de topire ridicat. Aceeași relație există și pentru punctul de fierbere.
- La temperatura camerei, moleculele cu legături covalente sunt, în marea majoritate a cazurilor, lichide sau gaze, în timp ce compușii ionici sunt solizi.
Similitudini între legăturile ionice și covalente
- Ambele tipuri de legături duc la formarea unor compuși chimici stabili.
- Este nevoie de reacții exotermice (adică care degajă căldură) pentru a crea legături ionice și covalente.
- Electronii de valență sunt implicați în ambele procese de legare.
- Nu contează dacă o moleculă este formată prin legături ionice sau covalente în ceea ce privește sarcina electrică: rezultatul este întotdeauna neutru din punct de vedere electric.
.




