Chimie
Formarea unei soluții este un exemplu de proces spontan, un proces care are loc în condiții specifice fără a fi nevoie de energie de la o sursă externă. Uneori agităm un amestec pentru a accelera procesul de dizolvare, dar acest lucru nu este necesar; o soluție omogenă s-ar forma dacă am aștepta suficient de mult timp. Subiectul spontaneității este extrem de important pentru studiul termodinamicii chimice și este tratat mai amănunțit într-un capitol ulterior al acestui text. În scopul discuției din acest capitol, va fi suficient să luăm în considerare două criterii care favorizează, dar nu garantează, formarea spontană a unei soluții:
- o scădere a energiei interne a sistemului (o schimbare exotermică, așa cum s-a discutat în capitolul anterior despre termochimie)
- o creștere a dezordinii din sistem (ceea ce indică o creștere a entropiei sistemului, așa cum veți afla în capitolul următor despre termodinamică)
În procesul de dizolvare, o schimbare a energiei interne are loc adesea, dar nu întotdeauna, pe măsură ce se absoarbe sau se degajă căldură. O creștere a dezordinii rezultă întotdeauna atunci când se formează o soluție.
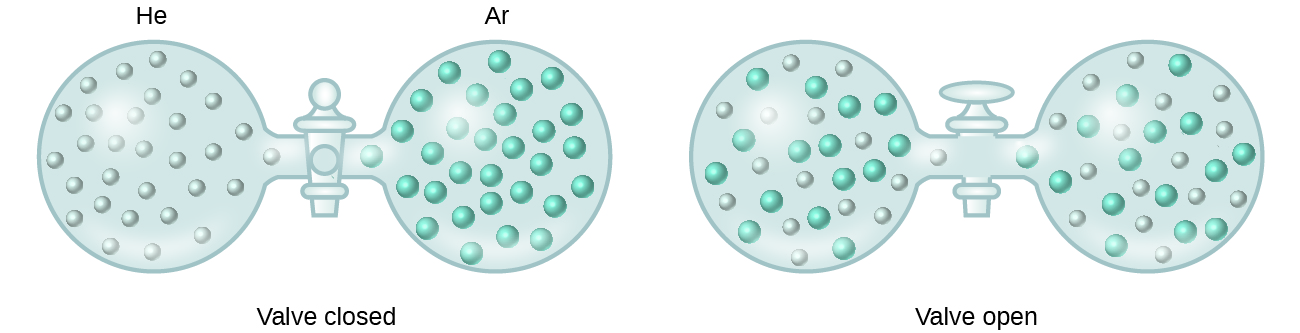
Când intensitățile forțelor de atracție intermoleculare dintre speciile de solut și solvent într-o soluție nu sunt diferite de cele prezente în componentele separate, soluția se formează fără nicio schimbare de energie însoțitoare. O astfel de soluție se numește soluție ideală. Un amestec de gaze ideale (sau gaze precum heliul și argonul, care se apropie foarte mult de comportamentul ideal) este un exemplu de soluție ideală, deoarece entitățile care compun aceste gaze nu experimentează atracții intermoleculare semnificative.
Când recipientele de heliu și argon sunt conectate, gazele se amestecă spontan datorită difuziunii și formează o soluție (figura 2). Formarea acestei soluții implică în mod clar o creștere a dezordinii, deoarece atomii de heliu și de argon ocupă un volum de două ori mai mare decât cel pe care fiecare îl ocupa înainte de amestecare.
Soluții ideale se pot forma și atunci când se amestecă lichide similare din punct de vedere structural. De exemplu, amestecurile de alcooli metanol (CH3OH) și etanol (C2H5OH) formează soluții ideale, la fel ca și amestecurile de hidrocarburi pentan, C5H12, și hexan, C6H14. Plasarea metanolului și a etanolului, sau a pentanului și a hexanului, în bulbii prezentați în figura 2 va avea ca rezultat aceeași difuzie și amestecare ulterioară a acestor lichide ca și cea observată pentru gazele He și Ar (deși cu o viteză mult mai mică), producând soluții fără modificări semnificative ale energiei. Totuși, spre deosebire de un amestec de gaze, componentele acestor soluții lichid-lichid cunosc, într-adevăr, forțe de atracție intermoleculare. Dar, deoarece moleculele celor două substanțe care se amestecă sunt foarte asemănătoare din punct de vedere structural, forțele de atracție intermoleculare dintre moleculele asemănătoare și cele diferite sunt în esență aceleași și, prin urmare, procesul de dizolvare nu implică o creștere sau o scădere apreciabilă a energiei. Aceste exemple ilustrează modul în care difuzia singură poate furniza forța motrice necesară pentru a determina formarea spontană a unei soluții. Cu toate acestea, în unele cazuri, mărimile relative ale forțelor de atracție intermoleculare dintre speciile de solut și solvent pot împiedica dizolvarea.
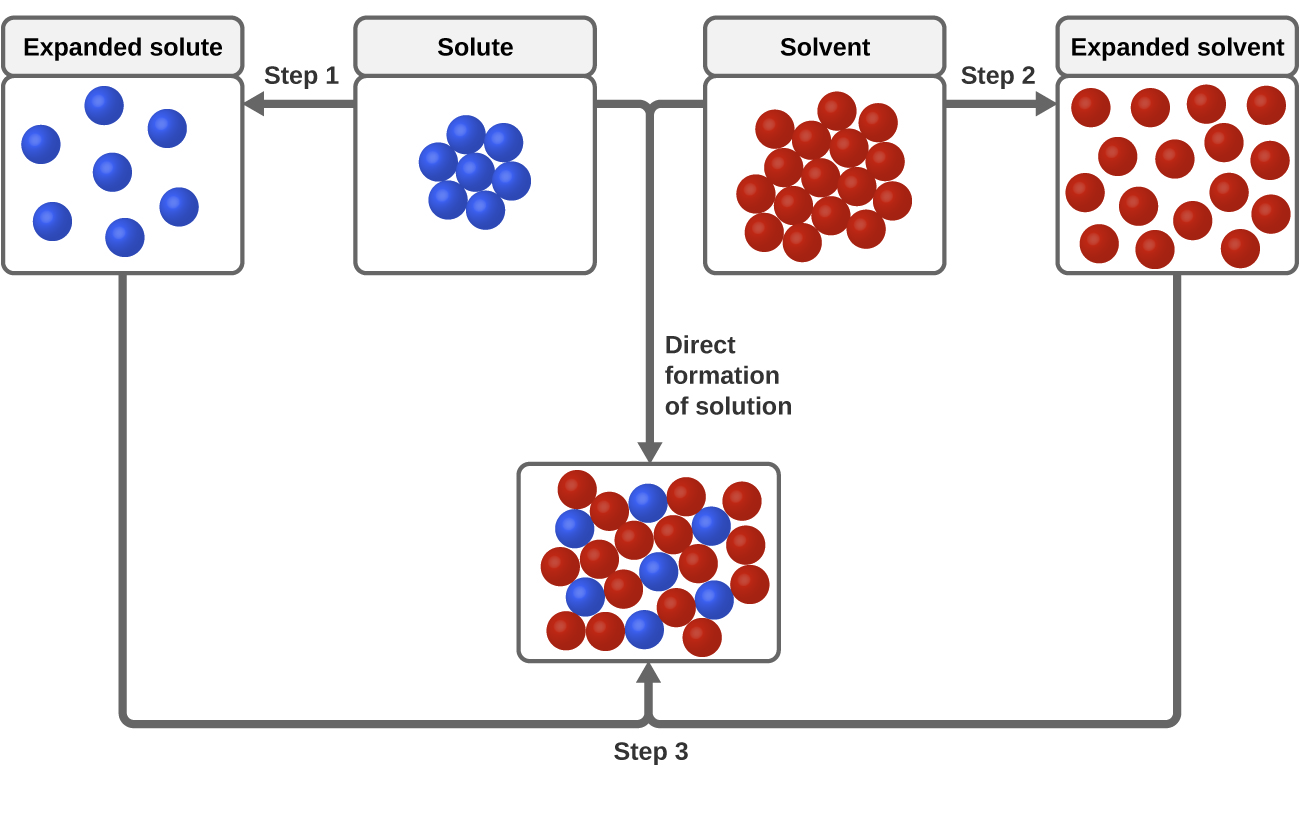
Trei tipuri de forțe de atracție intermoleculare sunt relevante pentru procesul de dizolvare: solut-solut, solvent-solvent și solut-solvent. Așa cum este ilustrat în figura 3, formarea unei soluții poate fi privită ca un proces în trepte, în care energia este consumată pentru a depăși atracțiile solut-solut și solvent-solvent (procese endotermice) și eliberată atunci când se stabilesc atracțiile solut-solvent (un proces exotermic denumit solvatare). Mărimile relative ale schimbărilor de energie asociate cu aceste procese etapizate determină dacă procesul de dizolvare în ansamblu va elibera sau va absorbi energie. În unele cazuri, soluțiile nu se formează deoarece energia necesară pentru a separa speciile de solut și solvent este mult mai mare decât energia eliberată prin solvatare.
De exemplu, uleiurile de gătit și apa nu se vor amesteca într-o măsură apreciabilă pentru a produce soluții (figura 4). Legătura de hidrogen este forța de atracție intermoleculară dominantă prezentă în apa lichidă; moleculele de hidrocarburi nepolare din uleiurile de gătit nu sunt capabile de legături de hidrogen, fiind în schimb ținute împreună de forțele de dispersie. Formarea unei soluții ulei-apă ar necesita depășirea legăturii de hidrogen foarte puternice din apă, precum și a forțelor de dispersie semnificativ de puternice dintre moleculele relativ mari de ulei. Și, din moment ce moleculele polare de apă și moleculele nepolare de ulei nu ar experimenta o atracție intermoleculară foarte puternică, foarte puțină energie ar fi eliberată prin solvatare.

Pe de altă parte, un amestec de etanol și apă se va amesteca în orice proporție pentru a da o soluție. În acest caz, ambele substanțe sunt capabile de legături de hidrogen și, astfel, procesul de solvatare este suficient de exotermic pentru a compensa separările endotermice ale moleculelor de solut și solvent.
După cum s-a menționat la începutul acestui modul, formarea spontană a soluțiilor este favorizată, dar nu garantată, de procesele exotermice de dizolvare. În timp ce mulți compuși solubili se dizolvă, într-adevăr, cu degajare de căldură, unii se dizolvă endotermic. Nitratul de amoniu (NH4NO3) este un astfel de exemplu și este utilizat pentru a face comprese reci instantanee pentru tratarea rănilor, precum cea ilustrată în figura 5. O pungă de plastic cu pereți subțiri de apă este sigilată în interiorul unei pungi mai mari cu NH4NO3 solid. Când punga mai mică este spartă, se formează o soluție de NH4NO3, care absoarbe căldura din mediul înconjurător (zona rănită pe care se aplică compresa) și oferă o compresă rece care diminuează umflarea. Dizolvările endotermice, cum este aceasta, necesită un aport energetic mai mare pentru a separa speciile de solut decât cel recuperat atunci când soluții sunt dizolvați, dar sunt totuși spontane datorită creșterii dezordinii care însoțește formarea soluției.


Vizionați acest scurt videoclip care ilustrează procesele de dizolvare endotermică și exotermică.
Concepte cheie și rezumat
O soluție se formează atunci când două sau mai multe substanțe se combină fizic pentru a da naștere unui amestec omogen la nivel molecular. Solventul este componenta cea mai concentrată și determină starea fizică a soluției. Soluții sunt celelalte componente prezente, de obicei, la concentrații mai mici decât cea a solventului. Soluțiile se pot forma endotermic sau exotermic, în funcție de mărimile relative ale forțelor de atracție intermoleculare ale solutului și ale solventului. Soluțiile ideale se formează fără o schimbare apreciabilă de energie.
Chimie Exerciții de sfârșit de capitol
- În ce se deosebesc soluțiile de compuși? De alte amestecuri?
- Ce caracteristici principale ale soluțiilor putem observa în soluțiile de K2Cr2O7 prezentate în figura 1?
- Când KNO3 este dizolvat în apă, soluția rezultată este semnificativ mai rece decât era apa inițial.
(a) Este dizolvarea KNO3 un proces endotermic sau exotermic?
(b) Ce concluzii puteți trage cu privire la atracțiile intermoleculare implicate în acest proces?
(c) Este soluția rezultată o soluție ideală?
- Dați câte un exemplu pentru fiecare dintre următoarele tipuri de soluții:
(a) un gaz într-un lichid
(b) un gaz într-un gaz
(c) un solid într-un solid
- Indicați cele mai importante tipuri de atracții intermoleculare în fiecare dintre următoarele soluții:
(a) Soluția din figura 1.
(b) NO(l) în CO(l)
(c) Cl2(g) în Br2(l)
(d) HCl(aq) în benzen C6H6(l)
(e) Metanolul CH3OH(l) în H2O(l)
.
- Precizați dacă fiecare dintre următoarele substanțe ar fi mai solubilă în apă (solvent polar) sau într-o hidrocarbură cum ar fi heptanul (C7H16, solvent nepolar):
(a) uleiul vegetal (nepolar)
(b) alcoolul izopropilic (polar)
(c) bromura de potasiu (ionic)
- Căldura este eliberată atunci când se formează unele soluții; căldura este absorbită atunci când se formează alte soluții. Oferiți o explicație moleculară pentru diferența dintre aceste două tipuri de procese spontane.
- Soluțiile de hidrogen în paladiu se pot forma prin expunerea metalului Pd la gaz H2. Concentrația de hidrogen în paladiu depinde de presiunea gazului H2 aplicată, dar într-un mod mai complex decât poate fi descrisă de legea lui Henry. În anumite condiții, 0,94 g de hidrogen gazos se dizolvă în 215 g de paladiu metalic.
(a) Determinați molaritatea acestei soluții (densitatea soluției = 1,8 g/cm3).
(b) Determinați molalitatea acestei soluții (densitatea soluției = 1,8 g/cm3).
(c) Determinați procentul în masă al atomilor de hidrogen din această soluție (densitatea soluției = 1,8 g/cm3).
.




