Frontiere în oncologie
Introducere
Glioblastomul și astrocitomul anaplazic (ANA) sunt două dintre cele mai frecvente tumori cerebrale primare la adulți (1). Există o adevărată creștere a ratelor de incidență, în special la vârstnici (1-3). În practica clinică, este dificil de diferențiat pacienții cu glioblastom de cei cu ANA înainte de operație sau biopsie, deoarece simptomele și semnele celor două tumori sunt relativ uniforme și nespecifice (4, 5). Cu toate acestea, managementul pentru acestea este diferit, cum ar fi protocolul de chimioterapie, doza și modul de administrare (6). De exemplu, pentru pacienții cu ANA (gradul III OMS), se recomandă radioterapie sau TMZ după rezecție sau biopsie; în timp ce pentru pacienții nou diagnosticați cu glioblastom (gradul IV OMS), este vorba de radioterapie plus TMZ concomitent, urmată de TMZ adjuvant. Conform studiilor anterioare, glioblastomul și ANA se dezvoltă prin invazie în țesutul cerebral normal, se răspândesc prin lichidul cefalorahidian (LCR) și se extind dincolo de o singură distribuție a arterei carotide sau vertebrale, astfel că ambele au un răspuns slab la managementul medical și devin principalele cauze de deces legate de cancer la adulți (7, 8). În plus, prognosticul glioblastomului și al ANA sunt diferite. La populația vârstnică, nu există o diferență semnificativă în ceea ce privește prognosticul între glioblastom și ANA, dar diferența poate exista la populația mai tânără (9). Prin urmare, este dificil, dar crucial să se facă distincția între glioblastom și ANA.
Imagistica prin rezonanță magnetică (IRM) este neuroimagistica optimă în diagnosticul preoperator al glioblastomului și ANA pentru capacitatea sa multiplanară și contrastul superior al țesuturilor moi. Deși unele studii au demonstrat că prezența intensificării de tip inelar și a necrozei era sugestivă pentru glioblastom, în majoritatea cazurilor, atât glioblastomul, cât și ANA apar ca forme neregulate pe imaginile RM (hiperdense pe secvența ponderată în T2 și hipodense pe secvența ponderată în T1), cu un grad diferit de intensificare a contrastului pe bază de Gd și edem, ale căror diferențe erau de obicei imperceptibile pentru ochiul uman (10-12).
Recent, analiza texturii (TA), cunoscută și sub numele de radiomică, a fost aplicată pe scară largă în diferite domenii. Cercetătorii au constatat că AT este o metodă fezabilă și promițătoare pentru a facilita diagnosticul diferențial, deoarece a permis dobândirea de informații cantitative suplimentare din imaginile RM, care erau invizibile pentru evaluarea umană (13-15). TA descrie distribuția de frecvență și organizarea spațială a valorii voxelului pentru a dezvălui posibilele diferențe în țesutul tumoral (16). Studii anterioare au explorat fezabilitatea aplicării TA în diagnosticul diferențial, clasificarea subtipurilor de tumori și detectarea eterogenității țesutului tumoral (17-19). După știința noastră, aplicarea TA în diagnosticul diferențial între glioblastom și ANA nu a fost încă raportată. Scopul acestui studiu a fost de a evalua capacitatea de discriminare a analizei texturii IRM utilizând algoritmi de învățare automată pentru a diferenția glioblastomul și ANA.
Materiale și metode
Selecția pacienților
Am căutat retrospectiv în baza de date a instituției noastre și am examinat toți pacienții diagnosticați histopatologic ca glioblastom sau ANA, din ianuarie 2015 până în decembrie 2018. Criteriile de eligibilitate pentru pacienții calificați au fost: (1) diagnostic histopatologic concludent de glioblastom sau ANA; (2) fișe medicale electronice elaborate, în special material patologic; (3) RMN de diagnosticare la instituția noastră înainte de rezecția chirurgicală. Criteriile de excludere au fost: (1) antecedente de boală intracraniană (de exemplu, traumatism cerebral, infecție intracraniană sau alte tipuri de tumori cerebrale), având în vedere interferența țesutului cicatricial asupra intensității imaginilor; (2) prezența artefactelor de mișcare la RMN; (3) antecedente de tratamente înainte de RMN (de exemplu, intervenție chirurgicală, chimioterapie sau radioterapie); (4) pacienți care nu au îndeplinit criteriile de diagnosticare a glioblastomului sau ANA conform sistemului de clasificare al OMS din 2016. Un neuropatolog senior cu o experiență de 10 ani a judecat dacă pacientul îndeplinea criteriile (sistemul de clasificare OMS 2016) pentru glioblastom sau ANA. Consiliul de revizuire instituțională a aprobat acest studiu retrospectiv. Consimțământul informat în scris a fost obținut de la participanții înrolați în acest studiu. Comitetul de etică al Universității Sichuan și departamentul de radiologie al instituției noastre au aprobat utilizarea statisticilor pentru acest studiu.
Achiziționarea imaginilor RM
Pentru toți pacienții incluși în acest studiu, au fost disponibile secvențe ponderate T1 cu contrast și au fost obținute pe 3.0T Siemens Trio Scanner cu următorii parametri: TR/TE/TI = 1900/2,26/900 ms, unghi Flip = 9 °, 20 de felii axiale cu grosimea = 5 mm, FOV axial = 25,6 × 25,6 cm2 și matrice de date = 256 × 256. Imagistica ponderată T1 cu contrast a folosit gadopentetat dimeglumină (0,1 mmol/Kg) a fost agentul de contrast pentru imaginea cu contrast, iar datele multidirecționale ale RMN-ului cu contrast au fost colectate în timpul intervalului de timp continuu de 90-250 s.
Extragerea texturii
În studiul nostru, pachetul LifeX (http://www.lifexsoft.org) a fost folosit pentru a extrage caracteristicile texturii. Imaginile ponderate cu contrast T1 (T1C) post-contrast au fost selectate pentru o analiză ulterioară datorită reprezentării clare a localizării și marginii tumorii (20). Regiunea de interes (ROI) a fost trasată manual felie cu felie în planul axial de-a lungul leziunilor pe imaginile cu contrast pentru a obține caracteristici de textură. Doi neurochirurgi experimentați, nevăzători față de fișele medicale ale pacienților și față de diagnosticul histopatologic, au trasat ROI, urmată de editarea de către un radiolog senior și un neurochirurg senior. Dezacordurile au fost soluționate prin discuții și consultări cu radiologul senior și cu neurochirurgul senior. Un total de 40 de caracteristici de textură au fost extrase din imaginile RMN, inclusiv minValue, meanValue, maxValue, stdValue și parametrii derivați din șase matrici: Matrice bazată pe histograme (HISTO), Shape, Gray-level co-occurrence matrix (GLCM), Gray-level run length matrix (GLRLM), Gray-level zone length matrix (GLZLM) și Neighborhood gray-level dependence matrix (NGLDM).
Selecția caracteristicilor
Au fost 40 de caracteristici de textură în total derivate din șase matrici selectate. Explicația celor 40 de caracteristici de textură a fost prezentată în tabelul suplimentar 1. Statisticile acestor caracteristici de textură au fost prezentate în tabelul suplimentar 2. Selecția caracteristicilor a fost efectuată pentru a determina caracteristicile relevante și, astfel, pentru a evita supraadaptarea. În plus, algoritmul de învățare automată aplicat în acest studiu nu a putut lua în analiză toate cele 40 de caracteristici de textură. Trei metode independente de selecție a caracteristicilor au fost utilizate pentru a selecta caracteristicile optime de textură, inclusiv corelația de distanță, cel mai mic operator de contracție absolută și selecție (LASSO) și arborele de decizie de corelație în gradient (GBDT). S-au format astfel trei subseturi de caracteristici de textură, care au constituit trei seturi de date diferite.
Clasificare
Analiza discriminantă liniară (LDA) este o metodă de clasificare robustă pentru a separa două clase prin căutarea combinației liniare de predictori care maximizează separarea între grupuri. În acest studiu, au fost stabilite trei modele de clasificare pe baza algoritmului LDA: Corelație de distanță + LDA, LASSO + LDA și GBDT + LDA. Seturile de date au fost introduse în algoritmul LDA, respectiv, și independent. Fiecare set de date a fost împărțit în mod aleatoriu în grupul de instruire și grupul de validare în proporție de 4:1. Modelul instruit de grupul de instruire a fost apoi aplicat la grupul de validare independent pentru a evalua performanța acestuia. Pentru a evalua robustețea algoritmului LDA, procedura a fost repetată timp de 100 de cicluri cu atribuiri de cazuri diferite, aleatorii și independente. A fost determinată o matrice de confuzie folosind atribuirea reală din histopatologie și predicțiile algoritmului LDA. Sensibilitatea standard, specificitatea, ariile de sub curba caracteristică de funcționare a receptorului (AUC) și precizia au fost calculate atât pentru grupul de instruire, cât și pentru grupul de validare pentru a dezvălui capacitatea de discriminare a modelelor. Comparația a trei modele (Distance Correlation + LDA, LASSO + LDA și GBDT + LDA) a fost efectuată pentru a determina modelul discriminatoriu optim pentru glioblastom și ANA. Diagrama de flux a clasificării RMN prin caracteristici de textură este prezentată în figura 1.
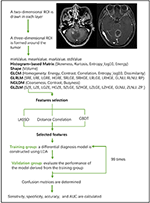
Figura 1. Diagrama de flux a clasificării RMN prin caracteristici de textură. ANA, astrocitom anaplazic; LDA, analiză discriminantă liniară; IRM, imagistică prin rezonanță magnetică; LASSO, operator de micșorare și selecție cel mai puțin absolută; GBDT, arbore de decizie cu corelație de gradient; HISTO, matrice bazată pe histograme; GLCM, matrice de co-ocurență la nivel de gri; GLRLM, matrice de lungime de cursă la nivel de gri; GLZLM, matrice de lungime de zonă la nivel de gri; NGLDM, matrice de dependență la nivel de gri de vecinătate; AUC, aria sub curba caracteristică de funcționare a receptorului.
Rezultate
Caracteristicile pacienților
Un total de 133 de pacienți cu glioblastom (n = 76) sau ANA (n = 57) au îndeplinit criteriile de includere. Toți pacienții cu glioblastom au fost înrolați în acest studiu, în timp ce 10 pacienți cu ANA au fost excluși în conformitate cu criteriile de excludere. În cele din urmă, 76 de pacienți cu glioblastom și 46 de pacienți cu ANA au fost incluși în acest studiu. Vârstele medii ale pacienților au fost de 46,9 (15-67) și, respectiv, 40,0 (7-69). Toți pacienții au fost supuși rezecției chirurgicale a tumorii în departamentul nostru de neurochirurgie din 2015 până în 2018. Figura 2 prezintă două cazuri din planul axial al imaginilor cu contrast la pacienții cu glioblastom și ANA.
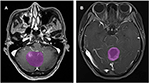
Figura 2. Exemple de două cazuri din imaginile RM cu substanță de contrast la pacienții cu glioblastom și ANA. (A) Imagini cu evidențiere a contrastului cu ANA, (B) imagini cu evidențiere a contrastului cu glioblastom. ANA, astrocitom anaplastic.
Glioblastom vs. ANA
În acest studiu au fost analizate trei modele, inclusiv Distance Correlation + LDA, LASSO + LDA, GBDT + LDA. Caracteristicile de textură utilizate pentru clasificare în aceste modele au fost prezentate în Tabelul suplimentar 3. Performanța fiecărui model a fost prezentată în tabelul 1 (inclusiv sensibilitatea, specificitatea, acuratețea și AUC a grupului de instruire și a grupului de validare). LASSO + LDA a obținut cea mai bună performanță, cu cele mai mari AUC atât în grupul de instruire, cât și în cel de validare. Sensibilitatea, specificitatea, acuratețea și AUC pentru grupul său de formare au fost de 0,989, 0,993, 0,996 și, respectiv, 0,997; iar pentru grupul de validare, acestea au fost de 0,927, 0,989, 0,968 și, respectiv, 0,974. În plus, Corelația de distanță + LDA și GBDT + LDA au arătat, de asemenea, o capacitate promițătoare de a discrimina glioblastomul de ANA, cu AUC ≥0,95 atât pentru grupurile de formare, cât și pentru grupurile de validare.

Tabelul 1. Discriminarea între glioblastom și ANA.
Figura 3 prezintă relația dintre funcțiile canonice de discriminare din modelele LASSO + LDA pentru grupurile de glioblastom și ANA (triunghiuri și cercuri) și pentru centroizii grupurilor (pătrate). În această figură s-a observat o suprapunere minimă. Din punct de vedere calitativ, analiza datelor selectate de LASSO a putut separa glioblastomul de ANA. Figura 4 prezintă distribuția funcției LDA directe determinate pentru glioblastom și ANA pentru unul dintre cele 100 de cicluri de instruire independente din analiza datelor pentru a ilustra performanța modelului LASSO + LDA. Au existat deplasări clare ale valorilor funcției LDA, cu deplasare spre stânga pentru ANA și spre dreapta pentru glioblastom.
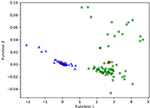
Figura 3. Relația dintre funcțiile discriminante canonice din modelele LASSO + LDA pentru grupurile glioblastom și ANA (triunghiuri și cercuri) și pentru centroizii grupurilor (pătrate). În această figură s-a observat o suprapunere minimă. Din punct de vedere calitativ, analiza datelor selectate de LASSO a putut separa glioblastomul de ANA. LASSO, operator de micșorare și selectare minimă absolută; LDA, analiză discriminantă liniară; ANA, astrocitom anaplazic.
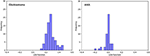
Figura 4. Distribuția funcției LDA directe determinate pentru glioblastom și ANA pentru unul dintre cele 100 de cicluri de instruire independente din analiza datelor pentru a ilustra performanța modelului LASSO + LDA. Au existat deplasări clare ale valorilor funcției LDA, cu deplasare spre stânga pentru ANA și spre dreapta pentru glioblastom. Se observă o suprapunere minimă între cele două grupuri și o similitudine calitativă puternică este evidentă între graficele pentru cicluri și triunghiuri. LDA, analiză discriminantă liniară; ANA, astrocitom anaplazic; LASSO, cel mai mic operator absolut de contracție și selecție.
Discuție
Diagnosticul diferențial înainte de tratament între glioblastom și ANA este important având în vedere diferența semnificativă în strategia de tratament și prognosticul pacienților. Rezonanța magnetică, principalul examen radiologic preoperator pentru tumorile cerebrale, este foarte recomandată, având în vedere sensibilitatea bună în detectarea leziunilor. Cu toate acestea, diagnosticul precis înainte de operație este încă o provocare din motivul că ambele tumori prezintă caracteristici similare pe imaginile RM convenționale, care sunt dincolo de evaluarea cu ochiul liber al omului (4, 5). În acest studiu, am extras caracteristici de textură care fac o descriere cantitativă a imaginilor pentru a maximiza utilizarea examinării RM, cu care au fost stabilite trei modele bazate pe LDA. Rezultatele au demonstrat că analiza texturii bazată pe IRM, combinată cu algoritmul LDA, ar putea permite diferențierea fezabilă între glioblastom și ANA.
TA este o abordare matematică pentru a caracteriza eterogenitatea valorii voxelului pe imagini. Aceasta ar putea vizualiza eterogenitatea histologică spațială care este invizibilă pentru evaluarea ochiului uman (21). Teoretic, caracteristicile imaginilor de leziuni ar putea fi analizate cantitativ ca trăsături de textură datorită modelelor lor diferite îmbunătățite pe imaginile RM (22). Mai mult decât atât, studiile anterioare au sugerat că trăsăturile de textură ar putea reflecta o serie de procese patologice anormale ale tumorii, cum ar fi edemul, efuzia și necroza, oferind un mecanism potențial pentru trăsăturile de textură în discriminarea glioblastomului de ANA (23, 24).
Inteligența artificială a fost explorată pe scară largă în cercetările recente. Combinată cu caracteristicile de textură extrase din imagini, a fost raportată pentru a ajuta la clasificarea tumorii, diagnosticul clinic și predicția rezultatelor. Un studiu care a avut ca scop evaluarea performanței de diagnosticare a algoritmilor de învățare automată pe bază de TA în diferențierea PCNSL de glioblastom a prezentat o performanță optimă cu AUC medie de 0,921, în timp ce AUC a trei cititori au fost toate <0,8. Astfel, cercetătorii au concluzionat că performanța de diagnosticare a algoritmilor de învățare automată bazată pe AT a fost superioară celei a cititorilor umani (25). Alte studii cu scop similar au demonstrat, de asemenea, rezultate similare, cu AUC-uri mai mari de 0,85 (18, 26). Mai mult, cercetătorii care urmăreau să aplice învățarea automată în clasificarea astrocitomului au raportat, de asemenea, o capacitate promițătoare de discriminare (27). În studiul nostru, modelele de clasificare au fost stabilite pe baza algoritmilor LDA. LDA este clasificatorul statistic care combină parametrii introduși într-o funcție discriminantă pentru a clasifica cazurile în diferite grupuri (28). Rezultatele noastre au demonstrat că modelul bazat pe LDA a reprezentat o performanță promițătoare în diagnosticarea precisă între glioblastom și ANA.
Adoptarea caracteristicilor optime pentru algoritmii de învățare automată a fost o provocare, dar a fost necesară în raport cu performanța de diagnosticare. Studiile anterioare realizează selecția caracteristicilor cu metode variate: Testul Mann-Whitney U cu AUC al ROC, testul t al lui Student cu eliminarea recursivă a caracteristicilor, pădurea aleatorie și, respectiv, discretizarea bazată pe entropie (18, 25, 29, 30). Pe baza rezultatelor acestor studii, am putea trage concluzia că metoda de selecție adecvată joacă un rol esențial în performanța clasificatorului. În ceea ce privește studiul nostru, un număr relativ mare de parametri au fost extrași din diferite matrici, ceea ce a crescut șansa de a selecta caracteristicile optime, dar și dificultatea de selecție. Prin urmare, au fost evaluate trei metode de selectare a caracteristicilor (Distance Correlation, LASSO și GBDT) pentru a o selecta pe cea cu cea mai bună performanță. Rezultatele acestui studiu au demonstrat că LASSO+LDA a fost modelul de discriminare adecvat pentru glioblastomul din ANA, cu cea mai mare AUC în grupul de testare de 0,997. LASSO a fost propus ca o metodă de selecție a variabilelor neliniare pentru rețeaua neuronală în studiul anterior, având avantajul de a minimiza suma comună a erorilor pătratice. Aceasta ar putea produce modele interpretabile (similare cu selecția subsetului) atunci când prezintă simultan stabilitatea regresiei ridge. Studiul anterior a ilustrat că a reprezentat o performanță superioară față de alte metode de selecție a variabilelor de ultimă generație (31). Cu toate acestea, trebuie să interpretăm cu atenție rezultatele conform cărora câștigul suplimentar de informații din compararea diferitelor tehnici de învățare automată este destul de limitat, în special având în vedere că toate metodele de clasificare/selectare a caracteristicilor investigate par să aibă performanțe destul de comparabile, iar variația în AUC poate fi atribuită parțial din cauza grupului statistic. Prin urmare, studiul nostru ar putea fi considerat doar ca o generare de ipoteze pentru studii viitoare, mai mari.
S-au înregistrat unele limitări ale studiului nostru. În primul rând, fiind un studiu retrospectiv cu un singur centru, părtinirea în selecția pacienților a fost inevitabilă. În al doilea rând, numărul de pacienți incluși a fost relativ mic și a fost necesar un număr mai mare de pacienți în studiile ulterioare pentru a valida rezultatele. În al treilea rând, ANA este acum împărțit în trei categorii în conformitate cu Clasificarea Organizației Mondiale a Sănătății din 2016 a tumorilor sistemului nervos central: IDH-mutant, IDH-tip sălbatic și NOS (32). Abilitatea învățării automate în discriminarea subtipurilor de ANA au fost necesare pentru a fi explorate în studiile viitoare. În al patrulea rând, modelele de învățare automată din studiul nostru nu au fost de fapt validate în alte seturi de date. Nu am adoptat alte seturi de date ale instituției deoarece acele caracteristici de textură ar putea fi diferite atunci când sunt extrase din imagini dobândite cu diverse scanere sau protocoale. Acest lucru ar putea fi privit ca o sabie cu două tăișuri. Pe de o parte, ar putea fi furnizat un set de variabile controlate; pe de altă parte, rezultatele nu ar putea fi garantate ca fiind aplicate pe scară largă. Protocolul de analiză și procedura de procesare a imaginilor au fost pachete open-source și este necesar un studiu cu o populație mare pentru a valida și reproduce rezultatele noastre.
Concluzie
În această lucrare, am extras parametrii cantitativi din imaginile RM cu contrast și am folosit trei metode de selectare a caracteristicilor pentru a selecta parametrii cei mai discriminanți. Apoi am aplicat algoritmul LDA pentru a analiza parametrii selectați. Studiul nostru arată că caracteristicile de textură au o capacitate promițătoare de a discrimina glioblastomul de ANA. Studiile multicentrice cu un număr mai mare de pacienți sunt justificate pentru a confirma acest rezultat preliminar.
Disponibilitatea datelor
Suntem încântați să împărtășim datele noastre oricărui cercetător calificat fără rezerve nejustificate. Vă rugăm să contactați autorul corespondent dacă au nevoie de ceva.
Declarație etică
Studiile care implică participanți umani au fost revizuite și aprobate de Comitetul de Etică al Universității Sichuan. Consimțământul în cunoștință de cauză scris pentru participarea la acest studiu a fost furnizat de către tutorele legal al participanților / rudele apropiate. Consimțământul în cunoștință de cauză în scris a fost obținut de la persoana (persoanele) și de la tutorele legal/primarul legal al minorului (minorilor), pentru publicarea oricăror imagini sau date potențial identificabile incluse în acest articol.
Contribuții ale autorilor
ZT, CC, JX și XM au contribuit la conceperea și proiectarea studiului. CC și XO au înrolat pacienții eligibili și au obținut fișele medicale și imaginile RMN ale fiecărui pacient. YF și ZT au făcut analiza texturii. JW a stabilit modelele și a efectuat alte analize statistice. ZT a scris prima versiune a manuscrisului. CC a scris secțiuni ale manuscrisului. Toți autorii au contribuit la revizuirea manuscrisului, au citit și au aprobat versiunea trimisă.
Declarație privind conflictul de interese
Autorii declară că cercetarea a fost efectuată în absența oricăror relații comerciale sau financiare care ar putea fi interpretate ca un potențial conflict de interese.
Material suplimentar
Materialul suplimentar pentru acest articol poate fi găsit online la adresa: https://www.frontiersin.org/articles/10.3389/fonc.2019.00876/full#supplementary-material
Abbreviații
ANA, astrocitom anaplazic; LDA, analiză discriminantă liniară; IRM, imagistică prin rezonanță magnetică; RM, rezonanță magnetică; LASSO, operator de micșorare și selecție cel mai mic absolut; GBDT, arbore de decizie cu corelație de gradient; LCR, lichid cefalorahidian; AT, analiză de textură; ROI, regiuni de interes; HISTO, Matrice bazată pe histograme; GLCM, Matrice de co-ocurență la nivel de gri; GLRLM, Matrice de lungime a traseului la nivel de gri; GLZLM, Matrice de lungime a zonei la nivel de gri; NGLDM, Matrice de dependență la nivel de gri de vecinătate; AUC, Aria sub curba caracteristică de funcționare a receptorului; PCNSL, Limfom primar al sistemului nervos central; MLP, Perceptron multistrat; IDH, Isocitrat dehidrogenază.
1. Torre LA, Bray F, Siegel RL, Ferlay J, Lortet-Tieulent J, Jemal A. Global cancer statistics, 2012. CA Cancer J Clin. (2015) 65:87-108. doi: 10.3322/caac.21262
PubMed Abstract | Full CrossRef Text | Google Scholar
2. Chen W, Zheng R, Baade PD, Zhang S, Zeng H, Bray F, et al. Statisticile privind cancerul în China, 2015. CA Cancer J Clin. (2016) 66:115-32. doi: 10.3322/caac.21338
PubMed Abstract | Full Text | Google Scholar
3. Wen PY, Kesari S. Malignant gliomas in adults. N Engl J Med. (2008) 359:492-507. doi: 10.1056/NEJMra0708126
PubMed Abstract | Publicitate | CrossRef Full Text | Google Scholar
4. Grimm SA, Chamberlain CM. Astrocitomul anaplastic. CNS Oncol. (2016) 5:145-57. doi: 10.2217/cns-2016-0002
PubMed Abstract | Refef Full Text | Google Scholar
5. Batash R, Asna N, Schaffer P, Francis N, Schaffer M. Glioblastomul multiform, diagnostic și tratament; revizuirea recentă a literaturii. Curr Med Chem. (2017) 24:3002-9. doi: 10.2174/09298673246661617051616123206
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Weller M, van den Bent M, Hopkins K, Tonn JC, Stupp R, Falini AE, et al. Ghidul EANO pentru diagnosticul și tratamentul gliomelor anaplastice și al glioblastomului. Lancet Oncol. (2014) 15:e395-403. doi: 10.1016/s1470-2045(14)70011-7
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Souhami L, Seiferheld W, Brachman D, Podgorsak EB, Werner-Wasik M, Lustig R, et al. Compararea randomizată a radiochirurgiei stereotactice urmată de radioterapie convențională cu carmustină cu radioterapia convențională cu carmustină pentru pacienții cu glioblastom multiform: raport al protocolului Radiation Therapy Oncology Group 93-05. Int J Radiat Oncol Biol Phys. 60:853-60. (2004) 60:853-60. doi: 10.1016/j.ijrobp.2004.04.011
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Burger PC, Heinz ER, Shibata T, Kleihues P. Anatomia topografică și corelațiile CT în glioblastomul multiform netratat. J Neurosurg. (1988) 68:698-704. doi: 10.3171/jns.1988.68.5.0698
PubMed Abstract | CrossRef Full Text | Google Scholar
9. Wick Wick, Platten M, Meisner C, Felsberg J, Tabatabai G, Simon M, et al. Chimioterapia cu temozolomidă singură versus radioterapia singură pentru astrocitomul malign la vârstnici: studiul randomizat NOA-08, studiu de fază 3. Lancet Oncol. (2012) 13:707-15. doi: 10.1016/s1470-2045(12)70164-x
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Chen W, Silverman HD. Progrese în evaluarea tumorilor cerebrale primare. Semin Nucl Med. (2008) 38:240-50. doi: 10.1053/j.semnuclmed.2008.02.005
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Burger PC, Vogel FS, Green SB, Strike AT. Glioblastomul multiform și astrocitomul anaplastic. Criterii patologice și implicații prognostice. Cancer. (1985) 56:1106-11.
PubMed Abstract | Google Scholar
12. Omuro A, DeAngelis ML. Glioblastomul și alte gliome maligne: o analiză clinică. JAMA. (2013) 310:1842-50. doi: 10.1001/jama.2013.280319
PubMed Abstract | Full CrossRef Text | Google Scholar
13. Lakhman Y, Veeraraghavan H, Chaim J, Feier D, Goldman DA, Moskowitz CS, et al. Diferențierea leiomiosarcomului uterin de leiomiomul atipic: acuratețea diagnostică a caracteristicilor calitative ale imagisticii RM și fezabilitatea analizei texturii. Eur Radiol. (2017) 27:2903-15. doi: 10.1007/s00330-016-4623-9
PubMed Abstract | Full CrossRef Text | Google Scholar
14. Skogen K, Schulz A, Schulz A, Dormagen JB, Ganeshan B, Helseth E, Server A. Performanța de diagnosticare a analizei texturii pe RMN în clasificarea gliomelor cerebrale. Eur J Radiol. (2016) 85:824-9. doi: 10.1016/j.ejrad.2016.01.013
PubMed Abstract | CrossRef Full Text | Google Scholar
15. Gibbs P, Turnbull WL. Analiza texturală a imaginilor RM îmbunătățite cu contrast ale sânului. Magn Reson Med. (2003) 50:92-8. doi: 10.1002/mrm.10496
PubMed Abstract | Full CrossRef Text | Google Scholar
16. Castellano G, Bonilha L, Li LM, Cendes F. Texture analysis of medical images. Clin Radiol. (2004) 59:1061-9. doi: 10.1016/j.crad.2004.07.008
PubMed Abstract | Reflect Full Text | Google Scholar
17. Davnall F, Yip CS, Ljungqvist G, Selmi M, Ng F, Sanghera B, et al. Evaluarea heterogenității tumorale: un instrument imagistic emergent pentru practica clinică? Insights Imaging. (2012) 3:573-89. doi: 10.1007/s13244-012-0196-6
PubMed Abstract | Reflect Full Text | Google Scholar
18. Xiao DD, Yan PF, Wang YX, Osman MS, Zhao YH. Glioblastomul și limfomul primar al sistemului nervos central: diferențiere preoperatorie prin utilizarea analizei texturii 3D bazate pe RMN. Clin Neurol Neurosurg. (2018) 173:84-90. doi: 10.1016/j.clineuro.2018.08.004
PubMed Abstract | CrossRef Full Text | Google Scholar
19. Itakura H, Achrol AS, Mitchell LA, Loya JJ, Liu T, Westbroek EM, et al. Caracteristicile imaginii de rezonanță magnetică identifică subtipuri fenotipice de glioblastom cu activități distincte ale căilor moleculare. Sci Transl Med. (2015) 7:303ra138. doi: 10.1126/scitranslmed.aaa7582
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Nioche C, Orlhac F, Boughdad S, Reuze S, Goya-Outi J, Robert C, et al. LIFEx: un freeware pentru calculul caracteristicilor radiomice în imagistica multimodală pentru accelerarea progreselor în caracterizarea eterogenității tumorale. Cancer Res. (2018) 78:4786-9. doi: 10.1158/0008-5472.Can-18-0125
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Hu LS, Ning S, Ning S, Eschbacher JM, Gaw N, Dueck AC, Smith KA, et al. RMN multiparametric și analiza texturii pentru a vizualiza eterogenitatea histologică spațială și extinderea tumorii în glioblastom. PLoS ONE. (2015) 10:e0141506. doi: 10.1371/journal.pone.0141506
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Florez E, Nichols T, Parker EE, Lirertte ST, Howard CM, Fatemi A. Imagistica prin rezonanță magnetică multiparametrică în evaluarea tumorilor cerebrale primare prin caracteristici radiomice: o metrică pentru planificarea ghidată a tratamentului cu radiații. Cureus. (2018) 10:e3426. doi: 10.7759/cureus.3426
PubMed Abstract | CrossRef Full Text | Google Scholar
23. Mahmoud-Ghoneim D, Alkaabi MK, de Certaines JD, Goettsche MF. Impactul gamei dinamice a imaginii asupra clasificării texturii materiei albe a creierului. BMC Med Imaging. (2008) 8:18. doi: 10.1186/1471-2342-8-18
PubMed Abstract | Full Text | Google Scholar
24. Ahn SY, Park CM, Park CM, Park SJ, Kim HJ, Song C, Lee SM, et al. Prognostic value of computed tomography texture features in non-small cell lung cancers treated with definitive concomitent chemoradiotherapy. Invest Radiol. (2015) 50:719-25. doi: 10.1097/rli.0000000000000174
PubMed Abstract | Refef Full Text | Google Scholar
25. Suh HB, Choi YS, Choi YS, Bae S, Ahn SS, Chang JH, Kang SG, et al. Primary central nervous system lymphoma and atypical glioblastoma: Differentiation using radiomics approach. Eur Radiol. (2018) 28:3832-9. doi: 10.1007/s00330-018-5368-4
PubMed Abstract | Full CrossRef Text | Google Scholar
26. Mouthuy N, Cosnard G, Abarca-Quinones J, Michoux N. Imagistica prin rezonanță magnetică multiparametrică pentru diferențierea gliomelor de grad înalt și a metastazelor cerebrale. J Neuroradiol. (2012) 39:301-7. doi: 10.1016/j.neurad.2011.11.002
PubMed Abstract | Reflect Full Text | Google Scholar
27. Glotsos D, Spyridonos P, Cavouras D, Ravazoula P, Dadioti PA, Nikiforidis G. An image-analysis system based on support vector machines for automatic grade diagnosis of brain-tumour astrocytomas in clinical routine. Med Inform Internet Med. (2005) 30:179-93. doi: 10.1080/14639230500077444
PubMed Abstract | CrossRef Full Text | Google Scholar
28. Dellacasa Bellingegni A, Gruppioni E, Colazzo G, Davalli A, Sacchetti R, Guglielmelli E, et al. NLR, MLP, SVM și LDA: o analiză comparativă a datelor EMG de la persoane cu amputație trans-radială. J Neuroeng Rehabil. (2017) 14:82. doi: 10.1186/s12984-017-0290-6
PubMed Abstract | CrossRefef Full Text | Google Scholar
29. Ion-Margineanu A, Van Cauter S, Sima DM, Maes F, Sunaert S, Himmelreich U, et al. Classifying glioblastoma multiforme follow-up progressive vs. responsive forms using multi-parametric MRI features. Front Neurosci. (2016) 10:615. doi: 10.3389/fnins.2016.00615
PubMed Abstract | Reflect Full Text | Google Scholar
30. Fetit AE, Novak J, Peet AC, Arvanitits NT. Caracteristicile texturale tridimensionale ale RMN convenționale îmbunătățesc clasificarea diagnostică a tumorilor cerebrale la copii. NMR Biomed. (2015) 28:1174-84. doi: 10.1002/nbm.3353
PubMed Abstract | FullRef Text | Google Scholar
31. Sun K, Huang SH, Huang SH, Wong DS, Jang SS. Proiectarea și aplicarea unei metode de selecție a variabilelor pentru rețeaua neuronală perceptron multistrat cu LASSO. IEEE Trans Neural Netw Learn Syst. (2017) 28:1386-96. doi: 10.1109/tnnls.2016.2542866
PubMed Abstract | Reflect Full Text | Google Scholar
32. Louis DN, Perry A, Perry A, Reifenberger G, von Deimling A, Figarella-Branger D, Cavenee WK, et al. The 2016 World Health Organization classification of tumors of the central nervous system: a summary. Acta Neuropathol. (2016) 131:803-20. doi: 10.1007/s00401-016-1545-1
PubMed Abstract | CrossRef Full Text | Google Scholar
.




