Inhibiția enzimatică
Enzimele sunt necesare pentru majoritatea, dacă nu chiar pentru toate procesele necesare vieții. Enzimele catalizează o reacție prin reducerea energiei de activare necesare pentru ca reacția să aibă loc. Cu toate acestea, enzimele trebuie să fie strict reglementate pentru a se asigura că nivelurile de produs nu cresc la niveluri nedorite. Acest lucru se realizează prin inhibiția enzimatică.
Tipuri de inhibiție
Inhibitorii reversibili și ireversibili sunt substanțe chimice care se leagă de o enzimă pentru a-i suprima activitatea. O metodă de a realiza acest lucru este de a se lega aproape permanent de o enzimă. Aceste tipuri de inhibitori se numesc ireversibili. Cu toate acestea, alte substanțe chimice se pot lega tranzitoriu de o enzimă. Aceștia sunt numiți reversibili. Inhibitorii reversibili se leagă fie la un situs activ (inhibitori competitivi), fie la un alt situs al enzimei (inhibitori necompetitivi).
 Fig 1 – Diagramă pentru a arăta efectul inhibitorilor enzimatici competitivi și necompetitivi.
Fig 1 – Diagramă pentru a arăta efectul inhibitorilor enzimatici competitivi și necompetitivi.Inhibitori competitivi
Inhibitorii competitivi concurează cu substratul la situsul activ și, prin urmare, cresc Km (constanta Michaelis-Menten). Cu toate acestea, Vmax rămâne neschimbat deoarece, cu o concentrație suficientă de substrat, reacția se poate finaliza în continuare. Graficul grafic al activității enzimei în funcție de concentrația de substrat ar fi deplasat spre dreapta din cauza creșterii Km, în timp ce graficul Lineweaver-Burke ar fi mai abrupt în comparație cu absența inhibitorului.
Inhibitori necompetitivi
Inhibitorii necompetitivi se leagă de o altă locație a enzimei și, ca atare, scad VMAX. Cu toate acestea, KM rămâne neschimbat. Acest lucru este demonstrat de un maxim mai mic pe un grafic care trasează activitatea enzimatică în funcție de concentrația de substrat și o intersecție y mai mare pe un grafic Lineweaver-Burke, în comparație cu absența inhibitorului.
| Competitiv | Non-competitiv | |
| Unde acționează? | Situație activă | Situație alternativă |
| Schimbare de Km | Creștere | Nu se schimbă |
| Schimbare de Vmax | Nu se modifică | Diminuare |
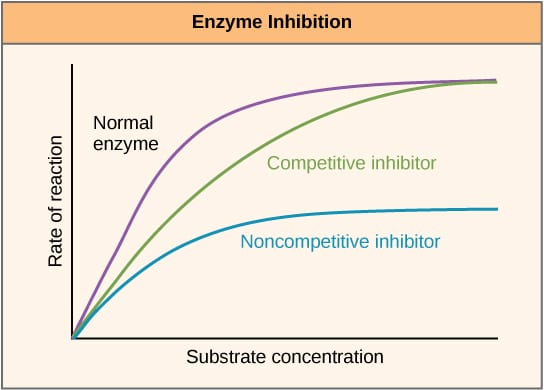 Fig 2 – Fig 2. Diagramă pentru a arăta efectul inhibitorilor enzimatici asupra vitezei de reacție și modul în care aceasta variază în funcție de concentrația substratului.
Fig 2 – Fig 2. Diagramă pentru a arăta efectul inhibitorilor enzimatici asupra vitezei de reacție și modul în care aceasta variază în funcție de concentrația substratului.Inhibiția alosterică
Enzimele alosterice prezintă o curbă sigmoidală în contrast cu curba hiperbolică prezentată de enzimele Michaelis-Menten. Acest lucru se datorează faptului că majoritatea enzimelor alosterice conțin mai multe subunități care se pot afecta reciproc atunci când substratul se leagă de enzimă. Inhibiția poate afecta fie K0.5, care este concentrația de substrat pentru semisaturație, fie Vmax sau ambele. Acest lucru are ca rezultat o deplasare a curbei spre dreapta, iar în cazul reducerii Vmax, deplasează curba în jos.
Enzimele alosterice au două stări: o stare de afinitate scăzută denumită starea „T” și starea de afinitate ridicată „R”. Inhibitorii acționează prin legarea preferențială la starea T a unei enzime alosterice, determinând enzima să mențină această stare de afinitate scăzută.
Acest lucru este extrem de util pentru a limita cantitatea de produs al unei enzime, deoarece produsul poate continua apoi să inhibe același tip de enzimă pentru a se asigura că cantitatea de produs nu este excesivă. Acest lucru este cunoscut sub numele de inhibiție prin feedback. De exemplu, ATP inhibă alosteric piruvat kinaza pentru a preveni formarea crescută de piruvat, astfel încât, în cele din urmă, se formează mai puțin ATP. În plus, fosfofructokinaza este inhibată alosteric de citrat, un intermediar al ciclului lui Kreb. Acest lucru înseamnă că glicoliza va fi limitată atunci când există o generare mare de ATP din ciclul lui Kreb.
 Fig 3 – Diagramă pentru a arăta mecanismul atât al inhibiției cât și al activării alosterice.
Fig 3 – Diagramă pentru a arăta mecanismul atât al inhibiției cât și al activării alosterice.
Fosforilarea
Fosforilarea oferă un alt mecanism prin care enzimele pot fi inhibate. Aceasta are loc de obicei prin acțiunea enzimelor kinaze, care pot inhiba sau activa o enzimă în funcție de situație. Enzimele kinazice scindă o grupare fosfat din ATP și o leagă de enzimă. În situațiile în care acest lucru duce la o creștere a activității enzimei, se creează o reacție în cascadă, permițând generarea unui răspuns mare de la un stimul mic.
Zimogeni
Enzimele pot fi, de asemenea, secretate într-o stare inactivă, care se numesc zimogeni. Zimogenii sunt un mecanism util care permite ca enzimele să fie transportate în siguranță în diferite locații, fără ca enzima să devină activă și să-și îndeplinească funcția pe parcurs. Ele rămân inactive datorită unui adaos de aminoacizi în proteină. Prin urmare, pentru a activa un zimogen, o altă enzimă trebuie să scindeze acești aminoacizi suplimentari. De exemplu, chimotripsinogenul este sintetizat de pancreas, dar este inactivat și nu poate funcționa. Când ajunge în intestine, o altă enzimă (tripsina) scindează aminoacizii suplimentari pentru a produce forma activată, chimotripsina.
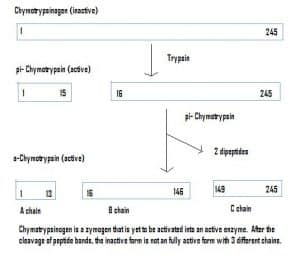 Fig. 4 – Diagramă care arată activarea chimotripsinogenului în cadrul sistemului gastrointestinal și enzimele implicate în fiecare etapă.
Fig. 4 – Diagramă care arată activarea chimotripsinogenului în cadrul sistemului gastrointestinal și enzimele implicate în fiecare etapă.Relevanță clinică – Farmacocinetică
Cea mai importantă utilizare clinică a inhibiției enzimatice este utilizarea medicamentelor farmaceutice. Inhibitorii ACE sunt un tratament obișnuit pentru hipertensiune arterială. Angiotensina I este transformată în Angiotensina II prin acțiunea enzimei de conversie a angiotensinei (ACE). Cu toate acestea, Angiotensina II provoacă numeroase efecte care se referă la o creștere a tensiunii arteriale. Prin urmare, inhibitorii ACE au fost concepuți pentru a inhiba în mod competitiv acțiunea ACE, ceea ce duce la o formare mai mică de Angiotensină II și la scăderea tensiunii arteriale.
Altfel, Penicilina se leagă ireversibil de situsul activ al unei enzime numite DD-transpeptidază. DD-transpeptidaza este responsabilă de etapa finală a sintezei peretelui celular bacterian. Prin inhibarea acestei enzime, bacteriile nu pot sintetiza un perete celular și, prin urmare, nu pot susține viața.
În cele din urmă, cianura este un exemplu de inhibitor necompetitiv. Cianura se leagă de enzima finală din lanțul de transport al electronilor și împiedică această enzimă să catalizeze reacția de transformare a oxigenului în apă. Acest lucru împiedică fluxul de electroni în josul lanțului de transport al electronilor și nu poate fi generat ATP, ceea ce duce la moarte.
.




